 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: leucemia mieloide, imatinib, dasatinib, nilotinib, costo efectividad, transferibilidad, leukemia myeloid, cost-effectiveness, transferability
Abreviaturas:
BsF: Bolívares Fuertes
CHR: Complete Hematologic Response (respuesta hematológica completa)
CCyR: Complete Cytogenetic Response (respuesta citogenética completa)
CYR: Cytogenetic Response (respuesta citogenética)
DASISION: Dasatinib versus Imatinib Study in Treatment-Naïve CML-CP Patients
ENESTnd: Evaluating Nilotinib Efficacy and Safety in Clinical Trials-Newly Diagnosed Patients
ICER: Incremental Cost-Effectiveness Ratio (incremento de costo-efectividad)
IRIS: International Randomized Study of Interferon and STI571 (estudio interferón versus imatinib)
LMC: Leucemia Mieloide Crónica
PCyR: Partial Cytogenetic Response (respuesta citogenética parcial)
OS: Overal Survival (análisis de sobrevida)
PFS: Progression Free Survival (sobrevida libre de progresión de la enfermedad)
PHR: Partial Hematologic Response (respuesta hematológica parcial)
QALY: The Quality-Adjusted Life Year (años de vida ajustados por calidad)
RH: Respuesta Hematológica
RM: Respuesta Molecular
RMM: Respuesta Molecular Mayor
SAE: Serious Adverse Event (tasas de eventos adversos serios)
Objetivo: Basados en una evaluación económica de costo-efectividad del dasatinib primera línea en el tratamiento de la leucemia mieloide crónica (LMC) realizada por el Consorcio de York, y previo análisis de transferibilidad de datos, se realizó una adaptación de ésta a Colombia y Venezuela. Se compararon los costos y la relación de costo-efectividad del uso de la dosis de 100 mg/día de dasatinib versus 400 mg/día de imatinib y 600 mg/día de nilotinib para cada fase de la enfermedad, como tratamientos de primera línea, con incrementos a 140 mg/día de dasatinib, 800 mg/día de imatinib y 800 mg/día de nilotinib en una segunda línea de tratamiento. Métodos: El modelo original consideró aquellos pacientes con diagnóstico de LMC que no hubieran recibido tratamiento previo. Para realizar la adaptación de la evaluación económica se asumieron las probabilidades de cambio, para lo cual se consideraron tres fases, crónica, acelerada y muerte, a lo largo de toda la vida y con una tasa de descuento del 3,5% para los costos y beneficios. Los resultados del modelo incluyeron los costos de cada alternativa de tratamiento con dasatinib, nilotinib o imatinib y los años de vida ajustados a calidad ganada. Los costos se expresan en pesos colombianos y bolívares fuertes del año 2011. Resultados: El dasatinib produjo la mayor cantidad de años de vida ajustados a calidad, tanto para Colombia como para Venezuela con 10,67 y 10,53 QALYs respectivamente, en comparación con 10,10 y 9,97 QALYs en cada caso para el imatinib y 10,50 y 10,36 QALYs para el nilotinib. Los costos esperados por QALY en Colombia fueron de $ 108.174.020 para el dasatinib, $ 80.826.556 para el imatinib y $ 134.747.281 para el nilotinib. En Venezuela fueron de BsF 222.970 para el dasatinib, BsF 213.142 para el imatinib y BsF 269.193 para el nilotinib. El dasatinib fue dominante sobre el nilotinib en ambos países. Conclusiones: El dasatinib fue más efectivo que el imatinib y el nilotinib, además mostró mejores índices de costo-efectividad que el nilotinib siendo dominante en ambos países. Aunque hubo un aumento de los costos en general, esto se debe al aumento en los años de vida ganados y, por lo tanto, a un mayor uso de recursos médicos y medicamentos.
El actual estándar de tratamiento para la Leucemia Mieloide Crónica (LMC) es el mesilato de imatinib oral (Gleevec ®, Glivec ®), siguiendo las recomendaciones de diversos organismos de evaluación de tecnologías sanitarias en diversos países. El tratamiento con imatinib ha demostrado altas tasas de respuesta y un mejor pronóstico, especialmente en los pacientes recién diagnosticados con LMC en fase crónica1,2. Sin embargo, una gran preocupación sobre el uso de imatinib es la aparición de resistencia. Una respuesta duradera con imatinib es difícil de lograr en los pacientes con resistencia previa, aún con dosis altas. Teniendo en cuenta las limitaciones para el trasplante de médula ósea, las opciones de tratamiento en la LMC se limitan tras el fracaso de imatinib.
En el año 2006 fue aprobado en Estados Unidos y en la Unión Europea el medicamento dasatinib, un inhibidor multiobjetivo de la tirosin-kinasa BCR-ABL, SRC, c-Kit, eprhrin y PDGFR, que ha demostrado ser seguro y efectivo en las tres fases de la LMC cromosoma Filadelfia positivo3,4,5. Una respuesta durable, tanto hematológica como citogenética, ha sido demostrada con el dasatinib en un número de estudios clínicos fase II, en pacientes con LMC6,7,8,9,10.
También se ha propuesto la utilización de otro medicamento inhibidor de la SRC-ABL kinasa como es el nilotinib a dosis de 600 a 800 mg en la fase crónica y en la fase acelerada11. En octubre de 2010 The York Health Economics Consortium, presentó para Bristol Myers Squibb el reporte final de la investigación “An Economic Evaluation of Dasatinib in the First-Line Treatment of Patients with Chronic Myelogenous Leukaemia"12. Este trabajo, fundamentado en los hallazgos de los ensayos clínicos DASISION13 y ENESTnd14, mostró que el medicamento dasatinib está asociado con un incremento en la expectativa de vida y en los años de vida ajustados por calidad (QALYs por sus siglas en inglés Quality Adjusted Life Year) con un costo efectivo incrementado de 36,435 libras por QALY, y en la gran mayoría, los costos aumentados se debían a un incremento en la expectativa de vida asociada con el tratamiento con dasatinib.
La eficacia del tratamiento de la LMC puede ser medido a nivel hematológico, citogenético y molecular. Una respuesta hematológica (RH) se mide por la cantidad de células inmaduras en un conteo sanguíneo completo después del tratamiento. La respuesta hematológica puede ser completa (CHR) o parcial (PHR). Una respuesta citogenética (CyR) después del tratamiento se mide por la cantidad de células con el cromosoma Ph+. Una respuesta citogenética completa (CCyR) como presencia de 0% de Ph+ en las células y respuesta citogenética parcial (PCyR) como un 1% a 34% de células Ph+. Una respuesta molecular (RM) se mide por la cantidad de BCR-ABL en la médula ósea o la sangre periférica. Una respuesta molecular mayor (RMM) se ha definido como ≥3-log reducción de BCR-ABL. Niveles más profundos de la respuesta se han asociado con un mejor pronóstico de la LMC. En la actualidad, un CyR es el marcador de la lucha contra la enfermedad en el largo plazo, ya que existe una fuerte relación entre CyR y supervivencia15,16.
El presente trabajo adapta el modelo analítico a las condiciones de costos, de práctica médica y de mortalidad en estos dos países. Teniendo en cuenta que existe concordancia entre las guías y protocolos latinoamericanos e ingleses en el manejo de la LMC y que se requiere explorar alternativas de acción para el manejo de pacientes tanto en la fase crónica como en las fases acelerada y blástica, es importante hacer un análisis de costos y de costo efectividad de los medicamentos dasatinib, imatinib y nilotinib. Este trabajo hace una evaluación económica de dasatinib en el tratamiento de la LMC en pacientes que no han recibido tratamiento previo, en comparación con los medicamentos imatinib y nilotinib, utilizando para ello la adaptación del modelo desarrollado por el Consorcio de Economía de la Salud de York.
Considerando que los actuales resultados de efectividad clínica de los medicamentos bloqueadores de la tirosin-kinasa en pacientes con LMC están reportados en estudios de corto plazo, y que es posible que los costos y los beneficios continúen durante el resto de la vida, es necesario pensar en un modelo predictivo que nos permita dar respuesta a esta interrogante.
Para tal fin, el consorcio de York usó un modelo con la información disponible en el corto plazo y construyó sobre la misma el modelo predictivo de los costos y beneficios para el resto de la vida del paciente, asociados con los diferentes tratamientos. El enfoque de un modelo de Markov permite asumir las probabilidades de cambio en los diferentes estadios de salud de la enfermedad y, por ende, los efectos sobre los resultados y costos para los diferentes tratamientos. El modelo consideró la evaluación de dos estadios de la LMC, la fase crónica y la fase progresiva. También incluyó la muerte en el modelo.
Los pacientes recibieron dasatinib, imatinib o nilotinib como tratamiento de primera línea con la posibilidad de cambiar a un tratamiento de segunda línea después de doce meses. Adicionalmente, los pacientes cambian a "tratamiento post falla" cuando pasan a la fase progresiva.
El trasplante de médula ósea fue excluido del modelo como tratamiento directo debido a que en el ensayo clínico International Randomized Study of Interferon and STI571 (IRIS), de donde se tomaron datos de progresión para el modelo, el impacto del trasplante ya fue incluido indirectamente.
En la Figura 1 se muestra el diagrama de la estructura del modelo y las posibilidades de cambio entre un estado y otro, incluyendo la muerte. Para cada secuencia de tratamiento se calcularon los resultados y los costos. Lo resultados se efectuaron en términos de años de vida ganados y de años de vida ajustados por calidad. Los costos, se calcularon en términos de los recursos utilizados en cada estado multiplicados por el costo de cada unidad de recurso. Para el desarrollado del modelo, The York Consortium usó un paquete de Microsoft Excel con periodos mensuales con probabilidades de cambio de un paciente de un estado a otro durante cada período.
Los costos fueron calculados desde la perspectiva del proveedor, es decir, desde el Sistema Nacional de Salud de Inglaterra (NHS en inglés). El horizonte de tiempo para el análisis fue desde el comienzo del tratamiento y durante toda la vida del paciente hasta su muerte. Se consideraron aquellos pacientes con diagnóstico de LMC que no hubieran recibido tratamiento previo. Para el caso de la adaptación del modelo a Colombia y Venezuela, se debieron considerar los costos de acuerdo al medio.
Figura 1. Estructura del modelo de Markov.
Se incluyeron en el presente trabajo pacientes con LMC sin discriminación de sexo. Se asumió un promedio de edad de 55 años al comienzo del tratamiento. Teniendo en cuenta que el diseño del modelo es de tipo determinístico, todos los costos y resultados esperados en salud son reportados por paciente. Sin embargo, para el modelo de Markov se utiliza una cohorte hipotética inicial de 1.000 pacientes.
Las probabilidades de respuesta para el dasatinib e imatinib se basaron en los datos del ensayo clínico DASISISON y del ensayo clínico ENESTnd para el caso del nilotinib. Estas tasas de respuesta se aplicaron en el modelo para determinar el pronóstico esperado del paciente, el cual se basó en la mejor respuesta a doce meses.
Para evaluar la posibilidad de hacer la transferibilidad del modelo, se asumieron las recomendaciones de la fuerza de tareas en buenas prácticas de investigación en transferibilidad de data en evaluación de tecnología en salud17.
De acuerdo al análisis realizado al modelo de Bristol-Myers Squibb y los ensayos clínicos y evaluaciones de costo-efectividad utilizados, se encontró que los supuestos iníciales eran relevantes para Colombia y Venezuela. En segundo lugar, se encontró que se podían asumir el mismo horizonte de tiempo e iguales tasas de descuento18.
Adicionalmente, se realizó un análisis comparativo entre los patrones de manejo médico contemplados en los estudios clínicos y evaluaciones económicas referenciadas, con los patrones médicos colombianos y venezolanos utilizados para el tratamiento de los diferentes estados de la LMC, no encontrándose diferencias relevantes entre éstos19.
Revisados los trabajos de investigación citados en el modelo, encontramos que en la gran mayoría de éstos se incluyeron todos los pacientes con LMC, independientemente de la presencia de otras comorbilidades y no se realizó ningún tipo de selección muestral con exclusión por grupo étnico o procedencia.
Las tasas de mortalidad varían para cada entorno, por lo que se asumieron las tasas de mortalidad del observatorio de salud global de la Organización Mundial de la Salud para Colombia y Venezuela actualizadas al año 200920.
Consideramos entonces que, de acuerdo a la evaluación realizada, era posible hacer la transferibilidad del modelo a Colombia y Venezuela efectuando ajustes a los costos y a las tasas de mortalidad y conservando los patrones de tratamiento, la efectividad, utilidades y probabilidades de transición entre un estado de salud y otro, incluyendo la probabilidad de abandono de la primera línea de tratamiento o de la segunda, así como el tratamiento post falla.
Dentro del análisis de transferibilidad del trabajo de York, se tuvo como primer criterio la relevancia y pertinencia del trabajo al entorno colombiano y venezolano. Se encontró que el trabajo tenía una etapa clara de definición del problema y del objetivo, además del modelo a emplear el cual fue consistente con la perspectiva, el alcance y los objetivos del mismo.
Los supuestos del modelo fueron transparentes y estuvieron adecuadamente justificados. Las opciones fueron claramente definidas y sustentadas. Estas alternativas, junto con los diferentes estados de la leucemia, reflejaron adecuadamente los estados de la enfermedad y del cuadro clínico subyacente y los ciclos fueron definidos en términos de la historia natural de la enfermedad.
Las fuentes de los datos de efectividades fueron adecuadamente seleccionadas y los datos fueron apropiadamente utilizados dentro del modelo. A partir de éstos se calcularon debidamente las probabilidades de transición entre estados. Tanto para los costos como para las utilidades incorporados al modelo, estuvieron bien referenciadas y justificadas, realizándose en forma transparente. Finalmente, los resultados del modelo fueron bien y suficientemente explicados y justificados. Teniendo en cuenta este análisis, se concluyó que el modelo no sólo era relevante y pertinente al entorno colombiano y venezolano, sino que cumplía con los criterios de calidad para ello.
De acuerdo al modelo enunciado, se usaron ciclos mensuales para calcular la progresión de la enfermedad y el uso de recursos. Al final del primer periodo, los pacientes en la fase crónica, acelerada o blástica se enfrentaban a uno de los siguientes resultados:
Las probabilidades de respuesta se basaron en los datos de 12 meses del ensayo clínico DASISION19 para dasatinib e imatinib y en los datos de 12 meses del ensayo clínico Nilotinib primera línea ENESTnd20. Las tasas aplicadas para determinar el pronóstico del paciente se fundaron en la mejor respuesta en los 12 meses.
El modelo contempla tres líneas iniciales de tratamiento para pacientes con LMC a saber: imatinib, dasatinib o nilotinib. Luego pueden cambiar a una de las otras dos alternativas o permanecer en el mismo tratamiento antes de cambiar a tratamiento de post falla.
Hay dos importantes razones para descontinuar el tratamiento. La primera es que el paciente descontinúe el tratamiento, lo cual se relaciona con la respuesta al primer año, y la segunda razón se asocia con la necesidad de cambiar de tratamiento en relación con la progresión de la enfermedad.
Los datos de respuesta para dasatinib 100 mg e imatinib 400 mg fueron tomados por los investigadores del York Consortium del ensayo clínico CA180-056. La respuesta para el nilotinib fue tomado del ensayo ENESTnd.
La Tabla I muestra la mejor respuesta al tratamiento con cada terapia, tomado del CA180-056 y del ensayo ENESTnd. Para dasatinib 100 mg e imatinib 400 mg, la mejor respuesta dentro de los 12 meses fue identificada del CA180-056. Para nilotinib 600 mg, MMR y PCER, como fue publicada en ENESTnd en Saglio et al., CCyR como mejor respuesta fue asumida como la diferencia entre CCyR (por ejemplo 80,1%) y MMR dentro de los 12 meses (44%) de ENESTnd.
La CHR como mejor respuesta para nilotinib fue calculada sobre la base de los datos publicados del CHR en Cortés et al de un 98%.
Para obtener una tasa de CHR mutuamente excluyente, se calculó la diferencia entre el total CHR y CCyR + MMR. Se asumió que los no respondedores eran la diferencia entre 100 (MMR + CCyR + CHR).
Tabla I. Mejor respuesta por tratamiento.
El pronóstico del paciente basado en la respuesta inicial al tratamiento, se calculó siguiendo el análisis de sobrevida OS (Overal Survival) y de sobrevida libre de progresión de la enfermedad PFS (Progression Free Survival), del ensayo clínico IRIS. Este contempló el seguimiento de largo plazo de una cohorte de pacientes tratados con imatinib.
Los datos fueron usados posteriormente para producir una serie de resultados sobre un potencial período de nueve años. Se generaron curvas de Kaplan-Meier para PFS y OS del ensayo IRIS de acuerdo a cada uno de los grupos de respuesta.
Teniendo en cuenta que los datos reportados en el estudio para PFS y OS fueron reportados a 60 y a 42 meses respectivamente, fue necesario hacer extrapolación de los resultados. Para esto se asumió que la tasa de progresión y de mortalidad fue igual a la observada durante el último año del ensayo publicado. Estas curvas fueron luego aplicadas a las respuestas de corto plazo al dasatinib del ensayo clínico CA180-05621 y usadas para modelar el pronóstico de largo plazo de los pacientes dentro de este modelo.
La probabilidad de discontinuar el tratamiento dependió de la terapia en uso y de la respuesta del paciente. La probabilidad de discontinuación del tratamiento de segunda línea está basada en las tasas PFS de acuerdo a mejor respuesta en CA180-034. La probabilidad de discontinuación se asume igual para los tres tratamientos.
Las tasas de eventos adversos serios SAE (Serious Adverse Event) fueron tomadas de los ensayos clínicos de primera línea DASISION y ENESTnd. Todos los SAE del dasatinib 100 mg/día, fueron tomados de DASISION y las tasas de eventos adversos del nilotinib 600 mg/día fueron tomadas del ENESTnd. Para el caso del imatinib, se tomaron datos del DASISION y del ENESTnd cuando era aplicable.
Cada ocurrencia de un SAE resulta en un aumento de los costos y una disminución de la utilidad. La frecuencia de utilización de los recursos se hizo de acuerdo a la opinión de clínicos.
La probabilidad de muerte relacionada con la leucemia depende del estado de salud en que se encuentre el paciente y su respuesta al tratamiento. Su sobrevivencia se basa en la revisión de resultados de largo plazo del ensayo clínico IRIS22.
La mortalidad no relacionada con la leucemia depende de la edad del paciente. Su sobrevivencia se calcula a partir de la terminación del seguimiento en el estudio IRIS.
Las utilidades para cada estado son presentadas en la Tabla III. Estas utilidades se multiplican por la cantidad de años que el paciente dure en cada estado de salud y así obtener los QALYs.
Tabla III. Utilidades por estado de salud.
Los principales recursos usados en el tratamiento de la LMC incluyeron medicamentos formulados, atenciones ambulatorias y exámenes paraclínicos de monitoreo. Los efectos del trasplante de medula ósea fueron indirectamente incluidos en este estudio.
Para el cálculo de los costos de los tratamientos médicos en Colombia se utilizó el Decreto 2.423 de 1996 del entonces Ministerio de Salud, actualizado al año 201123, así como los manuales tarifarios del Instituto de los Seguros Sociales24 y referentes de negociación entre aseguradores y prestadores.
En el caso de los tratamientos médicos en Venezuela se consultó a un experto que utilizó como referencia los costos en instituciones privadas clase A y C, de acuerdo a la denominación de las normas Covenin25. Estos costos son ajustados cada tres meses de acuerdo al índice inflacionario.
Tabla IV. Costos por unidad de recurso.
El promedio de los costos de los tratamientos farmacéuticos se calculó de las dosis recomendadas en un período de 12 meses, multiplicado por el costo de una simple dosis.
En la Tabla V se muestra el costo mensual de cada tratamiento. Los costos de los medicamentos fueron tomados de los reportes de las tarifas máximas permitidas para la comercialización por parte del Ministerio de Protección Social y de la Liga Colombiana Contra el Cáncer, para el caso de Colombia, y de precios ofertados en las recientes compras del IVSS (Abr-May/2011) para Venezuela. Estos precios se reportan en las respectivas monedas nacionales, es decir, pesos colombianos y bolívares fuertes del año 2010.
Tabla V. Costos por unidad de tratamiento.
A continuación presentamos los resultados de efectividad de costos y el análisis de costo efectividad incremental.
Tabla VI. Costo efectividad incremental dasatinib versus imatinib y nilotinib en Colombia.
Tabla VII. Costo efectividad incremental dasatinib versus imatinib y nilotinib en Venezuela.
Resultados de efectividad: caso base
Los pacientes tratados con dasatinib experimentaron más años de vida ganados y más QALYs comparado con los pacientes tratados con imatinib y nilotinib tanto en Colombia como en Venezuela. Con dasatinib se obtuvieron 10,7 y 10,53 QALYs en Colombia y Venezuela respectivamente en comparación 10,1 y 9,97 QALYs obtenidos con el imatinib y 10,5 y 10,36 QALYs obtenidos con el nilotinib. Igualmente se obtuvieron más años de vida ganados con el dasatinib que con el imatinib y nilotinib tanto en Colombia como en Venezuela.
Resultados de costos: caso base
Cuando el dasatinib es usado en el tratamiento de la LMC se obtiene un costo total para cada paciente de $ 1.154.324.971 y BsF 2.347.870 en Colombia y Venezuela respectivamente. Estos costos corresponden a los tratamientos farmacológicos y a los costos médicos directos incluyendo los eventos adversos severos.
Análisis incremental de costo efectividad: caso base
El tratamiento con dasatinib obtiene 0,57 y 0,56 QALYs en Colombia y Venezuela, adicionales a los obtenidos con el imatinib. También obtiene 0,17 QALYs en Colombia y Venezuela extras a los obtenidos con nilotinib.
Estos mayores QALYs obtenidos sobre el imatinib tienen un costo incremental de $ 589.214.895 y de BsF 398.603 por QALY. Con respecto al nilotinib, el dasatinib presenta dominancia en ambos países. Es decir, no solo es más efectivo, sino que también menos costoso.
Análisis de sensibilidad univariado
Además de los resultados de costos y de costo-efectividad, se realizó un análisis de sensibilidad univariado con el fin de evaluar el cambio en el ICER para diferentes cambios en variables claves. Los cambios en las variables se pueden observar en las tablas VIII y IX, tanto para el dasatinib como para los tratamientos comparados.
En el caso de Colombia el dasatinib continuó siendo dominante con respecto al nilotinib cuando se realizaron cambios en las tasas de descuento del 2% y del 5%. Sólo perdió su dominancia cuando se incrementó el valor del dasatinib en un 20% y cuando se disminuyó el valor del nilotinib, también en un 20%.
Tabla VIII. Análisis de sensibilidad univariado para Colombia.
Tabla IX. Análisis de sensibilidad univariado para Venezuela.
En Venezuela, el dasatinib continuó mostrando su dominancia sobre el nilotinib en todos los cambios de valores.
Esta adaptación del modelo de York, permitió comparar los costos y los beneficios en salud del medicamento dasatinib, asociados al tratamiento de pacientes con LMC, versus el imatinib y el nilotinib.
Este análisis permitió mostrar que el tratamiento con el dasatinib es más efectivo pero más costoso que el imatinib con un ICER de $ 589.214.895 y de BsF 398.603 por QALY, para Colombia y Venezuela respectivamente. Con respecto al nilotinib, el dasatinib fue menos costoso y más efectivo en ambos países, es decir, fue dominante.
Las principales limitaciones que el grupo de York plantea a su trabajo, se relacionan con el bajo número de casos diagnosticados con leucemia cada año. Esto hace que sea difícil obtener información confiable e información en prácticas de tratamiento y, por ende, se dificulta el estimar adecuadamente el consumo de recursos.
En esta misma línea, la limitación más relevante que expresa el consorcio de York es que el análisis usó un modelo basado en la mejor respuesta de cada tratamiento, pero a corto plazo.
En efecto, si la mejor respuesta es un buen indicador de sobrevivencia y de sobrevivencia libre de enfermedad, sería importante para el trabajo validar esta información contra datos reales. Sin embargo, todavía no se cuenta con ensayos de larga data que hayan realizado comparaciones entre los tratamientos. Por otra parte, la clave de la diferencia entre los pacientes tratados con dasatininb y nilotinib fue la tasa inicial de mejor respuesta.
Para el caso de la transferiibilidad de datos, las principales limitaciones se relacionan con los estudios clínicos. En dichos estudios, aunque no se menciona selección muestral con sesgos por grupos étnicos o por ingresos económicos, el hecho de corresponder a países con características idiosincráticas diferentes, puede introducir un sesgo en la adaptación del modelo.
La segunda limitación está relacionada con la valoración de los estados de salud, lo cual se basa en la percepción de la población inglesa. No obstante, mientras en nuestros países no se tenga valores estandarizados para los diferentes estados de salud, necesariamente deberemos tomar referencias foráneas.
La presente adaptación del modelo permitió comparar los costos y los beneficios en salud asociados al tratamiento de los pacientes con Leucemia Mieloide Crónica con dasatinib versus imatinib y nilotinib. El análisis mostró que el dasatinib fue más efectivo que el imatinib y el nilotinib en términos de QALYs y de años de vida ganados, tanto en Colombia como en Venezuela.
En ambos países, el dasatinib fue dominante con respecto al nilotinib. Sin embargo, debido al aumento de los costos el ICER con respecto al imatinib fue de $ 589.214.895 y de BsF 398.603 para Colombia y Venezuela respectivamente.
Los mayores costos se dieron en el tratamiento de primera línea y fueron menores en el tratamiento de segunda línea para el dasatinib en ambos países.
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE traducido al castellano por Medwave, y declaran que este estudio recibió apoyo financiero de Bristol-Myers Squibb. John J. Orozco declara ser docente e investigador de la Universidad CES, y Juan E. Valencia declara ser Associate HEOR Manager en Bristol-Myers Squibb. Los autores declaran no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor principal.
Al tratarse de una adaptación de un modelo de evaluación económica previamente realizado, durante el análisis de transferibilidad sólo se utilizaron del trabajo original las probabilidades de cambio entre estados, tomadas a su vez de estudios clínicos previamente publicados. Para recalcular los resultados para Colombia y Venezuela se tomaron datos generales relacionados con costos de los medicamentos y de los tratamientos médicos directos, así como las probabilidades de muertes publicadas por la Organización Mundial de la Salud.

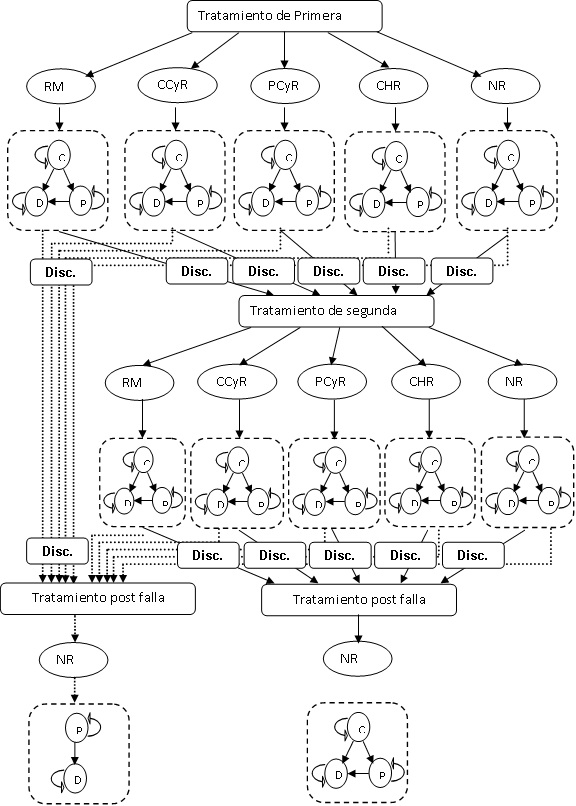 Figura 1. Estructura del modelo de Markov.
Figura 1. Estructura del modelo de Markov.

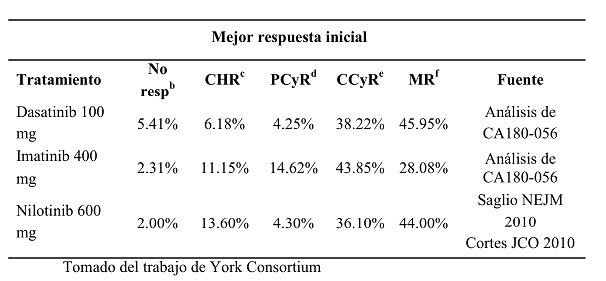 Tabla I. Mejor respuesta por tratamiento.
Tabla I. Mejor respuesta por tratamiento.

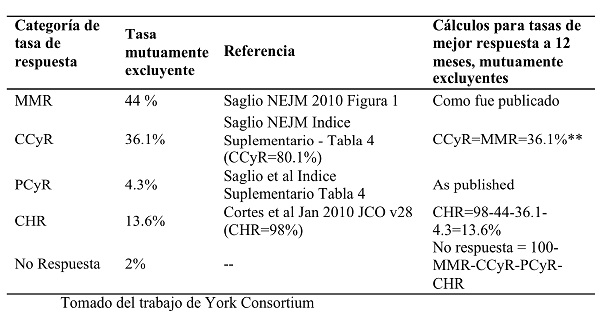 Tabla II. Referencias y cálculos para mutuamente excluyentes mejores tasas de respuesta a los 12 meses para nilotinib 300 mgs. dos veces al día.
Tabla II. Referencias y cálculos para mutuamente excluyentes mejores tasas de respuesta a los 12 meses para nilotinib 300 mgs. dos veces al día.

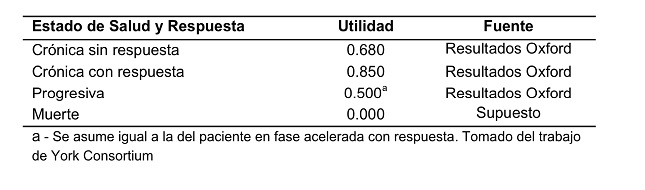 Tabla III. Utilidades por estado de salud.
Tabla III. Utilidades por estado de salud.

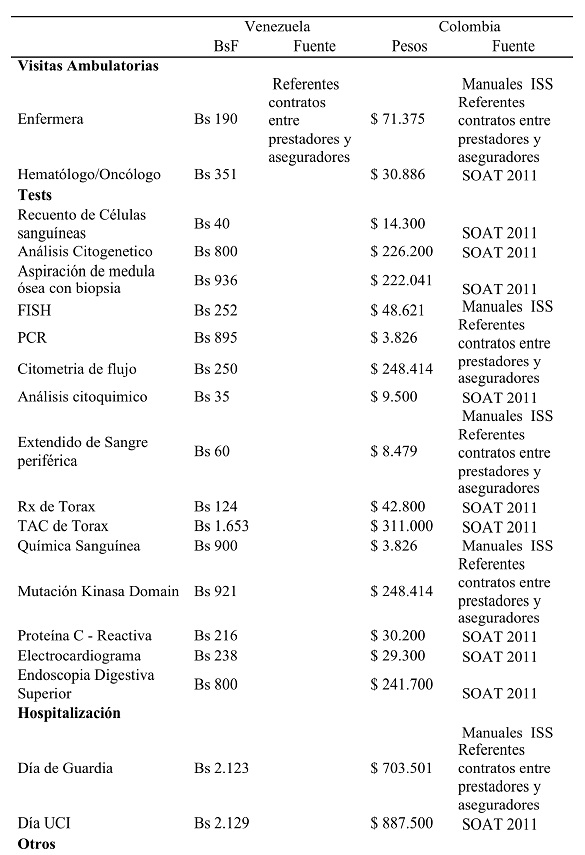 Tabla IV. Costos por unidad de recurso.
Tabla IV. Costos por unidad de recurso.

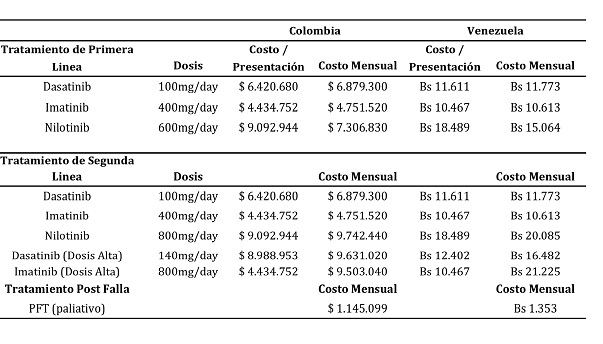 Tabla V. Costos por unidad de tratamiento.
Tabla V. Costos por unidad de tratamiento.

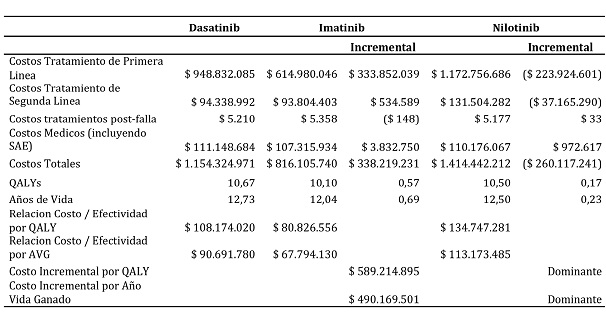 Tabla VI. Costo efectividad incremental dasatinib versus imatinib y nilotinib en Colombia.
Tabla VI. Costo efectividad incremental dasatinib versus imatinib y nilotinib en Colombia.

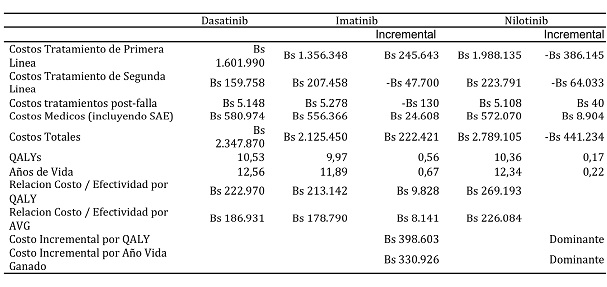 Tabla VII. Costo efectividad incremental dasatinib versus imatinib y nilotinib en Venezuela.
Tabla VII. Costo efectividad incremental dasatinib versus imatinib y nilotinib en Venezuela.

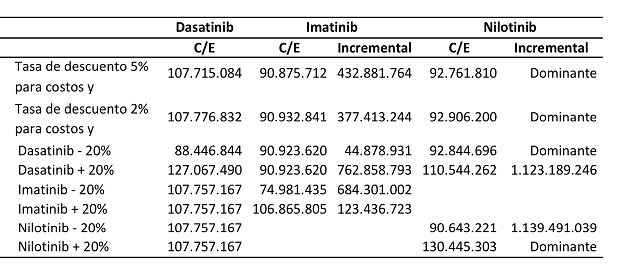 Tabla VIII. Análisis de sensibilidad univariado para Colombia.
Tabla VIII. Análisis de sensibilidad univariado para Colombia.

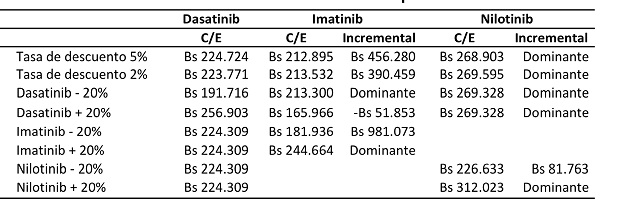 Tabla IX. Análisis de sensibilidad univariado para Venezuela.
Tabla IX. Análisis de sensibilidad univariado para Venezuela.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Objective: To adapt an economic model of frontline dasatinib treatment for chronic myeloid leukemia developed by the York Consortium to the health care settings in Colombia and Venezuela. Methods: The original model considered treatment of naïve patients with CML and a Markov's model with probabilities of change between chronic, accelerated phases and death, over a patient’s lifetime. The applied discount rate is 3.5% for both costs and benefits. Direct medical and treatment costs, and mortality rates were taken from the local published data and WHO life tables. Costs are expressed in 2011 Colombian pesos and Venezuelan strong bolivars. Results: Dasatinib 100 mg/day as frontline treatment for CML produced the greatest number of QALYs, both in Colombia and Venezuela with 10.67 and 10.53 QALYs respectively, compared with 10.10 and 9.97 QALYs for imatinib and 10.50 and 10.36 QALYs for nilotinib. The expected cost per QALY in Colombia was $ 108.174.020 for dasatinib, $ 80.826.556 for imatinib and $ 134.747.281 for nilotinib. The expected cost per QALY in Venezuela was BsF 222.970 for dasatinib, BsF 213.142 for imatinib and BsF 269.193 for nilotinib. Dasatinib was dominant to nilotinib in both countries. Conclusions: In the frontline treatment for CML in Colombia and Venezuela, dasatinib had greater QALYs than both imatinib and nilotinib, and demonstrated cost-effectiveness relative to nilotinib. There was an increase in overall costs, due to the increase in life years gained and thus a greater use of overall health care resources.
 Autores:
Juan E. Valencia[1], John J. Orozco[2]
Autores:
Juan E. Valencia[1], John J. Orozco[2]

Citación: Valencia JE, Orozco JJ. Adaptation to Colombia and Venezuela of the economic model Dasatinib first-line treatment of chronic myeloid leukemia, developed by the York Health Economics Consortium. Medwave 2012 May;12(4):e5348 doi: 10.5867/medwave.2012.04.5348
Fecha de envío: 1/1/2012
Fecha de aceptación: 15/3/2012
Fecha de publicación: 1/5/2012
Origen: no solicitado, ingresado por FTS
Tipo de revisión: con revisión externa por 3 revisores, a doble ciego
Citaciones asociadas
1. Romero M, Chávez D, De los Ríos M, Alvis-Guzmán N. Cost effectiveness of nilotinib, dasatinib and imatinib as first-line treatment for chronic myeloid leukemia in Colombia, 2012. Biomédica. 2014;34(1). | Link |

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Reksodiputro AH, Syafei S, Prayogo N, Karsono B, Rinaldi I, Rajabto W, et al. Clinical characteristics and hematologic responses to Imatinib in patients with chronic phase myeloid leukemia (CML) at Cipto Mangunkusumo Hospital. Acta Med Indones. 2010 Jan;42(1):2-5. | PubMed |
Reksodiputro AH, Syafei S, Prayogo N, Karsono B, Rinaldi I, Rajabto W, et al. Clinical characteristics and hematologic responses to Imatinib in patients with chronic phase myeloid leukemia (CML) at Cipto Mangunkusumo Hospital. Acta Med Indones. 2010 Jan;42(1):2-5. | PubMed | Garside R, Round A, Dalziel K, Stein K, Royle P. The effectiveness and cost-effectiveness of imatinib in chronic myeloid leukaemia: a systematic review. Health Technol Assess. 2002;6(33):1-162. | PubMed |
Garside R, Round A, Dalziel K, Stein K, Royle P. The effectiveness and cost-effectiveness of imatinib in chronic myeloid leukaemia: a systematic review. Health Technol Assess. 2002;6(33):1-162. | PubMed | Cortes J, Rousselot P, Kim DW, Ritchie E, Hamerschlak N, Coutre S, et al. Dasatinib induces complete hematologic and cytogenetic responses in patients with imatinib-resistant or -intolerant chronic myeloid leukemia in blast crisis. Blood. 2007 Apr 15;109(8):3207-13. | CrossRef | PubMed |
Cortes J, Rousselot P, Kim DW, Ritchie E, Hamerschlak N, Coutre S, et al. Dasatinib induces complete hematologic and cytogenetic responses in patients with imatinib-resistant or -intolerant chronic myeloid leukemia in blast crisis. Blood. 2007 Apr 15;109(8):3207-13. | CrossRef | PubMed | Hochhaus A, Kantarjian HM, Baccarani M, Lipton JH, Apperley JF, Druker BJ, et al. Dasatinib induces notable hematologic and cytogenetic responses in chronic phase chronic myeloid leukemia after failure of imatinib therapy. Blood. 2007 Sep 1;110(5):1438. | CrossRef |
Hochhaus A, Kantarjian HM, Baccarani M, Lipton JH, Apperley JF, Druker BJ, et al. Dasatinib induces notable hematologic and cytogenetic responses in chronic phase chronic myeloid leukemia after failure of imatinib therapy. Blood. 2007 Sep 1;110(5):1438. | CrossRef | Coutre S, Martinelli G, Dombret H, Hochhaus R, Larson G, Saglio A, et al. Dasatinib (D) in patients (pts) with chronic myelogenous leukemia (CML) in lymphoid blast crisis (LB-CML) or Philadelphia-chromosome positive acute lymphoblastic leukemia (Ph_ALL) who are imatinib (IM)-resistant (IM-R) or intolerant (IM-I): the CA180015 ’START-L’ study. J Clin Oncol. 2006 Jun;24(18) suppl 6528. | Link |
Coutre S, Martinelli G, Dombret H, Hochhaus R, Larson G, Saglio A, et al. Dasatinib (D) in patients (pts) with chronic myelogenous leukemia (CML) in lymphoid blast crisis (LB-CML) or Philadelphia-chromosome positive acute lymphoblastic leukemia (Ph_ALL) who are imatinib (IM)-resistant (IM-R) or intolerant (IM-I): the CA180015 ’START-L’ study. J Clin Oncol. 2006 Jun;24(18) suppl 6528. | Link | Quinta's-Cardama A, Kantarjian H, Jones D, Talpaz M, Jabbour E, O’Brien S, et al. Dynamics of molecular response to dasatinib (BMS-354825) in patients (pts) with chronic myelogenous leukemia (CML) resistant or intolerant to imatinib. J Clin Oncol. 2006;24(Suppl):6525. | Link |
Quinta's-Cardama A, Kantarjian H, Jones D, Talpaz M, Jabbour E, O’Brien S, et al. Dynamics of molecular response to dasatinib (BMS-354825) in patients (pts) with chronic myelogenous leukemia (CML) resistant or intolerant to imatinib. J Clin Oncol. 2006;24(Suppl):6525. | Link | Talpaz M, Shah NP, Kantarjian H, Donato N, Nicoll J, Paquette R, et al. Dasatinib in imatinib-resistant Philadelphia chromosomepositive leukemias. N Engl J Med. 2006 Jun 15;354(24):2531-41. | CrossRef | PubMed |
Talpaz M, Shah NP, Kantarjian H, Donato N, Nicoll J, Paquette R, et al. Dasatinib in imatinib-resistant Philadelphia chromosomepositive leukemias. N Engl J Med. 2006 Jun 15;354(24):2531-41. | CrossRef | PubMed | O'Hare T, Walters DK, Stoffregen EP, Sherbenou DW, Heinrich MC, Deininger MW, et al. Combined Abl inhibitor therapy for minimizing drug resistance in chronic myeloid leukemia: Src/Abl inhibitors are compatible with imatinib. Clin Cancer Res. 2005 Oct 1;11(19 Pt 1):6987-93. | CrossRef | PubMed |
O'Hare T, Walters DK, Stoffregen EP, Sherbenou DW, Heinrich MC, Deininger MW, et al. Combined Abl inhibitor therapy for minimizing drug resistance in chronic myeloid leukemia: Src/Abl inhibitors are compatible with imatinib. Clin Cancer Res. 2005 Oct 1;11(19 Pt 1):6987-93. | CrossRef | PubMed | Shah NP, Tran C, Lee FY, Chen P, Norris D, Sawyers CL. Overriding imatinib resistance with a novel ABL kinase inhibitor. Science. 2004 Jul 16;305(5682):399-401. | CrossRef | PubMed |
Shah NP, Tran C, Lee FY, Chen P, Norris D, Sawyers CL. Overriding imatinib resistance with a novel ABL kinase inhibitor. Science. 2004 Jul 16;305(5682):399-401. | CrossRef | PubMed | Tokarski J, Newitt J, Lee F, Lombardo L, et al. The crystal structure of Abl kinase with BMS-354825, a dual SRC/ABL kinase inhibitor. Blood 2004;104:553.
Tokarski J, Newitt J, Lee F, Lombardo L, et al. The crystal structure of Abl kinase with BMS-354825, a dual SRC/ABL kinase inhibitor. Blood 2004;104:553.  Rosti G, le Coutre P, Bhalla K, Giles F, Ossenkoppele G, Hochhaus A, et al. A phase II study of nilotinib administered to imatinib resistant and intolerant patients with chronic myelogenous leukemia (CML) in chronic phase (CP). Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings Part I. 2007 Jun;25(18S): 7007. | Link |
Rosti G, le Coutre P, Bhalla K, Giles F, Ossenkoppele G, Hochhaus A, et al. A phase II study of nilotinib administered to imatinib resistant and intolerant patients with chronic myelogenous leukemia (CML) in chronic phase (CP). Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings Part I. 2007 Jun;25(18S): 7007. | Link | Taylor M, Patton TC. An Economic Evaluation of Dasatinib in the First-Line Treatment of Patients with Chronic Myelogenous Leukaemia. York Health Economic consortium. Bristol-Myers SQUIBB, October 2010.
Taylor M, Patton TC. An Economic Evaluation of Dasatinib in the First-Line Treatment of Patients with Chronic Myelogenous Leukaemia. York Health Economic consortium. Bristol-Myers SQUIBB, October 2010.  Kantarjian H, O’Brien S, Talpaz M, et al. Dasision study - Outcome of patients with Philadelphia chromosome-positive chronic myelogenous leukemia post-imatinib mesylate failure. NEJM 2010;109(8):1556-60.
Kantarjian H, O’Brien S, Talpaz M, et al. Dasision study - Outcome of patients with Philadelphia chromosome-positive chronic myelogenous leukemia post-imatinib mesylate failure. NEJM 2010;109(8):1556-60.  Saglio G, Kim DW, Issaragrisil S, le Coutre P, Etienne G, Lobo C, et al. Nilotinib versus Imatinib for Newly Diagnosed Chronic Myeloid Leukemia. N Engl J Med. 2010 Jun 17;362(24):2251-9. | CrossRef | PubMed |
Saglio G, Kim DW, Issaragrisil S, le Coutre P, Etienne G, Lobo C, et al. Nilotinib versus Imatinib for Newly Diagnosed Chronic Myeloid Leukemia. N Engl J Med. 2010 Jun 17;362(24):2251-9. | CrossRef | PubMed | Kantarjian H, Sawyers C, Hochhaus A, Guilhot F, Schiffer C, Gambacorti-Passerini C, et al. Hematologic and cytogenetic responses to imatinib mesylate in chronic myelogenous leukemia. N Engl J Med. 2002 Feb 28;346(9):645-52. | CrossRef | PubMed |
Kantarjian H, Sawyers C, Hochhaus A, Guilhot F, Schiffer C, Gambacorti-Passerini C, et al. Hematologic and cytogenetic responses to imatinib mesylate in chronic myelogenous leukemia. N Engl J Med. 2002 Feb 28;346(9):645-52. | CrossRef | PubMed | Aoki E, Kantarjian H, O'Brien S. Correlation of Different Responses to Imatinib on Survival of Patients (pts) with Chronic Myelogenous Leukemia (CML) in Accelerated (AP) and Blast Phase (BP). Houston, Texas: MDACC, 2004.
Aoki E, Kantarjian H, O'Brien S. Correlation of Different Responses to Imatinib on Survival of Patients (pts) with Chronic Myelogenous Leukemia (CML) in Accelerated (AP) and Blast Phase (BP). Houston, Texas: MDACC, 2004.  Drummond M, Barbier, M, Cook J, Glick H, Lis J, Malik F. et al. Transferability of Economic Evaluations Across Jurisdictions: ISPOR Good Research Practices Task Force Report. Value in Health 2009;12:4:409-418. | CrossRef |
Drummond M, Barbier, M, Cook J, Glick H, Lis J, Malik F. et al. Transferability of Economic Evaluations Across Jurisdictions: ISPOR Good Research Practices Task Force Report. Value in Health 2009;12:4:409-418. | CrossRef | Edejer T.T, Baltussen R., Adam T., R. Making Choices in Health: WHO Guide to cost-effectiveness analysis. Geneva: World Health Organization, 2003.
Edejer T.T, Baltussen R., Adam T., R. Making Choices in Health: WHO Guide to cost-effectiveness analysis. Geneva: World Health Organization, 2003.  Cortes J, De Souza C, Ayala-Sanchez M, Bendit I, Best-Aguilera C, Enrico A, et al. Current patient management of chronic myeloid leukemia in Latin America: a study by the Latin American Leukemia Net (LALNET). Cancer. 2010 Nov 1;116(21):4991-5000. | CrossRef | PubMed |
Cortes J, De Souza C, Ayala-Sanchez M, Bendit I, Best-Aguilera C, Enrico A, et al. Current patient management of chronic myeloid leukemia in Latin America: a study by the Latin American Leukemia Net (LALNET). Cancer. 2010 Nov 1;116(21):4991-5000. | CrossRef | PubMed | An Economic Evaluation of Dasatinib in the First-Line Treatment of Patients with Chronic Myelogenous Leukaemia. York Health Economic consortium. Bristol-Myers SQUIBB, October 2010.
An Economic Evaluation of Dasatinib in the First-Line Treatment of Patients with Chronic Myelogenous Leukaemia. York Health Economic consortium. Bristol-Myers SQUIBB, October 2010.  O'Brien SG, Guilhot F, Larson RA, Gathmann I, Baccarani M, Cervantes F, et al. Imatinib Compared with Interferon and Low-Dose Cytarabine for Newly Diagnosed Chronic-Phase Chronic Myeloid Leukemia. N Engl J Med. 2003 Mar 13;348(11):994-1004. | CrossRef | PubMed |
O'Brien SG, Guilhot F, Larson RA, Gathmann I, Baccarani M, Cervantes F, et al. Imatinib Compared with Interferon and Low-Dose Cytarabine for Newly Diagnosed Chronic-Phase Chronic Myeloid Leukemia. N Engl J Med. 2003 Mar 13;348(11):994-1004. | CrossRef | PubMed | Ministerio de Protección Social. Decreto 2423 de 1996. Por el cual se determina la nomenclatura y clasificación de los procedimientos médicos, quirúrgicos y hospitalarios del Manual Tarifario y se dictan otras disposiciones. República de Colombia: Diario Oficial No. 42.961, 20 Enero 1997.
Ministerio de Protección Social. Decreto 2423 de 1996. Por el cual se determina la nomenclatura y clasificación de los procedimientos médicos, quirúrgicos y hospitalarios del Manual Tarifario y se dictan otras disposiciones. República de Colombia: Diario Oficial No. 42.961, 20 Enero 1997.  Republica de Colombia, EPS Seguro Social. Acuerdo Nº 256 de diciembre 19 de 2001. Manual de Tarifas. | Link |
Republica de Colombia, EPS Seguro Social. Acuerdo Nº 256 de diciembre 19 de 2001. Manual de Tarifas. | Link | Normas COVENIN. Venezuela: Centro de Publicaciones, Sistemas y Servicios para la Construcción Civil, 2011. | Link |
Normas COVENIN. Venezuela: Centro de Publicaciones, Sistemas y Servicios para la Construcción Civil, 2011. | Link | Evaluación económica del dasatinib en el tratamiento de la leucemia mieloide crónica en pacientes resistentes al imatinib en Chile
Evaluación económica del dasatinib en el tratamiento de la leucemia mieloide crónica en pacientes resistentes al imatinib en Chile