 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: coronavirus, remdesivir, steroids, methylprednisolone
El síndrome respiratorio agudo grave coronavirus 2 (SARS-CoV-2) se ha diseminado rápidamente a lo largo del mundo causando una mortalidad significativa en pacientes de alto riesgo con manifestaciones severas. A la fecha, Remdesivir ha sido el único antiviral autorizado por la FDA para uso de emergencia. Una de las posibles complicaciones de esta infección es el desarrollo de tormenta de citoquinas, para la cual no existe un tratamiento óptimo. Presentamos el caso de un varón de 48 años sin antecedentes médicos que acudió al hospital con disnea, tos, fiebre subjetiva y diarrea durante 10 días. La reacción de cadena polimerasa nasofaríngea fue positiva para SARS-CoV-2. Su estado respiratorio empeoró rápidamente hasta el punto de requerir oxígeno suplementario a través cánula nasal de alto flujo con 80% de FiO2. La tomografía computarizada de tórax mostró opacidades confluyentes en vidrio esmerilado en los lóbulos superiores, acompañadas de opacidades irregulares alveolares en los lóbulos inferiores bilateralmente. Se inició terapia con hidroxicloroquina, la cual se cambió a Remdesivir cuando estuvo disponible. Luego se inició metilprednisolona como tratamiento de una posible tormenta de citoquinas. La oxigenación del paciente mejoró significativamente en los días posteriores y fue dado de alta sin requerir oxigeno adicional y saturando 96% en medio ambiente. Nuestro caso ilustra el papel de Remdesivir en el tratamiento de la neumonía grave por COVID-19. También observamos un posible beneficio clínico de los corticoides en tormenta de citoquinas. Se necesitan más estudios para evaluar la eficacia de esta estrategia terapéutica.
Ideas clave
|
El síndrome respiratorio agudo grave coronavirus 2 (SARS-Cov-2) apareció por primera vez en Wuhan, China en diciembre del 2019, y desde entonces se ha propagado rápidamente por todo el mundo, lo que ha llevado a una pandemia de proporciones no descritas por varias décadas. Aunque la mayoría de los pacientes afectados tienen un buen pronóstico, aproximadamente el 15% puede desarrollar manifestaciones graves que dan lugar a altas tasas de mortalidad[1],[2]. En la actualidad, el tratamiento óptimo de esta infección no se ha determinado completamente. Remdesivir, un antiviral dirigido a la ARN polimerasa dependiente del ARN del SARS-CoV-2, es el único medicamento autorizado por la Food and Drug Administration (FDA) para uso de emergencia en el contexto de COVID[3]. Una de las características particulares de esta infección es el desarrollo de una posible tormenta de citoquinas inducida por el virus, para la cual no existe una terapia ampliamente aceptada[4]. Se han considerado varios inmunosupresores para esta complicación que se vienen investigando a través de ensayos clínicos aleatorizados[4]. En este reporte, presentamos el caso de un paciente con neumonía grave por COVID-19 tratado con Remdesivir y metilprednisolona, este último utilizado ante la sospecha de tormenta de citoquinas.
Un paciente varón de 48 años sin antecedentes médicos acude al hospital con disnea, tos, fiebre no objetivada y diarrea por 10 días. El paciente refirió trabajar en el aeropuerto vendiendo flores, y negó contacto con algún compañero de trabajo o miembro de la familia con síntomas respiratorios. A su llegada al servicio de urgencias, sus signos vitales revelaron temperatura oral de 38°C, frecuencia respiratoria de 28/min, frecuencia cardíaca de 131/min, presión arterial de 130/80 mmHg y saturación de oxígeno del 90% en medio ambiente. Se le colocó oxigeno suplementario a 4 litros/min por cánula binasal, y su saturación mejoró a 96%. El examen físico mostró un paciente con dificultad respiratoria, pero no se detectaron crepitantes en campos pulmonares. Los estudios de laboratorio revelaron un recuento total de leucocitos de 16,9K/uL con linfopenia de 1,0 K/uL, hemoglobina de 13,9 g/dL, recuento de plaquetas de 313K/uL y una tasa de neutrófilos/linfocitos de 14,3. El perfil metabólico completo mostró AST de 175 unidades/L, AST de 164 unidades/L, y creatinina de 0,6 mg/dL. Los marcadores inflamatorios fueron los siguientes: ferritina de 3 209 ng/mL, proteína C reactiva (PCR) de 34,5 mg/dL, DHL de 1 855 unidades/L, dímero D de 2,84 ug/ml e IL-6 de 81,69 pg/mL. La procalcitonina fue de 0,343 ng/mL (Tabla 1). Se realizó la reacción en cadena polimerasa en tiempo real para SARS-Cov-2, resultando positivo (InGenius®). El panel respiratorio viral nasofaríngeo (FilmArray®) no aisló ningún otro patógeno respiratorio. El antígeno de Legionella en orina y el antígeno neumocócico en orina fueron ambos negativos. La radiografía de tórax mostró volúmenes pulmonares reducidos con opacidades bilaterales en la zona pulmonar inferior (Figura 1).
Se inició tratamiento con ceftriaxona y azitromicina, pero más adelante, se suspendió la azitromicina y se añadió hidroxicloroquina. La saturación de oxígeno del paciente continuó disminuyendo y tuvo que colocársele cánula nasal de alto flujo (CNAF) con un FiO2 de 80% para lograr una saturación de 98%. Debido a su descompensación respiratoria, fue trasladado a la Unidad de Cuidados Intensivos (UCI) para su monitorización cercana. Debido a su pobre oxigenación, se ordenó una angiotomografía, la cual fue negativa para tromboembolismo pulmonar; sin embargo, mostró opacidades en vidrio esmerilado confluentes en los lóbulos superiores asociadas a opacidades alveolares leves irregulares principalmente en los segmentos posteriores apicales. También se observaron opacidades alveolares heterogéneas en el segmento medial del lóbulo medio derecho y en los segmentos superiores, posteriores y laterales de los lóbulos inferiores bilateralmente (Figura 2 A, B). El ecocardiograma no mostró signos de sobrecarga ventricular derecha, y la función sistólica del ventrículo izquierdo fue normal. Se inició profilaxis con enoxaparina 40mg subcutánea al día y se ofreció al paciente participar en el ensayo clínico COVACTA, el cual evalúa el uso de Tocilizumab, pero el paciente no aceptó.
Figura 2: Tomografía computarizada de Tórax.
Durante los siguientes 3 días, el paciente tuvo una mejoría leve en su oxigenación, pero aun requería CNAF con FiO2 de 50% para mantener una saturación de 95%. En este instante, se suspendió la administración de hidroxicloroquina y se comenzó Remdesivir, en una dosis de 200 mg EV al día (una sola dosis) y luego 100 mg EV diarios durante 4 días. Dos días más tarde, se inició metilprednisolona 1mg/kg al día como tratamiento de una posible tormenta de citoquinas debido a la elevación de los marcadores inflamatorios. La radiografía de tórax se repitió un día después, y mostró un empeoramiento de las opacidades difusas alrededor del hilio pulmonar. Dada la sospecha de una neumonía intrahospitalaria sobre-agregada, se ordenó cultivo de esputo. La tinción de Gram mostró bacilos gram negativos, lo que motivó escalar la cobertura antibiótica a cefepime y vancomicina; asimismo se suspendió la metilprednisolona luego de 2 días de iniciado su uso (Figura 3). Como parte de la evaluación de neumonía intrahospitalaria, se realizó la prueba de descarte para Staphylococcus aureus resistente a meticilina en fosas nasales, siendo negativa, por lo que se suspendió vancomicina. El cultivo final de esputo sólo reveló flora respiratoria normal, por esta razón cefepime también se suspendió.
Figura 3: Medicamentos administrados durante la hospitalización.
En los siguientes 4 días, la oxigenación del paciente mejoró significativamente, requiriendo sólo 4L/min de oxígeno por cánula nasal para mantener una saturación de 97%. Sus marcadores inflamatorios disminuyeron notablemente, mostrando una ferritina de 806 ng/mL, PCR de 1,5 mg/dL, DHL de 699 unidades/L, y dímero D de 1,30 ug/mL (Tabla 1). Tres días más tarde, fue dado de alta en condición estable saturando 96% en medio ambiente.
Tabla 1: Resultados de Exámenes de Laboratorio durante la Hospitalización.
El tratamiento óptimo de la neumonía por COVID-19 no está claramente determinado. Con respecto a la terapia farmacológica, la utilidad de hidroxicloroquina ha sido muy cuestionado por publicaciones recientes[5],[6]. El estudio retrospectivo realizado por Geleris et al. en el New York-Presbyterian Hospital-Columbia University Irving Medical Center, demostró que la administración de hidroxicloroquina no estuvo asociada con un riesgo más algo o más bajo de intubación o muerte (cociente de riesgo: 1,04; intervalo de confianza 95%: 0,82 a 1,32)[5]. Asimismo, el artículo publicado por Mahévas et al. tampoco mostró resultados positivos[6]. Este estudio observacional se realizó en 4 hospitales de tercer nivel en Francia y evaluó la eficacia clínica de la hidroxicloroquina[6]. De acuerdo a sus resultados, el tratamiento con esta droga no reduce la tasa de ingresos a cuidados intensivos o la mortalidad en pacientes con neumonía por COVID-19 tributarios de oxigeno suplementario[6]. Estos resultados, aunque provenientes de estudios observacionales retrospectivos, han llevado a muchas instituciones a cambiar sus protocolos de manejo y no considerar a la hidroxicloroquina como un medicamento de primera elección en el tratamiento de COVID[5]. A la fecha, el único antiviral que ha demostrado beneficio clínico basado en un ensayo clínico aleatorizado es Remdesivir[7]. Según los resultados preliminares publicados recientemente, Remdesivir fue superior a placebo al acortar el tiempo de recuperación en adultos hospitalizados con COVID-19 con evidencia de infección respiratoria baja[7]. El tiempo de recuperación se redujo de 15 días en pacientes tratados con placebo a 11 días en pacientes tratados con Remdesivir, lo cual correspondió a una tasa de recuperación de 1,32 (intervalo de confianza 95%: 1,22 a 1,55; p<0,001). En términos de mortalidad a los 14 días, hubo una reducción (7,1% vs 11,9%); pero sin significancia estadística. Cabe destacar que los resultados de mortalidad a los 28 días no se mostraron en la publicación debido al gran número de pacientes que aún no habían completado el día 29 de visita[7]. En la actualidad, Remdesivir ha sido autorizado por la FDA sólo para uso de emergencia, y está siendo distribuido de forma amplia en todos los hospitales en los Estados Unidos. El paciente del caso reportado fue tratado inicialmente con hidroxicloroquina debido a la falta de terapias alternativas al momento de su ingreso hospitalario; sin embargo, tan pronto como Remdesivir estuvo disponible, su terapia fue cambiada a este nuevo antiviral.
Otro aspecto importante de la patogénesis de COVID-19 es el posible desarrollo de tormenta de citoquinas, una condición inmune caracterizada por la rápida proliferación e hiperactivación de células T, macrófagos, células asesinas naturales y sobreproducción de más de 150 citoquinas inflamatorias y mediadores químicos, lo cual conlleva a un mayor riesgo de hiperpermeabilidad vascular, falla multiorgánica, y eventualmente la muerte[4]. Una de las citoquinas clave implicadas en este proceso es la IL-6, que aparentemente se asocia con severidad de la enfermedad[8],[9]. Por esta razón, se ha considerado el tratamiento con Tocilizumab, un inhibidor de la IL-6, en pacientes con descompensación respiratoria y marcadores inflamatorios compatibles con tormenta de citoquinas[10],[11]. En nuestro hospital, dado su uso experimental para COVID-19, Tocilizumab sólo se ofrece en el contexto de un ensayo clínico, al cual nuestro paciente se negó a participar. Otra medida para tratar esta respuesta inflamatoria abrumadora asociada con COVID-19 es la administración de corticoides[4]. En la actualidad, su uso es muy controversial[4]. A pesar de que algunos estudios no han reportado beneficio real[12],[13], otros han demostrado buenos resultados clínicos con el uso de dosis bajas y aplicación a corto plazo de metilprednisolona[14],[15]. En el estudio realizado por Wu, C et al. la administración de metilprednisolona aparentemente redujo el riesgo de muerte en pacientes con síndrome de distrés respiratorio del adulto (cociente de riesgo: 0,38; intervalo de confianza 95%: 0,20 a 0,72; P 0,003)[14]. Otro estudio dirigido por Wang, Yin et al. reveló resultados clínicos favorables en pacientes tratados con metilprednisolona en una dosis de 1-2 mg/kg/día durante 5-7 días. Este estudio de cohorte retrospectivo incluyó 46 pacientes, 26 de ellos tratados con corticoides. El análisis de esta cohorte mostró que los pacientes en metilprednisolona tenían una mejoría más rápida de la saturación de oxígeno y un intervalo más corto de oxigenoterapia suplementaria en comparación con los que no recibieron corticoides. Además, los autores encontraron que los pacientes en metilprednisolona eran menos propensos a requerir ventilación mecánica[15]. Una publicación reciente de Fadel et al. concuerda con muchos de estos hallazgos[16]. Estos autores llevaron a cabo un estudio cuasi-experimental con prueba única pre-test y post-test en un sistema de salud multicéntrico en Michigan que incluía pacientes con infección moderada y grave por COVID. Se implementó un protocolo que utilizaba un curso temprano y corto de metilprednisolona (0,5 a 1 mg/kg/día) durante 3 días, y los investigadores encontraron que este régimen redujo el escalonamiento en la atención médica y mejoró los resultados clínicos[16].
Nuestro paciente fue tratado con metilprednisolona debido a poca mejoría de su estado respiratorio y a la elevación de marcadores inflamatorios compatibles con tormenta de citoquinas. Utilizamos una dosis baja de metilprednisolona (1mg/kg/día) de acuerdo con los estudios publicados anteriormente. A pesar de que nuestro protocolo hospitalario actual recomienda el uso de metilprednisolona por 5-7 días; este medicamento fue suspendido de forma temprana en nuestro paciente debido al desarrollo de una posible infección bacteriana, la cual fue descartada más adelante. No reinstauramos metilprednisolona ya que observamos una recuperación oxigenatoria importante luego de dos días de su uso.
Nuestro caso ilustra el papel de Remdesivir en el tratamiento de la neumonía grave por COVID-19. Observamos un posible beneficio clínico de los corticoides en el contexto de la tormenta de citoquinas inducida por COVID-19. Aunque los resultados de un único caso no se pueden generalizar, creemos que la combinación de Remdesivir y metilprednisolona debe considerarse en casos de neumonía grave por COVID-19, con el objetivo de contrarrestar el daño viral directo de COVID y a su vez controlar el estado hiperinflamatorio inducido por el virus. Claramente necesitamos ensayos clínicos que determinen el valor real de esta estrategia terapéutica.
Roles y contribuciones
JAGZ participó en la conceptualización y redacción. JAGZ, TQ y ADV contribuyeron con la revisión y edición.
Fuente de apoyo financiero
Ninguno.
Conflicto de Interés
El corresponsal declara que no hay conflicto de intereses.
Aspectos Éticos
El consentimiento informado solicitado por Medwave fue firmado por el paciente y una copia del formato fue enviado al comité editorial de la revista.

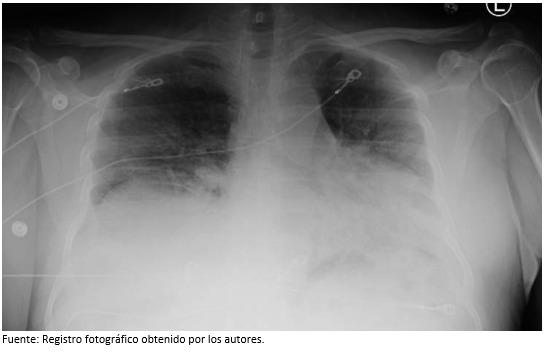 Figura 1: Radiografía de tórax portátil que muestra volúmenes pulmonares reducidos con opacidades bilaterales en la zona pulmonar inferior.
Figura 1: Radiografía de tórax portátil que muestra volúmenes pulmonares reducidos con opacidades bilaterales en la zona pulmonar inferior.

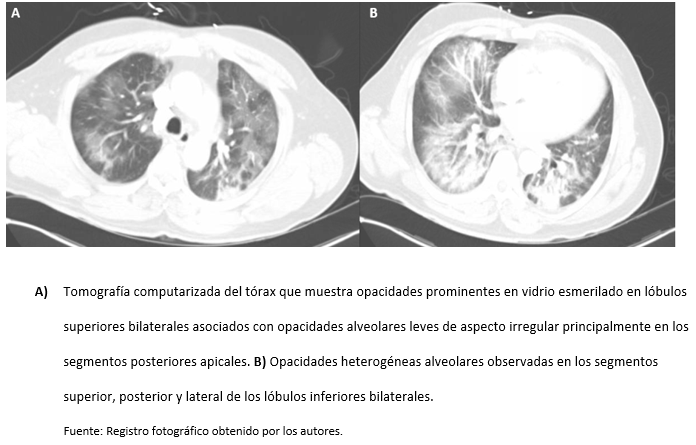 Figura 2: Tomografía computarizada de Tórax.
Figura 2: Tomografía computarizada de Tórax.




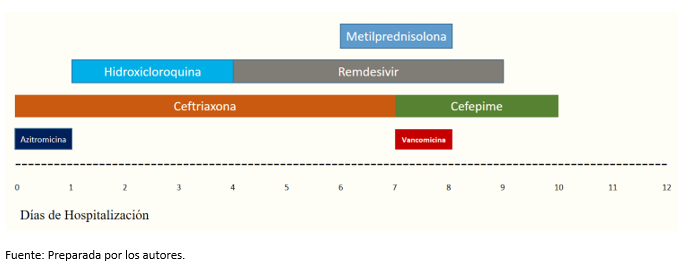 Figura 3: Medicamentos administrados durante la hospitalización.
Figura 3: Medicamentos administrados durante la hospitalización.

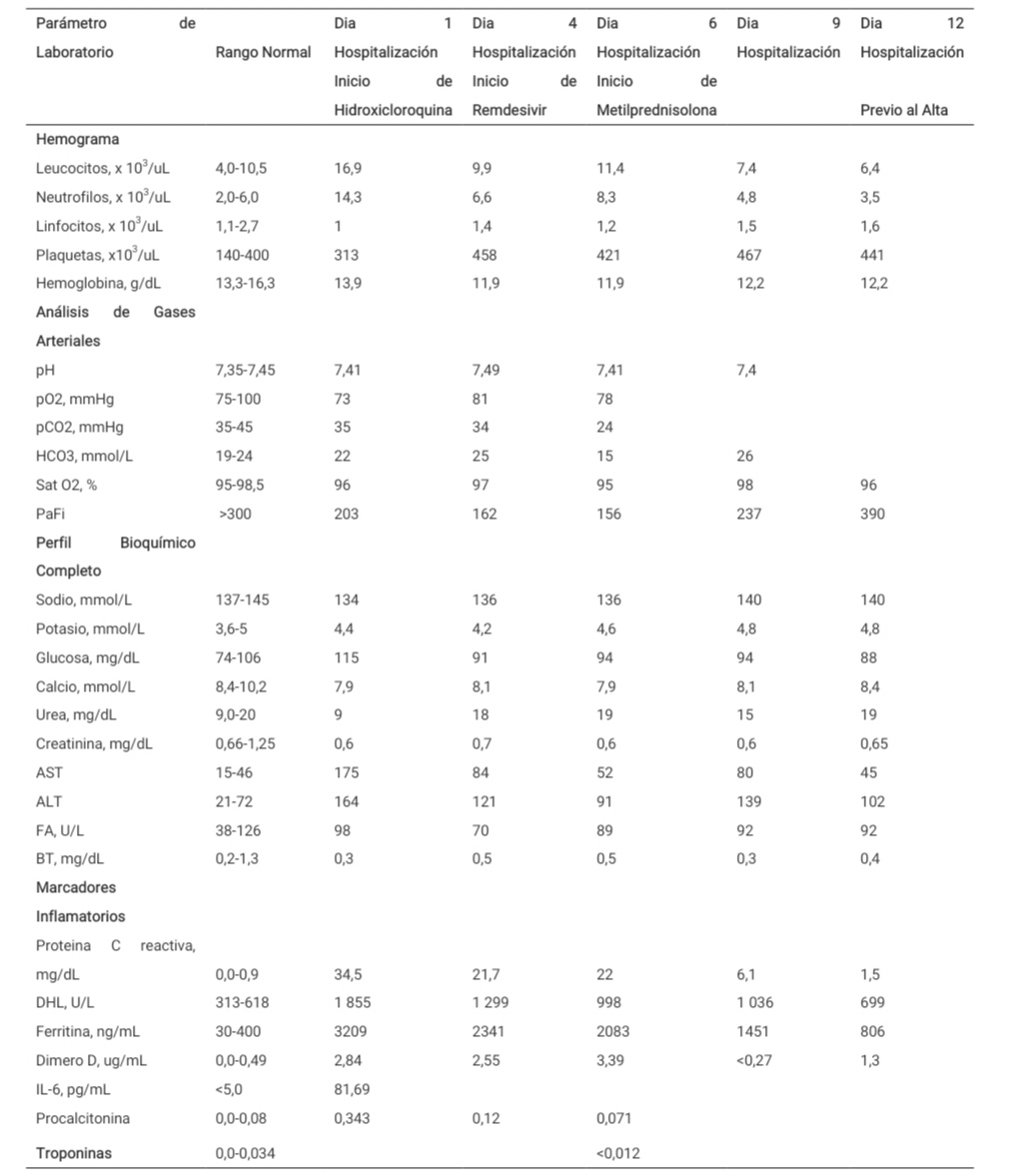 Tabla 1: Resultados de Exámenes de Laboratorio durante la Hospitalización.
Tabla 1: Resultados de Exámenes de Laboratorio durante la Hospitalización.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) has rapidly spread throughout the world causing significant mortality in high risk patients with severe manifestations. To date, Remdesivir has been the only antiviral authorized by FDA as therapy for emergency use. One of the potential complications of this infection is cytokine storm, which optimal treatment remains unknown. We present the case of a 48-year-old man with no past medical history who presented to the hospital with dyspnea, cough, subjective fever, and diarrhea for 10 days. Nasopharyngeal PCR was positive for SARS-CoV-2. His respiratory status rapidly worsened to the point of requiring supplemental oxygen by high flow nasal cannula with FiO2 of 80%. Chest computed tomography showed confluent ground glass opacities in upper lobes accompanied by patchy airspace opacities in lower lobes bilaterally. He was started on hydroxychloroquine, which was switched to Remdesivir when it became available. Then, methylprednisolone was initiated for suspected cytokine storm. The patient’s oxygenation improved significantly over the following days and he was discharged home with no oxygen supplementation and saturating 96% on room air. Our case illustrates the role of Remdesivir for the treatment of severe COVID-19 pneumonia. We also observed a possible clinical benefit of corticosteroids in the context of suspected cytokine storm. Further studies are needed to evaluate this therapeutic strategy.
 Autores:
José A Gonzales-Zamora [1], Tanya Quiroz[2], Ana D. Vega[3]
Autores:
José A Gonzales-Zamora [1], Tanya Quiroz[2], Ana D. Vega[3]

Citación: Gonzales-Zamora JA, Quiroz T, Vega AD. Successful treatment with Remdesivir and corticosteroids in a patient with COVID-19-associated pneumonia: A case report. Medwave 2020;20(7):e7998 doi: 10.5867/medwave.2020.07.7998
Fecha de envío: 28/5/2020
Fecha de aceptación: 1/8/2020
Fecha de publicación: 19/8/2020
Origen: No solicitado
Tipo de revisión: Con revisión por pares externa, por cuatro árbitros a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical Characteristics of Coronavirus
Disease 2019 in China. N Engl J Med. 2020 Apr 30;382(18):1708-1720. | CrossRef | PubMed |
Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical Characteristics of Coronavirus
Disease 2019 in China. N Engl J Med. 2020 Apr 30;382(18):1708-1720. | CrossRef | PubMed | Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized
Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020 Feb 7;323(11):1061–9. | CrossRef | PubMed |
Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized
Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020 Feb 7;323(11):1061–9. | CrossRef | PubMed | U.S. Food and Drug Administration (FDA). Fact sheet for health care providers, emergency use authorization (EUA) of Remdesivir (GS-5734™). [On line] | Link |
U.S. Food and Drug Administration (FDA). Fact sheet for health care providers, emergency use authorization (EUA) of Remdesivir (GS-5734™). [On line] | Link | Sun X, Wang T, Cai D, Hu Z, Chen J, Liao H, et al. Cytokine storm intervention in the early stages of COVID-19 pneumonia. Cytokine Growth Factor Rev. 2020 Jun;53:38-42. | CrossRef | PubMed |
Sun X, Wang T, Cai D, Hu Z, Chen J, Liao H, et al. Cytokine storm intervention in the early stages of COVID-19 pneumonia. Cytokine Growth Factor Rev. 2020 Jun;53:38-42. | CrossRef | PubMed | Geleris J, Sun Y, Platt J, Zucker J, Baldwin M, Hripcsak G, et al. Observational Study of Hydroxychloroquine in Hospitalized Patients with Covid-19. N Engl J Med. 2020 Jun 18;382(25):2411-2418. | CrossRef | PubMed |
Geleris J, Sun Y, Platt J, Zucker J, Baldwin M, Hripcsak G, et al. Observational Study of Hydroxychloroquine in Hospitalized Patients with Covid-19. N Engl J Med. 2020 Jun 18;382(25):2411-2418. | CrossRef | PubMed | Mahévas M, Tran VT, Roumier M, Chabrol A, Paule R, Guillaud C, et al. Clinical efficacy of hydroxychloroquine in patients with covid-19 pneumonia who require oxygen: observational comparative study using routine care data. BMJ. 2020 May 14;369:m1844. | CrossRef | PubMed |
Mahévas M, Tran VT, Roumier M, Chabrol A, Paule R, Guillaud C, et al. Clinical efficacy of hydroxychloroquine in patients with covid-19 pneumonia who require oxygen: observational comparative study using routine care data. BMJ. 2020 May 14;369:m1844. | CrossRef | PubMed | Beigel JH, Tomashek KM, Dodd LE, Mehta AK, Zingman BS, Kalil AC, et al. Remdesivir for the Treatment of Covid-19 - Preliminary Report. N Engl J Med. 2020 May 22. | CrossRef | PubMed |
Beigel JH, Tomashek KM, Dodd LE, Mehta AK, Zingman BS, Kalil AC, et al. Remdesivir for the Treatment of Covid-19 - Preliminary Report. N Engl J Med. 2020 May 22. | CrossRef | PubMed | Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062. | CrossRef | PubMed |
Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062. | CrossRef | PubMed | Liu F, Li L, Xu M, Wu J, Luo D, Zhu Y, et al. Prognostic value of interleukin-6, C-reactive protein, and procalcitonin in patients with COVID-19. J Clin Virol. 2020 Jun;127:104370. | CrossRef | PubMed |
Liu F, Li L, Xu M, Wu J, Luo D, Zhu Y, et al. Prognostic value of interleukin-6, C-reactive protein, and procalcitonin in patients with COVID-19. J Clin Virol. 2020 Jun;127:104370. | CrossRef | PubMed | Zhang S, Li L, Shen A, Chen Y, Qi Z. Rational Use of Tocilizumab in the Treatment of Novel Coronavirus Pneumonia. Clin Drug Investig. 2020 Jun;40(6):511-518. | CrossRef | PubMed |
Zhang S, Li L, Shen A, Chen Y, Qi Z. Rational Use of Tocilizumab in the Treatment of Novel Coronavirus Pneumonia. Clin Drug Investig. 2020 Jun;40(6):511-518. | CrossRef | PubMed | Xu X, Han M, Li T, Sun W, Wang D, Fu B, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A. 2020 May 19;117(20):10970-10975. | CrossRef | PubMed |
Xu X, Han M, Li T, Sun W, Wang D, Fu B, et al. Effective treatment of severe COVID-19 patients with tocilizumab. Proc Natl Acad Sci U S A. 2020 May 19;117(20):10970-10975. | CrossRef | PubMed | Zha L, Li S, Pan L, Tefsen B, Li Y, French N, Chen L, Yang G, Villanueva EV. Corticosteroid treatment of patients with coronavirus disease 2019 (COVID-19). Med J Aust. 2020 May;212(9):416-420. | CrossRef | PubMed |
Zha L, Li S, Pan L, Tefsen B, Li Y, French N, Chen L, Yang G, Villanueva EV. Corticosteroid treatment of patients with coronavirus disease 2019 (COVID-19). Med J Aust. 2020 May;212(9):416-420. | CrossRef | PubMed | Lu X, Chen T, Wang Y, Wang J, Yan F. Adjuvant corticosteroid therapy for critically ill patients with COVID-19. Crit Care. 2020 May 19;24(1):241. | CrossRef | PubMed |
Lu X, Chen T, Wang Y, Wang J, Yan F. Adjuvant corticosteroid therapy for critically ill patients with COVID-19. Crit Care. 2020 May 19;24(1):241. | CrossRef | PubMed | Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020 Mar 13;180(7):1–11. | CrossRef | PubMed |
Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020 Mar 13;180(7):1–11. | CrossRef | PubMed |