 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: adrenocortical carcinoma, mitotane, chemotherapy
En el carcinoma suprarrenal metastásico no existen esquemas de tratamiento aprobados tras la progresión a una primera línea de quimioterapia/mitotane, si bien un alto porcentaje de pacientes son candidatos a recibirlos. En este artículo realizamos una revisión sobre las posibles alternativas terapéuticas tras la progresión a una primera línea de tratamiento en pacientes con carcinoma suprarrenal metastásico. A propósito de la misma, se presenta un caso clínico en el que se consigue una prolongada supervivencia global, mucho mayor de la esperable, probablemente debido al manejo multidisciplinario del caso y a la utilización de la mayor parte del arsenal terapéutico disponible.
El carcinoma suprarrenal es un tumor maligno infrecuente, estimándose una incidencia en Estados Unidos de 0,72 casos por millón de habitantes, siendo el responsable del 0,2% de las muertes por cáncer en dicho país [1]. Tiene una edad media de presentación entre los 46 y los 55 años [2].
El tratamiento de elección de la enfermedad localizada es la cirugía, si bien hasta en el 70% de los casos la enfermedad se diagnostica en fase avanzada/metastásica [1]. Las localizaciones más comunes de diseminación metastásica son los pulmones, hígado, ganglios linfáticos y con menor frecuencia los huesos [1]. En esta fase, el pronóstico de la enfermedad es malo, siendo la supervivencia global en la mayoría de los pacientes menor a un año [3]. Aunque la cirugía citorreductora puede aumentar la supervivencia y controlar los síntomas en los tumores funcionantes, la base del tratamiento suele ser la terapia adrenolítica con mitotane y otros fármacos antihormonales (ketoconazol), la quimioterapia y/o la radioterapia [4]. A pesar de todo ello, la supervivencia a cinco años es menor del 20% [5],[6].
En el presente artículo revisamos el tratamiento del carcinoma suprarrenal metastásico, a propósito del caso clínico de un paciente tratado con múltiples líneas de quimioterapia y cirugía citorreductora, obteniendo con ello una supervivencia superior a la esperada.
Varón de 37 años, sin antecedentes médicos de interés. Ingresa en el Hospital Universitario de Torrejón (Madrid, España) en julio de 2013 por cuadro de dolor epigástrico, hiporexia y pérdida de 10 kilógramos de peso en los últimos seis meses.
En la exploración física el abdomen estaba distendido reflejando ascitis. Se realizó una tomografía computarizada (Figura 1). Esta reflejaba una masa adrenal derecha heterogénea de 13 centímetros de diámetro que comprimía la vena cava inferior y carcinomatosis peritoneal.
Figura 1. Tomografía computarizada abdominal.
Los estudios de laboratorio no presentaron incremento de las hormonas esteroideas ni de catecolaminas. En el servicio de radiología intervencionista se realizó una biopsia de la masa adrenal con aguja gruesa guiada con una ecografía. Se describió microscópicamente como una proliferación de células de mediano tamaño, con citoplasma eosinófilo granular y núcleo hipercromático de contorno ligeramente irregular, sin evidencia de nucléolo. Las células mostraron un patrón sólido en el material remitido, con múltiples estructuras vasculares de pequeño calibre. El perfil inmunohistoquímico presentó positividad para vimentina, inhibina, melan-A, calretinina y sinaptofisina, negatividad para CKAE1/AE3. Índice de proliferación Ki-67 del 10%.
Figura 2. A y B: infiltración por carcinoma sólido.
Se valoró al paciente en la unidad de consejo genético, siendo candidato a la realización del panel de 21 genes (BRCA1, BRCA2, CHEK2, PALB2, BRIP1, TP53, PTEN, STK11, CDH1, ATM, BARD1, MLH1, MRE11A, MSH2, MSH6, MUTYH, NBN, PMS1, PMS2, RAD50, RAD51C). Se enriqueció y se secuenció el ADN mediante una plataforma de secuenciación de alto rendimiento. Se analizaron todos los exones y las 10 pares de bases flaqueantes de los genes. Las variaciones detectadas incluyeron: mutaciones puntuales, pequeñas inserciones o deleciones. En nuestro paciente no se encontró ninguna mutación patogénica conocida.
Se presentó el caso en el comité de tumores de nuestro hospital, decidiéndose comenzar tratamiento de quimioterapia según el esquema EDP-mitotane. Este se compone de etopósido a dosis de 100 milígramos por metro cuadrado de superficie corporal administrado por vía endovenosa los días dos, tres y cuatro de cada ciclo; doxorrubicina a dosis de 40 milígramos por metro cuadrado de superficie corporal administrado por vía endovenosa el día uno; cisplatino a dosis de 40 milígramos por metro cuadrado de superficie corporal administrado por vía endovenosa los días tres y cuatro; y mitotane oral todos los días. Cada ciclo se administra cada cuatro semanas. El paciente recibió un total de seis ciclos de quimioterapia. El mitotane se inició una semana antes del comienzo de la quimioterapia con el objetivo de conseguir niveles plasmáticos del fármaco entre 14 y 20 milígramos por litro. El tratamiento glucocorticoideo sustitutivo se inició al comienzo del tratamiento con mitotane.
Al finalizar los seis ciclos de tratamiento (seis meses después), la tomografía computarizada mostró una reducción de la masa tumoral adrenal y la carcinomatosis peritoneal en torno al 40% según criterios RECIST (Figura 3).
Posteriormente a pesar de no poder obtener una resección completa R0, se realizó cirugía paliativa citorreductora (debulking) mediante adrenelectomía y omentectomía. El informe patológico posterior informaba carcinoma corticoadrenal, que alcanzó bordes quirúrgicos; invasión vascular y alteraciones histológicas compatibles con cambios secundarios a terapia neoadyuvante ypT3NxM1 (Figura 4).
Figura 4. Muestra de la pieza quirúrgica.
La tomografía computarizada post-quirúrgica reveló la persistencia de carcinomatosis peritoneal y una masa adrenal de siete por tres centímetros.
Tras la cirugía el paciente continuó tratamiento con mitotane, con necesidad de ajustes periódicos de la dosis para mantener niveles séricos entre 14 y 20 milígramos por litro. Además, necesitó tratamiento sustitutivo con mineralocorticoides, levotiroxina e hipolipemiantes debido a los efectos secundarios del mitotane. Se continuaron controles periódicos sin signos de progresión hasta la reevaluación mediante tomografía computarizada en febrero de 2016, en la que se objetivó empeoramiento de la neoplasia a nivel peritoneal y suprarrenal.
Debido al intervalo libre de progresión prolongado obtenido tras la primera línea de quimioterapia (de 30 meses) y el excelente estado general del paciente (puntaje 0 en la escala del East Cooperative Oncology Group, ECOG), se decidió retratar con el esquema de quimioterapia previo (etopósido, doxorrubicina y cisplatino por vía endovenosa, más mitotane oral). Se administraron un total de tres ciclos, siendo necesaria la reducción de dosis por presentar toxicidad hematológica y renal grado 2, sin obtener beneficio en la reevaluación, con nueva progresión de la enfermedad peritoneal y aparición de metástasis hepáticas (Figura 5).
Figura5. Tomografía computarizada
A la progresión se valoró la posibilidad de participar en un ensayo clínico, si bien las únicas opciones disponibles en ese momento en la Comunidad Autónoma de Madrid eran estudios fase I. El paciente declinó esta posibilidad. Debido al óptimo estado de rendimiento de la escala East Cooperative Oncology Group que presentaba - puntuación 1 - y el deseo del paciente por recibir más tratamiento, se realizó una revisión bibliográfica sobre las opciones para tratar el carcinoma suprarrenal metastásico tras progresión a una o más líneas de quimioterapia.
Se seleccionó entre los estudios analizados la combinación de quimioterapia basada en gemcitabina más capecitabina, recibiendo un total de cuatro ciclos (con dosis reducidas un 10% por la toxicidad hematológica que presentó con el esquema previo de quimioterapia). La respuesta obtenida fue progresión tumoral peritoneal con respuesta parcial hepática y estabilidad de la masa suprarrenal. No obstante, por criterios RECIST se considera progresión motivo por el cual se suspendió el tratamiento. La tolerabilidad fue aceptable (máxima toxicidad anemia y astenia grado 2), a pesar de que el paciente presentó deterioro clínico. Al finalizar el tratamiento, el puntaje East Cooperative Oncology Group fue 2.
Posteriormente se desestimó más tratamiento con quimioterapia, centrándonos en el manejo sintomático de soporte. El paciente falleció a los seis meses del último ciclo de quimioterapia, como consecuencia de la progresión tumoral. Esto fue 46 meses después del diagnóstico de la enfermedad metastásica.
El carcinoma suprarrenal requiere un manejo multidisciplinario que incluya endocrinólogos, oncólogos, cirujanos, radiólogos y otras disciplinas para asegurar un correcto manejo. La resección quirúrgica completa es la única opción curativa en los pacientes con carcinoma suprarrenal localizado. Sin embargo, aproximadamente el 80% de los pacientes presentarán recurrencia local o a distancia tras la resección completa [7].
Incluso si la tumoración no puede resecarse completamente, muchos autores defienden que la cirugía citorreductora aumenta la supervivencia de los pacientes [8],[9],[10], mientras que otros rechazan dicha maniobra [11],[12]. Por tanto, la decisión sobre la cirugía en carcinoma suprarrenal metastásico debería individualizarse, teniendo en cuenta la biología tumoral, el grado histológico, la progresión tumoral y la respuesta al tratamiento sistémico [13].
Múltiples estudios demuestran el valor pronóstico de los marcadores de proliferación celular, como el índice mitótico o la expresión de Ki-67 [14],[15]. La importancia de dichos parámetros queda demostrada en el estudio de 124 pacientes con carcinoma suprarrenal, en los que la tasa de supervivencia libre de enfermedad según el índice mitótico de ≤ 5, 6 a 10, 21 a 50, y > 50 (por 50 campos de aumento) fue del 63, 50, 25, y 0%, respectivamente [14].
El tratamiento con mitotane está indicado en pacientes con carcinoma suprarrenal en los que la cirugía es incompleta, no se puede realizar o bien está contraindicada. La evidencia sobre la utilización de mitotane en el carcinoma suprarrenal está basada en múltiples series retrospectivas, si bien se considera uno de los agentes antitumorales más activos en dicha neoplasia, con tasas de respuesta que varían entre el 13 y el 31% [16], aunque la posibilidad de respuesta completa es mínima. En términos de supervivencia global, los estudios son contradictorios, siendo cuatro negativos y cinco positivos [9],[16],[17],[18]. Sin embargo, existe consenso en las diferentes guías clínicas sobre el potencial beneficio de su utilización en el carcinoma suprarrenal metastásico.
Es generalmente aceptado, aunque no demostrado, que la quimioterapia en combinación con mitotane es superior al mitotane en monoterapia. El tratamiento de combinación suele utilizarse en la enfermedad metastásica y en la rápidamente progresiva. Los estudios prospectivos que evalúan el tratamiento de combinación se resumen en la Tabla 1.
Tabla 1. Quimioterapia más mitotane en carcinoma suprarrenal metastásico.
Malandrino y colaboradores demostraron en el análisis multivariante de su estudio que, tanto mantener unos niveles de mitotane en rango terapéutico como obtener al menos una respuesta parcial al tratamiento de quimioterapia basada en platino, son factores pronósticos independientes (p<0,03 y <0,001 respectivamente) [15]. En nuestro paciente se dieron ambas condiciones, lo que podría explicar su larga supervivencia.
Aunque ningún esquema de quimioterapia ha demostrado incrementar la supervivencia en carcinoma suprarrenal metastásico, los resultados más prometedores son los obtenidos con la combinación de etopósido, doxorrubicina y cisplatino por vía endovenosa, más mitotane oral. El ensayo clínico más importante realizado hasta la fecha es el First International Randomized Trial in locally advanced and metastatic Adrenocortical Carcinoma Treatment (FIRM-ACT), que aleatoriza 304 pacientes con carcinoma suprarrenal metastásico no candidatos a cirugía a mitotane en combinación con etopósido, doxorrubicina y cisplatino por vía endovenosa, más mitotane oral o mitotane más estreptozotocina [22]. La tasa de respuesta objetiva (23 versus 9%) y el intervalo libre de progresión (5 versus 2,1 meses) fueron significativamente superiores en el brazo de etopósido, doxorrubicina y cisplatino por vía endovenosa, más mitotane oral, si bien dicho beneficio no se demostró al analizar la supervivencia (mediana de 14,8 versus 12 meses). Esta ausencia de beneficio en supervivencia global podría explicarse por el entrecruzamiento (cross-over) que estaba permitido en el estudio. La tasa de eventos adversos fue similar en ambos grupos.
Debido a la edad del paciente (38 años en ese momento), bajo Ki-67 (<10%), buena respuesta a la quimioterapia (reducción tumoral del 40%) y buen estado de rendimiento de la escala East Cooperative Oncology Group (puntuación 0), se decidió en el comité multidisciplinario de tumores de nuestro centro el realizar cirugía citorreductora y mantener posteriormente el tratamiento con mitotane en monoterapia. Con todo ello se obtuvo un intervalo libre de progresión de 30 meses, cifra muy superior a lo esperado (en torno a cinco meses) [22].
Tras revisar las opciones de tratamiento con quimioterapia en una revisión exhaustiva de la bibliografía, destacamos el ensayo clínico fase II realizado por Sperone y colaboradores. En él se evalúa la eficacia del esquema de quimioterapia basado en fluoropirimidinas (5-fluorouracilo o capecitabina) a dosis metronómicas (tratamiento continuo a dosis bajas) en combinación con gemcitabina 800 milígramos por metro cuadrado intravenoso los días uno y ocho cada 21 días, en un total de 28 pacientes con carcinoma suprarrenal metastásico que han progresado a una o dos líneas de quimioterapia previa [23]. El tratamiento con mitotane se mantiene en todos los casos. A los cuatro meses el 46,3% de los pacientes no había progresado, obteniéndose un 3,5% de respuestas completas, un 3,5% de respuestas parciales y un 39,3% de estabilizaciones (por tanto un 46,3% de beneficio clínico). El tratamiento fue bien tolerado, con una toxicidad grado 3/4 baja (leucopenia 21%, trombopenia 3,5% y mucositis en el 3,5%). El intervalo libre de progresión es de 5,3 meses y la supervivencia global de 9,8 meses. Por tanto es un esquema con una actividad no despreciable y bien tolerado, si bien con las limitaciones de ser un ensayo clínico fase II. Fueron estos los motivos que llevaron a utilizar dicho esquema de quimioterapia como tercera línea paliativa en nuestro paciente. Aunque los resultados obtenidos fueron peores (progresión como mejor respuesta y un intervalo libre de progresión de casi cuatro meses), la tolerabilidad fue excelente, acorde con los resultados del estudio, no presentando toxicidades grado 3/4 y obteniendo una supervivencia global de 10 meses (muy similar a la obtenida en el estudio).
El mejor conocimiento de la biología molecular del carcinoma suprarrenal está permitiendo el desarrollo de nuevas y prometedoras moléculas. Desafortunadamente los resultados preliminares de los ensayos clínicos no están demostrando el beneficio deseado. En la Tabla 2 se resumen los estudios de los fármacos más prometedores en la actualidad. Por desgracia no fue una opción válida para nuestro paciente, por carecer de ensayo clínico en nuestra región.
Tabla 2. Tratamientos en desarrollo en carcinoma suprarrenal metastásico.
La supervivencia global del paciente fue de 46 meses, manteniendo una óptima calidad de vida hasta tres meses antes de su fallecimiento. Opinamos igual que Wahab y colaboradores [30], siendo probablemente la clave del éxito del caso el manejo multidisciplinario realizado. En nuestro caso, participaron en el tratamiento del paciente los servicios de cirugía, medicina interna, endocrinología, radiología y oncología médica.
No existe ningún tratamiento de quimioterapia estándar tras la progresión a una primera línea en este tipo de tumores. Los estudios existentes no son concluyentes y presentan resultados muy dispares. Debido al gran beneficio clínico y radiológico obtenido con el esquema de etopósido, doxorrubicina y cisplatino por vía endovenosa, más mitotane oral y la buena situación clínica del paciente, se decidió retratar, a pesar de que el beneficio obtenido fue mucho menor, con un intervalo libre de progresión de tres meses. Tampoco existe ningún tratamiento aprobado para el carcinoma suprarrenal metastásico en el contexto de tercera o sucesivas líneas de tratamiento, siendo la mejor opción en dicho contexto la participación en un ensayo clínico, opción únicamente disponible en ese momento dentro de un ensayo clínico fase I, opción que el paciente declinó.
Aspectos éticos
El consentimiento informado solicitado por Medwave, ha sido firmado por el paciente; una copia de este fue remitido a la dirección editorial de la revista.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.

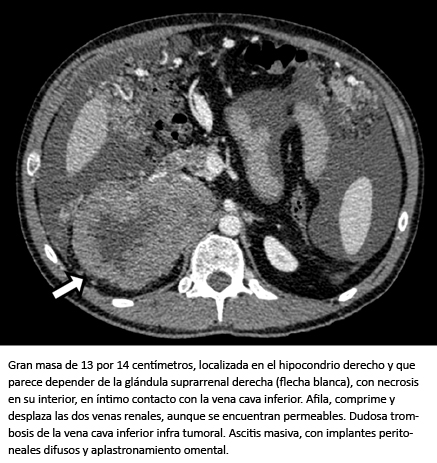 Figura 1. Tomografía computarizada abdominal.
Figura 1. Tomografía computarizada abdominal.

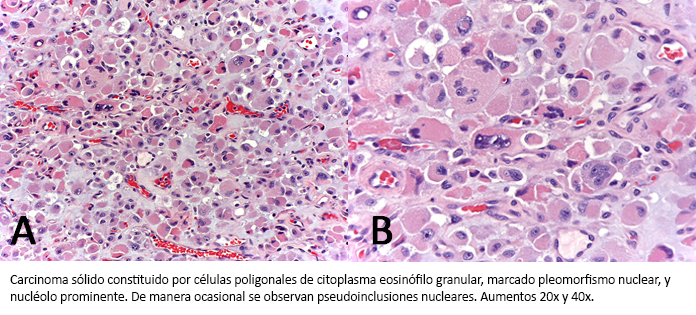 Figura 2. A y B: infiltración por carcinoma sólido.
Figura 2. A y B: infiltración por carcinoma sólido.

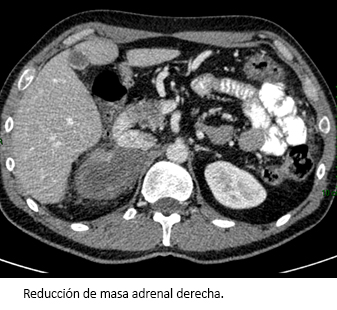 Figura 3. Tomografía computarizada a seis meses del tratamiento con primera línea de quimioterapia y mitotane.
Figura 3. Tomografía computarizada a seis meses del tratamiento con primera línea de quimioterapia y mitotane.

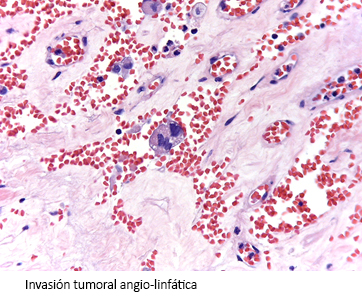 Figura 4. Muestra de la pieza quirúrgica.
Figura 4. Muestra de la pieza quirúrgica.

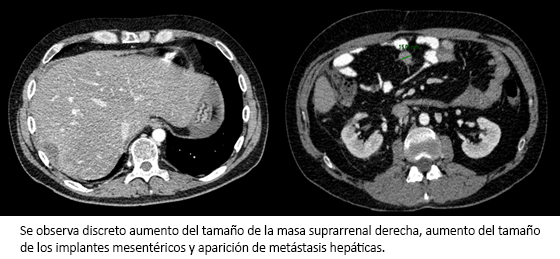 Figura5. Tomografía computarizada
Figura5. Tomografía computarizada

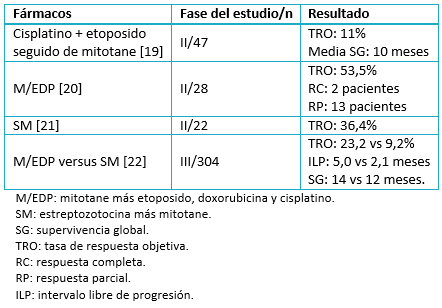 Tabla 1. Quimioterapia más mitotane en carcinoma suprarrenal metastásico.
Tabla 1. Quimioterapia más mitotane en carcinoma suprarrenal metastásico.

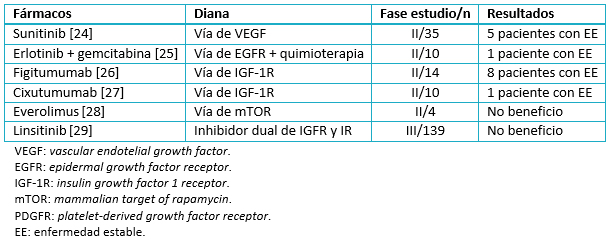 Tabla 2. Tratamientos en desarrollo en carcinoma suprarrenal metastásico.
Tabla 2. Tratamientos en desarrollo en carcinoma suprarrenal metastásico.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

There are no approved therapeutic regimes for adrenal carcinoma following progression to a first line of chemotherapy/mitotane although a high percentage of patients are candidates to receive them. In the present article we review the possible therapeutic alternatives after the progression to a first line of treatment in patients with adrenal carcinoma and we report a case in which a prolonged overall survival is achieved, much higher than expected, probably in relation to the multidisciplinary management of the case and the use of most of the therapeutic arsenal available.
 Autores:
Luis Cabezón-Gutiérrez[1], Parham Khosravi-Shahi[1], Sara Custodio-Cabello[1], David Ricardo Lujan-Rodríguez[2], Jesús Ángel Garijo-Álvarez[3], Claudia María Causso-Lariena[4], Ana Isabel Franco-Moreno[5]
Autores:
Luis Cabezón-Gutiérrez[1], Parham Khosravi-Shahi[1], Sara Custodio-Cabello[1], David Ricardo Lujan-Rodríguez[2], Jesús Ángel Garijo-Álvarez[3], Claudia María Causso-Lariena[4], Ana Isabel Franco-Moreno[5]

Citación: Cabezón-Gutiérrez L, Khosravi-Shahi P, Custodio-Cabello S, Lujan-Rodríguez DR, Garijo-Álvarez JA, Causso-Lariena CM, et al. Palliative chemotherapy in metastatic adrenal carcinoma beyond the first line: a case report and literature review. Medwave 2017 Jul;17(6):7007 doi: 10.5867/medwave.2017.06.7007
Fecha de envío: 8/5/2017
Fecha de aceptación: 15/7/2017
Fecha de publicación: 31/7/2017
Origen: no solicitado
Tipo de revisión: con revisión por cinco pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Kebebew E, Reiff E, Duh QY, Clark OH, McMillan A. Extent of disease at presentation and outcome for adrenocortical carcinoma: have we made progress?
World J Surg. 2006 May;30(5):872-8. | PubMed |
Kebebew E, Reiff E, Duh QY, Clark OH, McMillan A. Extent of disease at presentation and outcome for adrenocortical carcinoma: have we made progress?
World J Surg. 2006 May;30(5):872-8. | PubMed | Bilimoria KY, Shen WT, Elaraj D, Bentrem DJ, Winchester DJ, Kebebew E, et al. Adrenocortical carcinoma in the United States: treatment utilization and prognostic factors. Cancer. 2008 Dec 1;113(11):3130-6. | CrossRef | PubMed |
Bilimoria KY, Shen WT, Elaraj D, Bentrem DJ, Winchester DJ, Kebebew E, et al. Adrenocortical carcinoma in the United States: treatment utilization and prognostic factors. Cancer. 2008 Dec 1;113(11):3130-6. | CrossRef | PubMed | Kerkhofs TM, Verhoeven RH, Van der Zwan JM, Dieleman J, Kerstens MN, Links TP, et al. Adrenocortical carcinoma: a population-based study on incidence and survival in the Netherlands since 1993. Eur J Cancer. 2013 Jul;49(11):2579-86. | CrossRef | PubMed |
Kerkhofs TM, Verhoeven RH, Van der Zwan JM, Dieleman J, Kerstens MN, Links TP, et al. Adrenocortical carcinoma: a population-based study on incidence and survival in the Netherlands since 1993. Eur J Cancer. 2013 Jul;49(11):2579-86. | CrossRef | PubMed | Burotto M, Tageja N, Rosenberg A, Mahalingam S, Quezado M, Velarde M, et al. Brain metastasis in patients with adrenocortical carcinoma: a clinical series. J Clin Endocrinol Metab. 2015 Feb;100(2):331-6. | CrossRef | PubMed |
Burotto M, Tageja N, Rosenberg A, Mahalingam S, Quezado M, Velarde M, et al. Brain metastasis in patients with adrenocortical carcinoma: a clinical series. J Clin Endocrinol Metab. 2015 Feb;100(2):331-6. | CrossRef | PubMed | Giordano TJ, Kuick R, Else T, Gauger PG, Vinco M, Bauersfeld J, et al. Molecular classification and prognostication of adrenocortical tumors by transcriptome profiling. Clin Cancer Res. 2009 Jan 15;15(2):668-76. | CrossRef | PubMed |
Giordano TJ, Kuick R, Else T, Gauger PG, Vinco M, Bauersfeld J, et al. Molecular classification and prognostication of adrenocortical tumors by transcriptome profiling. Clin Cancer Res. 2009 Jan 15;15(2):668-76. | CrossRef | PubMed | Assié G, Letouzé E, Fassnacht M, Jouinot A, Luscap W, Barreau O, et al. Integrated genomic characterization of adrenocortical carcinoma. Nat Genet. 2014 Jun;46(6):607-12. | CrossRef | PubMed |
Assié G, Letouzé E, Fassnacht M, Jouinot A, Luscap W, Barreau O, et al. Integrated genomic characterization of adrenocortical carcinoma. Nat Genet. 2014 Jun;46(6):607-12. | CrossRef | PubMed | Dackiw AP, Lee JE, Gagel RF, Evans DB. Adrenal cortical carcinoma. World J Surg. 2001 Jul;25(7):914-26. | PubMed |
Dackiw AP, Lee JE, Gagel RF, Evans DB. Adrenal cortical carcinoma. World J Surg. 2001 Jul;25(7):914-26. | PubMed | Bertagna C, Orth DN. Clinical and laboratory findings and results of therapy in 58 patients with adrenocortical tumors admitted to a single medical center (1951 to 1978). Am J Med. 1981 Nov;71(5):855-75. | PubMed |
Bertagna C, Orth DN. Clinical and laboratory findings and results of therapy in 58 patients with adrenocortical tumors admitted to a single medical center (1951 to 1978). Am J Med. 1981 Nov;71(5):855-75. | PubMed | Luton JP, Cerdas S, Billaud L, Thomas G, Guilhaume B, Bertagna X, et al. Clinical features of adrenocortical carcinoma, prognostic factors, and the effect of mitotane therapy. N Engl J Med. 1990 Apr 26;322(17):1195-201. | PubMed |
Luton JP, Cerdas S, Billaud L, Thomas G, Guilhaume B, Bertagna X, et al. Clinical features of adrenocortical carcinoma, prognostic factors, and the effect of mitotane therapy. N Engl J Med. 1990 Apr 26;322(17):1195-201. | PubMed | Gröndal S, Cedermark B, Eriksson B, Grimelius L, Harach R, Kristoffersson A, et al. A retrospective study of a rare tumor with a poor prognosis. Eur J Surg Oncol. 1990 Dec;16(6):500-6. | PubMed |
Gröndal S, Cedermark B, Eriksson B, Grimelius L, Harach R, Kristoffersson A, et al. A retrospective study of a rare tumor with a poor prognosis. Eur J Surg Oncol. 1990 Dec;16(6):500-6. | PubMed | Hogan TF, Gilchrist KW, Westring DW, Citrin DL. A clinical and pathological study of adrenocortical carcinoma: therapeutic implications. Cancer. 1980 Jun 1;45(11):2880-3. | PubMed |
Hogan TF, Gilchrist KW, Westring DW, Citrin DL. A clinical and pathological study of adrenocortical carcinoma: therapeutic implications. Cancer. 1980 Jun 1;45(11):2880-3. | PubMed | Wajchenberg BL, Albergaria Pereira MA, Medonca BB, Latronico AC, Campos Carneiro P, Alves VA, et al. Adrenocortical carcinoma: clinical and laboratory observations. Cancer. 2000 Feb 15;88(4):711-36. | PubMed |
Wajchenberg BL, Albergaria Pereira MA, Medonca BB, Latronico AC, Campos Carneiro P, Alves VA, et al. Adrenocortical carcinoma: clinical and laboratory observations. Cancer. 2000 Feb 15;88(4):711-36. | PubMed | Schteingart DE, Doherty GM, Gauger PG, Giordano TJ, Hammer GD, Korobkin M, et al. Management of patients with adrenal cancer: recommendations of an international consensus conference. Endocr Relat Cancer. 2005 Sep;12(3):667-80. | PubMed |
Schteingart DE, Doherty GM, Gauger PG, Giordano TJ, Hammer GD, Korobkin M, et al. Management of patients with adrenal cancer: recommendations of an international consensus conference. Endocr Relat Cancer. 2005 Sep;12(3):667-80. | PubMed | Stojadinovic A, Brennan MF, Hoos A, Omeroglu A, Leung DH, Dudas ME, et al. Adrenocortical adenoma and carcinoma: histopathological and molecular comparative analysis. Mod Pathol. 2003 Aug;16(8):742-51. | PubMed |
Stojadinovic A, Brennan MF, Hoos A, Omeroglu A, Leung DH, Dudas ME, et al. Adrenocortical adenoma and carcinoma: histopathological and molecular comparative analysis. Mod Pathol. 2003 Aug;16(8):742-51. | PubMed | Malandrino P, Al Ghuzlan A, Castaing M, Young J, Caillou B, Travagli JP, et al. Prognostic markers of survival after combined mitotane- and platinum-based chemotherapy in metastatic adrenocortical carcinoma. Endocr Relat Cancer. 2010 Aug 16;17(3):797-807. | CrossRef | PubMed |
Malandrino P, Al Ghuzlan A, Castaing M, Young J, Caillou B, Travagli JP, et al. Prognostic markers of survival after combined mitotane- and platinum-based chemotherapy in metastatic adrenocortical carcinoma. Endocr Relat Cancer. 2010 Aug 16;17(3):797-807. | CrossRef | PubMed | Haak HR, Hermans J, van de Velde CJ, Lentjes EG, Goslings BM, Fleuren GJ, et al. Optimal treatment of adrenocortical carcinoma with mitotane: results in a consecutive series of 96 patients. Br J Cancer. 1994 May;69(5):947-51. | PubMed |
Haak HR, Hermans J, van de Velde CJ, Lentjes EG, Goslings BM, Fleuren GJ, et al. Optimal treatment of adrenocortical carcinoma with mitotane: results in a consecutive series of 96 patients. Br J Cancer. 1994 May;69(5):947-51. | PubMed | Heilmann P, Wagner P, Nawroth PP, Ziegler R. [Therapy of the adrenocortical carcinoma with Lysodren (o,p'-DDD). Therapeutic management by monitoring o,p'-DDD blood levels]. Med Klin (Munich). 2001 Jul 15;96(7):371-7. | PubMed |
Heilmann P, Wagner P, Nawroth PP, Ziegler R. [Therapy of the adrenocortical carcinoma with Lysodren (o,p'-DDD). Therapeutic management by monitoring o,p'-DDD blood levels]. Med Klin (Munich). 2001 Jul 15;96(7):371-7. | PubMed | Pommier RF, Brennan MF. An eleven-year experience with adrenocortical carcinoma. Surgery. 1992 Dec;112(6):963-70; discussion 970-1. | PubMed |
Pommier RF, Brennan MF. An eleven-year experience with adrenocortical carcinoma. Surgery. 1992 Dec;112(6):963-70; discussion 970-1. | PubMed | Williamson SK, Lew D, Miller GJ, Balcerzak SP, Baker LH, Crawford ED. Phase II evaluation of cisplatin and etoposide followed by mitotane at disease progression in patients with locally advanced or metastatic adrenocortical carcinoma: a Southwest Oncology Group Study. Cancer. 2000 Mar 1;88(5):1159-65. | PubMed |
Williamson SK, Lew D, Miller GJ, Balcerzak SP, Baker LH, Crawford ED. Phase II evaluation of cisplatin and etoposide followed by mitotane at disease progression in patients with locally advanced or metastatic adrenocortical carcinoma: a Southwest Oncology Group Study. Cancer. 2000 Mar 1;88(5):1159-65. | PubMed | Berruti A, Terzolo M, Sperone P, Pia A, Della Casa S, Gross DJ, et al. Etoposide, doxorubicin and cisplatin plus mitotane in the treatment of advanced adrenocortical carcinoma: a large prospective phase II trial. Endocr Relat Cancer. 2005 Sep;12(3):657-66. | PubMed |
Berruti A, Terzolo M, Sperone P, Pia A, Della Casa S, Gross DJ, et al. Etoposide, doxorubicin and cisplatin plus mitotane in the treatment of advanced adrenocortical carcinoma: a large prospective phase II trial. Endocr Relat Cancer. 2005 Sep;12(3):657-66. | PubMed | Khan TS, Imam H, Juhlin C, Skogseid B, Gröndal S, Tibblin S, et al. Streptozocin and o,p'DDD in the treatment of adrenocortical cancer patients: long-term survival in its adjuvant use. Ann Oncol. 2000 Oct;11(10):1281-7. | PubMed |
Khan TS, Imam H, Juhlin C, Skogseid B, Gröndal S, Tibblin S, et al. Streptozocin and o,p'DDD in the treatment of adrenocortical cancer patients: long-term survival in its adjuvant use. Ann Oncol. 2000 Oct;11(10):1281-7. | PubMed | Fassnacht M, Terzolo M, Allolio B, Baudin E, Haak H, Berruti A, et al. Combination chemotherapy in advanced adrenocortical carcinoma. N Engl J Med. 2012 Jun 7;366(23):2189-97. | CrossRef | PubMed |
Fassnacht M, Terzolo M, Allolio B, Baudin E, Haak H, Berruti A, et al. Combination chemotherapy in advanced adrenocortical carcinoma. N Engl J Med. 2012 Jun 7;366(23):2189-97. | CrossRef | PubMed | Sperone P, Ferrero A, Daffara F, Priola A, Zaggia B, Volante M, et al. Gemcitabine plus metronomic 5-fluorouracil or capecitabine as a second-/third-line chemotherapy in advanced adrenocortical carcinoma: a multicenter phase II study. Endocr Relat Cancer. 2010 Apr 21;17(2):445-53. | CrossRef | PubMed |
Sperone P, Ferrero A, Daffara F, Priola A, Zaggia B, Volante M, et al. Gemcitabine plus metronomic 5-fluorouracil or capecitabine as a second-/third-line chemotherapy in advanced adrenocortical carcinoma: a multicenter phase II study. Endocr Relat Cancer. 2010 Apr 21;17(2):445-53. | CrossRef | PubMed | Kroiss M, Quinkler M, Johanssen S, van Erp NP, Lankheet N, Pöllinger A, et al. Sunitinib in refractory adrenocortical carcinoma: a phase II, single-arm, open-label trial. J Clin Endocrinol Metab. 2012 Oct;97(10):3495-503. | CrossRef | PubMed |
Kroiss M, Quinkler M, Johanssen S, van Erp NP, Lankheet N, Pöllinger A, et al. Sunitinib in refractory adrenocortical carcinoma: a phase II, single-arm, open-label trial. J Clin Endocrinol Metab. 2012 Oct;97(10):3495-503. | CrossRef | PubMed | Quinkler M, Hahner S, Wortmann S, Johanssen S, Adam P, Ritter C, et al. Treatment of advanced adrenocortical carcinoma with erlotinib plus gemcitabine. J Clin Endocrinol Metab. 2008 Jun;93(6):2057-62. | CrossRef | PubMed |
Quinkler M, Hahner S, Wortmann S, Johanssen S, Adam P, Ritter C, et al. Treatment of advanced adrenocortical carcinoma with erlotinib plus gemcitabine. J Clin Endocrinol Metab. 2008 Jun;93(6):2057-62. | CrossRef | PubMed | Haluska P, Worden F, Olmos D, Yin D, Schteingart D, Batzel GN, et al. Safety, tolerability, and pharmacokinetics of the anti-IGF-1R monoclonal antibody figitumumab in patients with refractory adrenocortical carcinoma. Cancer Chemother Pharmacol. 2010 Mar;65(4):765-73. | CrossRef | PubMed |
Haluska P, Worden F, Olmos D, Yin D, Schteingart D, Batzel GN, et al. Safety, tolerability, and pharmacokinetics of the anti-IGF-1R monoclonal antibody figitumumab in patients with refractory adrenocortical carcinoma. Cancer Chemother Pharmacol. 2010 Mar;65(4):765-73. | CrossRef | PubMed | Carden E. Kim S, Jones RL, Alam SM, Johnson FM, Stephens AW, Poondru S, et al. Phase I study of intermittent dosing of OSI-906, a dual tyrosine kinase inhibitor of insulin-like growthfactor-1 receptor (IGF-1R) and insulin receptor (IR) in patients with advanced solid tumors. J Clin Oncol 2010;28(Suppl.):15s [abstr 2530]. | CrossRef |
Carden E. Kim S, Jones RL, Alam SM, Johnson FM, Stephens AW, Poondru S, et al. Phase I study of intermittent dosing of OSI-906, a dual tyrosine kinase inhibitor of insulin-like growthfactor-1 receptor (IGF-1R) and insulin receptor (IR) in patients with advanced solid tumors. J Clin Oncol 2010;28(Suppl.):15s [abstr 2530]. | CrossRef | Fraenkel M, Gueorguiev M, Barak D, Salmon A, Grossman AB, Gross DJ. Everolimus therapy for progressive adrenocortical cancer. Endocrine. 2013 Aug;44(1):187-92. | CrossRef | PubMed |
Fraenkel M, Gueorguiev M, Barak D, Salmon A, Grossman AB, Gross DJ. Everolimus therapy for progressive adrenocortical cancer. Endocrine. 2013 Aug;44(1):187-92. | CrossRef | PubMed |