 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
El consumo cada vez mayor de productos de la medicina alternativa y complementaria ha permitido reconocer con más frecuencia los efectos deletéreos asociados y las interacciones que estos productos pueden ocasionar. Así en la literatura médica encontramos casos reportados de toxicidad hepática con Aloe (sábila), Camellia sinensis (té verde), Rhammus purshianus (cáscara sangrada), Aesculus hippocastanum (castaño de indias) y Valeriana officinalis (valeriana), entre otros. El presente caso trata sobre una paciente femenina que consumió en dos ocasiones cardo santo (Argemone mexicana L), con intervalo de un año entre un evento y otro. En ambas oportunidades desarrolló un cuadro de diarrea, ictericia y ataque al estado general con alteración en las pruebas de función hepática. Se excluyeron otras causas de hepatopatía. Se utilizaron escalas para evaluar efectos adversos en el hígado relacionados con medicamentos. Se recabó la información del expediente clínico de la paciente y se revisó la bibliografía relacionada con el tema. Se concluyó que existe la posibilidad de lesión hepática relacionada con el consumo de Argemone mexicana L, al menos en esta paciente.
La medicina alternativa y complementaria constituye una opción de salud, tanto en los individuos de las sociedades industrializadas como de aquellas en vías de desarrollo. Su consumo cada vez mayor ha permitido reconocer con más frecuencia los efectos deletéreos asociados y las interacciones que estos productos pueden ocasionar1-3. En la literatura médica existen casos reportados de toxicidad hepática con Aloe (sábila)4, Camellia sinensis (té verde)6, Rhammus purshianus (cáscara sangrada)7, Aesculus hippocastanum (castaño de indias)6,7, y Valeriana officinalis (valeriana)6,7, entre otros.
De acuerdo con la Biblioteca Digital de la Medicina Tradicional Mexicana, de la Universidad Nacional Autónoma de México9, el Cardo Santo o Chicalote (Argemone mexicana L), pertenece a la familia Papaveraceae. De origen americano8,9, se distribuye en todo el mundo en climas tropicales y subtropicales, lo que permite su desarrollo en el oeste de África e India10. Difiere del Cardo Mariano (Silybum marianum) por su origen europeo y aplicaciones11,1. Ambas plantas fueron descritas por Carlos Linneo, botánico sueco. En la planta están presentes alcaloides isoquinolínicos9,13 como la sanguinarina14.
Uno de sus alcaloides se postula como el principal constituyente tóxico de la Argemone mexicana L. Este alcaloide mostró un incremento en las aminotransferasas y deshidrogenasa láctica, así como vacuolización hepática, acumulación y peroxidación lípidica. Tras la administración de la sanguinarina en ratones, se observó además inducción de muerte celular, fragmentación del ADN e incremento en las especies reactivas de oxígeno y disfunción mitocondrial15. Desde 1993 se observó que puede inducir la inhibición de la Na/K-ATPasa, lo que a su vez puede inhibir el transporte activo de D-glucosa dependiente de la bomba de sodio16. En 1997 se reconoce que el aceite de Argemone ocasiona alteración en la biotransformación, tanto en la fase I como en la II, al interactuar con las proteínas del sistema P-45017. Las flores contienen flavonoides9,18 y las semillas el argemexitín, eriodictiol y luteolín; un aceite fijo en el que se encuentran los ácidos grasos argemónico, mexicánico y mexicanol9. La raíz contiene beta-sitosterol9. Hasta el momento, los mecanismos propuestos de toxicidad de la Argemone mexicana L incluyen lesión de la membrana celular por las especies reactivas de oxígeno y la peroxidación lipídica, inhibición de la ADN-polimerasa y la acumulación de piruvato debido a un aumento en la glucogenolisis19,20.
Actualmente se reconoce a la Argemone mexicana L como responsable de la ascitis epidémica21 en países como India, Islas Mauricio y Fiji, algunos distritos del noroeste de Sudáfrica, Birmania y Madagascar. Esta rara forma de ascitis se reportó en 2.552 casos con 65 muertes entre el 5 de agosto y el 12 de octubre de 1998 en Nueva Deli, India. Esto fue consecuencia de la adulteración de aceites comestibles con semillas de Argemone mexicana L22, que fueron utilizadas en la preparación de alimentos y en masajes corporales23. La enfermedad comienza como un trastorno gastrointestinal, diarrea y disentería seguido de oliguria, edema distal, eritema cutáneo, dificultad para respirar con ortopnea, insuficiencia cardíaca derecha con el ventrículo izquierdo normal, anemia grave e hipoalbuminemia. Existe disminución de la tasa de filtración glomerular (TFG), leve a moderada azoemia, necrosis tubular aguda, hipoxia moderada con alcalosis respiratoria y congestión venosa hepática24.
Se trata de una paciente de sexo femenino, de 55 años de edad, con antecedentes quirúrgicos de colecistectomía, hernioplastia, una cesárea y salpingoclasia. En sus consultas iniciales negó ser consumidora de bebidas alcohólicas, ni usuaria de productos de medicina alternativa y complementaria tales como herbolaria, homeopatía, acupuntura y productos de compañías multinivel. Acudió a consulta en mayo de 2012 por pérdida de la consistencia de las heces de cuatro días de evolución, tenesmo, náusea sin vómito, cefalea y fatiga. Negó la presencia de fiebre. La exploración física en dicha ocasión mostró un índice de masa corporal (IMC) de 26,3, signos vitales dentro de parámetros normales y la presencia de coloración amarillenta en las escleras de los ojos de leve intensidad, dolor a la palpación de cuadrante superior derecho, sin hepatomegalia o crecimiento del hígado.
Los exámenes realizados mostraron valores por debajo de lo normal para eritrocitos, con leucocitos y tiempo de protombina normales, aminotransferasas y bilirrubinas elevadas (véase Tabla I). Se realizó serología viral para determinación de anticuerpos para hepatitis A (anti HVA-IgM), antígeno y anticuerpo para hepatitis B (HBsAg, anti-HBc), anticuerpo para hepatitis C (anti-HVC) y anticuerpo para hepatitis E (Anti-HVE-IgM), resultando negativos. El ultrasonido abdominal no presentó alteraciones. Un mes después (junio de 2012), la paciente se refirió asintomática, sólo persistiendo la coloración amarillenta de las escleras de los ojos y dolor subcostal derecho a la palmopercusión de la exploración física. Los glóbulos rojos y plaquetas estaban normales, las aminotrasferasas y las bilirrubinas disminuyen un 50% (Tabla I). En su tercera consulta continúa asintomática, ya no existe ictericia ni dolor subcostal derecho. Se normalizaron las aminostrasferasas y bilirrubinas (bilirrubina total de 1,10 mg). El examen físico con leve ictericia en la esclera ocular.
Acude a consulta un año después por presentar dolor abdominal que cede parcialmente con té herbal no especificado. Nuevamente presenta pérdida de la consistencia de las heces (de 8 a 10 en 24 horas), sin mucosidad o sangre, debilidad generalizada, dolor de cabeza, sensación de fiebre sin cuantificar temperatura. La persistencia del dolor abdominal ocasiona que le apliquen antibiótico, cefalosporina y butilhioscina.
La exploración física demostró un IMC de 26, signos vitales dentro de parámetros normales, coloración amarillenta de las escleras de los ojos, borde hepático a tres centímetros por debajo del reborde costal derecho, dolor hipogastrio a la palpación media. Las pruebas de función hepática mostraron elevación de transaminasas y bilirrubinas. La biometría hemática presentó hemoglobina de 11,7 g/dl (Tabla I).
El ultrasonido abdominal reportó hepatomegalia a expensas del lóbulo derecho, sin modificación en la ecogenicidad. La serología viral para determinar anticuerpos para hepatitis A, B, C y E, además de anticuerpos contra toxoplasma, citomegalovirus, herpes y rubéola, antimúsculo liso, antinucleares y antimitocondriales, fueron todos negativos. La determinación de cobre sérico (161,4 mcg/dl, VN=70-175 mcg/dl) y ceruloplasmina (0,29 g/L VN=0,20-0,60) fueron normales.
La paciente reconoció haber consumido tanto en 2012 como en 2013 cardo santo (Argemone mexicana L) hasta la aparición de los síntomas como coadyuvante de trastornos digestivos. Actualmente la paciente se encuentra sin manifestaciones clínicas con exámenes normales.
Se utilizó la escala María y Victorino29 para el diagnóstico de daño hepático inducido por fármacos para evaluar el presente caso. El puntaje fue de 19, situándola como definida (Tabla II). Los resultados obtenidos con la escala del Consejo de Organizaciones Internacionales de Ciencias Médicas (Council for International Organizations of Medical Sciences⁄Roussel Uclaf Causality Assessment Method / CIOMS/RUCAM)*, utilizando el ordenador en línea fue de 11, ubicando a la reacción adversa por Argemone mexicana L como altamente probable. Mientras que la escala de Naranjo (Adverse Drug Reactions Probability Scale, NADRPS), el puntaje fue de 8, dando resultado de probable (Tabla III).
Tabla I. Parámetros de laboratorio.
Tabla II. Escala diagnóstica de María-Victorino29 adaptada al caso clínico.
Hasta el momento se ha documentado la relación entre la Argemone mexicana L y la ascitis epidémica21-24. Uno de sus alcaloides, la sanguinarina, se ha reconocido hasta el momento como el más tóxico14. Sin embargo, su papel como agente causal de daño hepático en humanos no asociado a ascitis epidémica, no está documentado en la literatura médica.
En el caso presentado se manifiesta como la pérdida de la consistencia de las heces y el incremento en el número de las mismas (diarrea), referida por la paciente en las dos ocasiones. La diarrea se describe en la ascitis epidémica con al menos dos mecanismos como consecuencia de los componentes de la Argemone mexicana L. Se trata principalmente de la sanguinaria y dehidrosanguinarina. Éstas provocan estimulación aumentada del tono muscular intestinal30 y citotoxicidad directa sobre los enterocitos31. En animales de experimentación se ha observado una inmediata estimulación del tono y de los movimientos peristálticos del intestino. Además se describe una infiltración linfocitaria severa de la mucosa y submucosa gastrointestinal30,31,32.
El descenso observado en el conteo de glóbulos rojos y plaquetas en ambos períodos de atención se explica por el efecto genotóxico de la sanguinarina. La sanguinarina puede intercalarse con el ADN debido a su estructura planar. De igual forma, su naturaleza catiónica le permite unirse a las membranas cargadas negativamente y su reactividad frente a grupos tiol interfiere con un número de enzimas citosólicas32. Se ha observado tanto en los eritrocitos de humanos como en los de animales de experimentación, depleción de la glutatión reductasa, de la deshidrogenasa de glucosa-6-fosfato y glutation S-transferasa. Existe un incremento en la oxidación de los lípidos de la membrana eritrocitaria (la membrana plaquetaria es rica en fosfolípidos) y una reducción del contenido de alfa-tocoferol eritrocitario. Esto indica una disminución en el potencial de eliminación de los radicales libres o una limitación en el transporte de alfa-tocoferol del hígado a los eritrocitos, lo que permite un incremento en la oxidación de lípidos y proteínas en los eritrocitos33. Por otra parte, la saguinarina inhibe la movilización de calcio plaquetario y la producción de tromboxano, suprimiendo la actividad de la enzima ciclooxigenasa-1 (COX-1)34,35.
La elevación de las aminotransferasas se ha asociado a la inducción de alteraciones en la biotransformación, tanto en la fase I como en la II. La sanguinarina, al interactuar con las proteínas del sistema p-45017 y el glutatión, disminuye su actividad e incrementa el sorbitol deshidrogenasa y alanina aminotransferasa36. La sanguinarina en roedores (a dosis de 10 mg/kg), incrementa las cifras de aminotransferasas, disminuye la actividad del sistema microsomal hepático (CIP-450) y de la N-desmetilasa-benzefetamina, con cambios en el hígado tanto en el tamaño como degenerativos progresivos y necrosis31,36. Ello puede provocar vacuolización hepática, acumulación y peroxidación lípidica15.
Uno de los órganos blanco, descrito en la toxicidad asociada a la Argemone mexicana L, es el hígado. La ictericia escleral ocular, el dolor en el cuadrante superior derecho de la paciente, así como la elevación de las bilirrubinas está en relación con el proceso inflamatorio agudo (hepatitis), inducido por el cardo santo (Argemone mexicana L). En la ascitis epidémica se han descrito cambios en los hepatocitos (como edema, cambios hidrópicos y degeneración del núcleo), dilatación de las venas y sinusoides, infiltración grasa, fibrosis e hiperplasia de los conductos biliares22.
La confirmación de daño hepático inducido por fármacos o por productos de la medicina alternativa y complementaria, llámese herbolaria, homeopatía o compuestos de los productos de compañías multinivel, se consideran en la actualidad un reto. En la mayor parte de los casos se diagnostica excluyendo otras causas de hepatotoxicidad y sobre bases circunstanciales37, puesto que no existe una prueba específica que permita establecer la relación causa-efecto y, en consecuencia, establecer el diagnóstico.
Las escalas diagnósticas para determinar el daño inducido por fármacos fueron creadas para identificar una reacción adversa a un producto farmacológico. Posteriormente se adecuaron a los productos de la herbolaria. Si bien existen varias, las más utilizadas son la escala del Consejo de Organizaciones Internacionales de Ciencias Médicas (Council for International Organizations of Medical Sciences⁄Roussel Uclaf Causality Assessment Method/CIOMS/RUCAM)38, que para algunos autores resulta compleja y difícil de aplicar en la práctica diaria37. En nuestro caso, la puntuación obtenida utilizando el computador en línea fue de 11, lo que sitúa a la reacción adversa por Argemone mexicana L como altamente probable. Mientras que la escala de Naranjo (Adverse Drug Reactions Probability Scale (NADRPS)39, sin bien es sencilla de aplicar, puede resultar no órgano-específica40. Aplicada en este caso particular el puntaje fue de 8, dando como resultado de probable (véase Tabla III). Finalmente, la escala de María y Victorino publicada en 199729, que en este caso tuvo un puntaje de 19, situándola como definida (Tabla II).
A pesar de que las pruebas de seguridad aplicadas a los medicamentos son intensas antes de su salida al mercado o venta, las reacciones adversas suelen aparecer una vez en comercialización. Ello obliga a las compañías farmacéuticas a establecer programas de vigilancia, lo que no sucede con la totalidad de los productos de la herbolaria. En el caso de los fármacos, las reacciones adversas reportadas no reflejan la realidad, ya sea por la falta de reportes o desinterés por hacerlo. Dicha situación es más seria en lo referente a los productos de la medicina alternativa y complementaria.
La toxicidad asociada a la Argemone mexicana L es reconocida, así como su relación con la ascitis epidémica. Hasta ahora, no existe en la literatura médica un reporte de hepatopatía secundaria a su consumo. Aquí radica el interés de este trabajo, ya que puede servir como antecedente para reportes futuros.
*CIOMS/RUCAM Scale.Roussel Uclaf Causality Assessment MethodmCIOMS/RUCAM Scale [online calculator] - Medical Calculators disponible en: http://goo.gl/y3BRZ
El autor ha completado el formulario de declaración de conflictos de intereses del ICMJE traducido al castellano por Medwave, y declara no haber recibido financiamiento para la realización de la investigación; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. El formulario puede ser solicitado contactando al autor responsable.
El autor adjunta declaración de consentimiento de la sobrina de la paciente descrita en este estudio, documento donde ella acepta que la información sobre el caso de su tía sea reportada en el artículo publicado por Medwave.

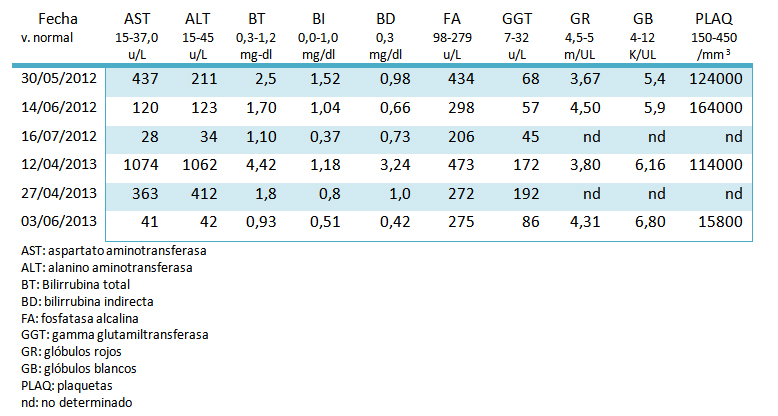 Tabla I. Parámetros de laboratorio.
Tabla I. Parámetros de laboratorio.

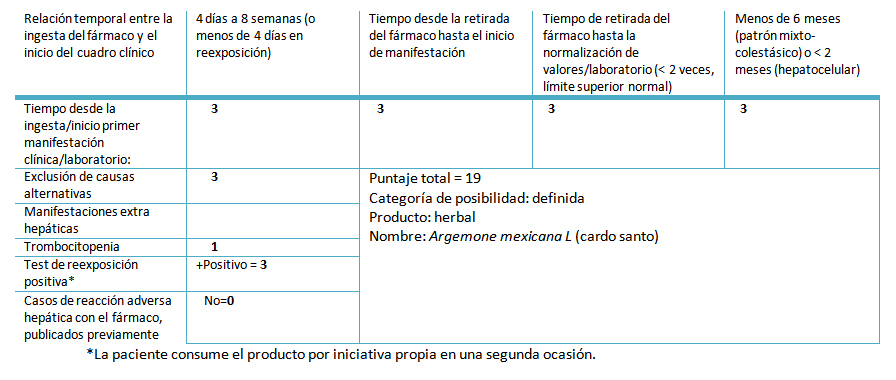 Tabla II. Escala diagnóstica de María-Victorino29 adaptada al caso clínico.
Tabla II. Escala diagnóstica de María-Victorino29 adaptada al caso clínico.

 Tabla III. Escala diagnóstica para reacciones adversas por medicamentos de Naranjo39, adaptada al caso.
Tabla III. Escala diagnóstica para reacciones adversas por medicamentos de Naranjo39, adaptada al caso.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

The increasing consumption of alternative medicines has lead to a greater awareness about the deleterious effects and interactions that these products can induce. Consequently, medical literature reports liver toxicity from Aloe, Camellia sinensis (green tea), Rhammus purshianus, Aesculus hippocastanum (buckeye) and Valeriana officinalis (valerian), among others. This article reports a female patient who twice consumed Mexican poppy (Argemone mexicana L) with a one-year interval between ingestions. Both times she developed diarrhea, jaundice and general malaise with impaired liver function tests. Other causes of liver disease were ruled out. Questionnaires were used to assess the possibility of drug-induced liver damage. Clinical information was collected from the patient’s medical record and the literature on the subject was reviewed. We conclude that, at least in this case, the most likely cause of liver toxicity was Argemone mexicana L consumption.
 Autor:
Carlos Alfredo Meléndez González[1]
Autor:
Carlos Alfredo Meléndez González[1]

Citación: Meléndez CA. Risks of herbalism: a case report of Mexican poppy (Argemone mexicana L) induced liver toxicity. Medwave 2013;13(7):e5763 doi: 10.5867/medwave.2013.07.5763
Fecha de envío: 28/6/2013
Fecha de aceptación: 25/8/2013
Fecha de publicación: 28/8/2013
Origen: no solicitado
Tipo de revisión: con revisión externa por tres pares revisores, a doble ciego
Citaciones asociadas
1. Editores. Masthead Aug;13(7). Medwave 2013;13(7):5768 | Link |

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Langmead L, Rampton DS. Review article: herbal treatment in gastrointestinal and liver disease benefits and dangers. Aliment Pharmacol Ther. 2001;15:1239-1252. | CrossRef |
Langmead L, Rampton DS. Review article: herbal treatment in gastrointestinal and liver disease benefits and dangers. Aliment Pharmacol Ther. 2001;15:1239-1252. | CrossRef | Hermann R and Von Richter O. Clinical evidence of herbal drugs as perpetrators of pharmacokinetic drug interactions. Planta Med. 2012 S;78(13):1458-77. | CrossRef |
Hermann R and Von Richter O. Clinical evidence of herbal drugs as perpetrators of pharmacokinetic drug interactions. Planta Med. 2012 S;78(13):1458-77. | CrossRef | Etheridge AS, Black SR, Patel PR, So J, Mathews JM. An in vitro evaluation of cytochrome P450 inhibition and P-glycoprotein interaction with goldenseal, ginkgo biloba, grape seed, milk thistle, and ginseng extracts and their constituents. Planta Med. 2007 Jul;73(8):731-41. | CrossRef |
Etheridge AS, Black SR, Patel PR, So J, Mathews JM. An in vitro evaluation of cytochrome P450 inhibition and P-glycoprotein interaction with goldenseal, ginkgo biloba, grape seed, milk thistle, and ginseng extracts and their constituents. Planta Med. 2007 Jul;73(8):731-41. | CrossRef | Rabe C, Musch A, Schirmacher P, Kruis W, Hoffmann R. Acute hepatitis induced by an aloe vera preparation: a case report. World J Gastroenterol. 2005; 11(2):303-304. | Link |
Rabe C, Musch A, Schirmacher P, Kruis W, Hoffmann R. Acute hepatitis induced by an aloe vera preparation: a case report. World J Gastroenterol. 2005; 11(2):303-304. | Link | García-Cortés M, Borraz Y, Lucena MI, Peláez G, Salmerón J, Diago M, et al. Hepatotoxicidad secundaria a “productos naturales”: análisis de los casos notificados al Registro Español de Hepatotoxicidad. Rev Esp Enferm Dig. 2008 Nov;100(11):688-95. | CrossRef | PubMed |
García-Cortés M, Borraz Y, Lucena MI, Peláez G, Salmerón J, Diago M, et al. Hepatotoxicidad secundaria a “productos naturales”: análisis de los casos notificados al Registro Español de Hepatotoxicidad. Rev Esp Enferm Dig. 2008 Nov;100(11):688-95. | CrossRef | PubMed | Rohde J, Jacobsen C, Kromann-Andersen H. Toxic hepatitis triggered by green tea (Toksisk hepatitis udløst af grøn te). Ugeskr Laeger. 2011 Jan 17;173(3):205-6. | PubMed |
Rohde J, Jacobsen C, Kromann-Andersen H. Toxic hepatitis triggered by green tea (Toksisk hepatitis udløst af grøn te). Ugeskr Laeger. 2011 Jan 17;173(3):205-6. | PubMed | Byung-Min Ahn. Hepatotoxicity, herbs and alternative medicine, causality assessment method, idiosyncrasy. Korean J Gastroenterol. 2004 Sep;44(3):113-25. | PubMed |
Byung-Min Ahn. Hepatotoxicity, herbs and alternative medicine, causality assessment method, idiosyncrasy. Korean J Gastroenterol. 2004 Sep;44(3):113-25. | PubMed | Chicalote. Atlas de las Plantas de la Medicina Tradicional Mexicana. medicinatradicionalmexicana. unam.mx. [on line] | Link |
Chicalote. Atlas de las Plantas de la Medicina Tradicional Mexicana. medicinatradicionalmexicana. unam.mx. [on line] | Link | Ibrahim HA, Ibrahim H. Phytochemical screening and toxicity evaluation on the leaves of Argemone mexicana Linn. (Papaveraceae). Int Jor App Sci. 2009;3:39-43.
Ibrahim HA, Ibrahim H. Phytochemical screening and toxicity evaluation on the leaves of Argemone mexicana Linn. (Papaveraceae). Int Jor App Sci. 2009;3:39-43.  Sarris J, McIntyre E, Camfield D. Plant-Based Medicines for Anxiety Disorders, Part 2: A Review of Clinical Studies with Supporting Preclinical Evidence. CNS Drugs. 2013;27(4):301-19. | CrossRef |
Sarris J, McIntyre E, Camfield D. Plant-Based Medicines for Anxiety Disorders, Part 2: A Review of Clinical Studies with Supporting Preclinical Evidence. CNS Drugs. 2013;27(4):301-19. | CrossRef | Ayesha, Jahan N, Rahman K, Nosheen S. Gemmomodification: an emerging source of natural antioxidants from Silybum marianum. Pak J Pharm Sci. 2013 May;26(3):585-91. | PubMed |
Ayesha, Jahan N, Rahman K, Nosheen S. Gemmomodification: an emerging source of natural antioxidants from Silybum marianum. Pak J Pharm Sci. 2013 May;26(3):585-91. | PubMed | Cahlíková L, Kucera R, Hoštálková A, Klimeš J, Opletal L. Identification of Pavinane Alkaloids in the Genera Argemone and Eschscholzia. Nat Prod Commun. 2012 Oct;7(10):1279-81. | PubMed |
Cahlíková L, Kucera R, Hoštálková A, Klimeš J, Opletal L. Identification of Pavinane Alkaloids in the Genera Argemone and Eschscholzia. Nat Prod Commun. 2012 Oct;7(10):1279-81. | PubMed | Vázquez-Flota FA, Monforte-González M, Guízar-González C, Rubio-Piña J, Trujillo-Villanueva K. Establishment of a sanguinarine-producing cell suspension culture of Argemone mexicana L (Papaveraceae): induction of alkaloid accumulation. Methods Mol Biol. 2012;877:271-6. | CrossRef |
Vázquez-Flota FA, Monforte-González M, Guízar-González C, Rubio-Piña J, Trujillo-Villanueva K. Establishment of a sanguinarine-producing cell suspension culture of Argemone mexicana L (Papaveraceae): induction of alkaloid accumulation. Methods Mol Biol. 2012;877:271-6. | CrossRef | Choy CS, Cheah KP, Chiou HY, Li JS, Liu YH, Yong SF, et al. Induction of hepatotoxicity by sanguinarine is associated with oxidation of protein thiols and disturbance of mitochondrial respiration. J Appl Toxicol. 2008;28(8):945-56. | PubMed |
Choy CS, Cheah KP, Chiou HY, Li JS, Liu YH, Yong SF, et al. Induction of hepatotoxicity by sanguinarine is associated with oxidation of protein thiols and disturbance of mitochondrial respiration. J Appl Toxicol. 2008;28(8):945-56. | PubMed | Tandon S, Das M, Khanna SK. Effect of sanguinarine on the transport of essential nutrients in an everted gut sac model: role of Na+,K(+)-ATPase. Nat Toxins. 1993;1(4):235-40. | CrossRef | PubMed |
Tandon S, Das M, Khanna SK. Effect of sanguinarine on the transport of essential nutrients in an everted gut sac model: role of Na+,K(+)-ATPase. Nat Toxins. 1993;1(4):235-40. | CrossRef | PubMed | Das M, Khanna SK. Type II binding spectra with hepatic cytochrome P-450 (P-450) protein, thereby causing loss of P-450 content and an impairment of phase I and phase II enzymes. Crit Rev Toxicol. 1997 May;27(3):273-97. | PubMed |
Das M, Khanna SK. Type II binding spectra with hepatic cytochrome P-450 (P-450) protein, thereby causing loss of P-450 content and an impairment of phase I and phase II enzymes. Crit Rev Toxicol. 1997 May;27(3):273-97. | PubMed | Waizel Haiat S, Waizel Bucay J. Algunas plantas utilizadas en México para el tratamiento del asma. Artículo de revisión. An Orl Mex. 2009;54(4):145-71. | Link |
Waizel Haiat S, Waizel Bucay J. Algunas plantas utilizadas en México para el tratamiento del asma. Artículo de revisión. An Orl Mex. 2009;54(4):145-71. | Link | Neeharika S, Aishwarya SC, Bechan S, Isolation and Characterization of Some Phytochemicals from Indian Traditional Plants. Biotech Res Int. 2012; Article ID 549850, 8 p. | CrossRef |
Neeharika S, Aishwarya SC, Bechan S, Isolation and Characterization of Some Phytochemicals from Indian Traditional Plants. Biotech Res Int. 2012; Article ID 549850, 8 p. | CrossRef | Brahmachari G, Gorai D, Roy R. Argemone mexicana: chemical and pharmacological aspects. Rev bras farmacogn. 2103; 23(3). | CrossRef |
Brahmachari G, Gorai D, Roy R. Argemone mexicana: chemical and pharmacological aspects. Rev bras farmacogn. 2103; 23(3). | CrossRef | Thatte U, Dahanukar S.J The Mexican poppy poisons the Indian mustard facts and figures. J Assoc Physicians India. 1999 Mar;47(3):332-5. | PubMed |
Thatte U, Dahanukar S.J The Mexican poppy poisons the Indian mustard facts and figures. J Assoc Physicians India. 1999 Mar;47(3):332-5. | PubMed | Sharma B, Malhotra S, Bhatia V, Rathee M. Epidemic dropsy in India. Postgrad Med J 1999;75:657–661. | CrossRef | PubMed | PMC |
Sharma B, Malhotra S, Bhatia V, Rathee M. Epidemic dropsy in India. Postgrad Med J 1999;75:657–661. | CrossRef | PubMed | PMC | Sood NN, Sachdev MS, Mohan M, Gupta SK, Sachdev HP. Epidemic dropsy following transcutaneous absorption of Argemone mexicana oil. Trans R Soc Trop Med Hyg. 1985;79(4):510-2. | CrossRef | PubMed |
Sood NN, Sachdev MS, Mohan M, Gupta SK, Sachdev HP. Epidemic dropsy following transcutaneous absorption of Argemone mexicana oil. Trans R Soc Trop Med Hyg. 1985;79(4):510-2. | CrossRef | PubMed | Sharma BD, Bhatia V, Rahtee M, Kumar R, Mukharjee A. Epidemic dropsy: observations on pathophysiology and clinical features during the Delhi epidemic of 1998. Trop Doct. 2002 Apr;32(2):70-5. | PubMed |
Sharma BD, Bhatia V, Rahtee M, Kumar R, Mukharjee A. Epidemic dropsy: observations on pathophysiology and clinical features during the Delhi epidemic of 1998. Trop Doct. 2002 Apr;32(2):70-5. | PubMed | Dong XZ, Zhang M, Wang K, Liu P, Guo DH, Zheng XL, et al. Sanguinarine inhibits vascular endothelial growth factor release by generation of reactive oxygen species in mcf-7 human mammary adenocarcinoma cells. Biomed Res Int. 2013;2013:517698. | CrossRef | PubMed | PMC |
Dong XZ, Zhang M, Wang K, Liu P, Guo DH, Zheng XL, et al. Sanguinarine inhibits vascular endothelial growth factor release by generation of reactive oxygen species in mcf-7 human mammary adenocarcinoma cells. Biomed Res Int. 2013;2013:517698. | CrossRef | PubMed | PMC | 26.
Han MH, Park C, Jin C-Y, Kim G-Y, Chang Y-C, et al. Apoptosis Induction of Human Bladder Cancer Cells by Sanguinarine through Reactive Oxygen Species-Mediated Up-Regulation of Early Growth Response Gene-1. PLoS One. 2013 May 22;8(5):e63425. | CrossRef | PubMed | PMC |
26.
Han MH, Park C, Jin C-Y, Kim G-Y, Chang Y-C, et al. Apoptosis Induction of Human Bladder Cancer Cells by Sanguinarine through Reactive Oxygen Species-Mediated Up-Regulation of Early Growth Response Gene-1. PLoS One. 2013 May 22;8(5):e63425. | CrossRef | PubMed | PMC | Han MH, Kim GY, Yoo YH, Choi YH.Sanguinarine induces apoptosis in human colorectal cancer HCT-116 cells through ROS-mediated Egr-1 activation and mitochondrial dysfunction. Toxicol Lett. 2013;220(2):157-66. | CrossRef | PubMed |
Han MH, Kim GY, Yoo YH, Choi YH.Sanguinarine induces apoptosis in human colorectal cancer HCT-116 cells through ROS-mediated Egr-1 activation and mitochondrial dysfunction. Toxicol Lett. 2013;220(2):157-66. | CrossRef | PubMed | Vaqar Mustafa A, Moammir Hasan A, Mukhtar H, Nihal A. Activation of Prodeath Bcl-2 Family Proteins and Mitochondrial Apoptosis Pathway by Sanguinarine in Immortalized Human HaCaT Keratinocytes. Clin Cancer Res. 2003 Aug 1;9(8):3176-82. | PubMed |
Vaqar Mustafa A, Moammir Hasan A, Mukhtar H, Nihal A. Activation of Prodeath Bcl-2 Family Proteins and Mitochondrial Apoptosis Pathway by Sanguinarine in Immortalized Human HaCaT Keratinocytes. Clin Cancer Res. 2003 Aug 1;9(8):3176-82. | PubMed | María VA, Victorino RM. Development and Validation of a Clinical Scale for the Diagnosis of Drug-Induced Hepatitis. Hepatology. 1997 Sep;26(3):664-9. | CrossRef | PubMed |
María VA, Victorino RM. Development and Validation of a Clinical Scale for the Diagnosis of Drug-Induced Hepatitis. Hepatology. 1997 Sep;26(3):664-9. | CrossRef | PubMed | Das M, Khanna SK. Clinicoepidemiological, toxicological, and safety evaluation studies on argemone oil. Crit Rev Toxicol. 1997 May;27(3):273-97. | CrossRef | PubMed |
Das M, Khanna SK. Clinicoepidemiological, toxicological, and safety evaluation studies on argemone oil. Crit Rev Toxicol. 1997 May;27(3):273-97. | CrossRef | PubMed | El gamal AA, Mohamed OSA, Khalid SA. Toxicity of argemone mexicana seed, seed oil and their extracts on albino rats. JST. 2007;8(1). | Link |
El gamal AA, Mohamed OSA, Khalid SA. Toxicity of argemone mexicana seed, seed oil and their extracts on albino rats. JST. 2007;8(1). | Link | Vázquez-Flota FA, Monforte M, Guízar-González C, Rubio-Piña J, Trujillo-Villanueva K. Establishment of a Sanguinarine-Producing Cell Suspension Culture of Argemone mexicana L (Papaveraceae): Induction of Alkaloid Accumulation. Methods Mol Biol. 2012;877:271-6. | CrossRef | PubMed |
Vázquez-Flota FA, Monforte M, Guízar-González C, Rubio-Piña J, Trujillo-Villanueva K. Establishment of a Sanguinarine-Producing Cell Suspension Culture of Argemone mexicana L (Papaveraceae): Induction of Alkaloid Accumulation. Methods Mol Biol. 2012;877:271-6. | CrossRef | PubMed | Babu CK, Khanna SK, Das M.Antioxidant status of erythrocytes and their response to oxidative challenge in humans with argemone oil poisoning. Toxicol Appl Pharmacol. 2008;230(3):304-11. | CrossRef | PubMed |
Babu CK, Khanna SK, Das M.Antioxidant status of erythrocytes and their response to oxidative challenge in humans with argemone oil poisoning. Toxicol Appl Pharmacol. 2008;230(3):304-11. | CrossRef | PubMed | Jeng JH, Wu HL, Lin BR, Lan WH, Chang HH, Ho YS, et al. Antiplatelet effect of sanguinarine is correlated to calcium mobilization, thromboxane and cAMP production. Atherosclerosis. 2007 Apr;191(2):250-8. | CrossRef | PubMed |
Jeng JH, Wu HL, Lin BR, Lan WH, Chang HH, Ho YS, et al. Antiplatelet effect of sanguinarine is correlated to calcium mobilization, thromboxane and cAMP production. Atherosclerosis. 2007 Apr;191(2):250-8. | CrossRef | PubMed | Mackraj I. Govender Thirumala, Gathiram Prem. Sanguinarine Cardiovasc Ther. 2008 Spring;26(1):75-83. | CrossRef | PubMed |
Mackraj I. Govender Thirumala, Gathiram Prem. Sanguinarine Cardiovasc Ther. 2008 Spring;26(1):75-83. | CrossRef | PubMed | Williams MK, Dalvi S, Dalvi RR. Influence of 3-methylcholanthrene pretreatment on sanguinarine toxicity in mice. Vet Hum Toxicol. 2000 Aug;42(4):196-8. | PubMed |
Williams MK, Dalvi S, Dalvi RR. Influence of 3-methylcholanthrene pretreatment on sanguinarine toxicity in mice. Vet Hum Toxicol. 2000 Aug;42(4):196-8. | PubMed | Fontana RJ, Seeff LB, Andrade RJ, Björnsson E, Day CP, Serrano J, et al. Standardization of nomenclature and causality assessment in drug-induced liver injury: summary of a clinical research workshop. Hepatology. 2010 Aug;52(2):730-42. | CrossRef | PubMed | PMC |
Fontana RJ, Seeff LB, Andrade RJ, Björnsson E, Day CP, Serrano J, et al. Standardization of nomenclature and causality assessment in drug-induced liver injury: summary of a clinical research workshop. Hepatology. 2010 Aug;52(2):730-42. | CrossRef | PubMed | PMC | Danan G, Benichou C. Causality assessment of adverse reactions to drugs--I. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries. J Clin Epidemiol. 1993 Nov;46(11):1323-30. | CrossRef | PubMed |
Danan G, Benichou C. Causality assessment of adverse reactions to drugs--I. A novel method based on the conclusions of international consensus meetings: application to drug-induced liver injuries. J Clin Epidemiol. 1993 Nov;46(11):1323-30. | CrossRef | PubMed | Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981 Aug;30(2):239-45. | CrossRef | PubMed |
Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981 Aug;30(2):239-45. | CrossRef | PubMed | García Cortés M. Evaluación de causalidad en hepatotoxicidad. Comparación de la operatividad de una escala general, escala de Naranjo,con la escala específica de Cioms. [Tesis doctoral] Universidad de Málaga. 2006. | Link |
García Cortés M. Evaluación de causalidad en hepatotoxicidad. Comparación de la operatividad de una escala general, escala de Naranjo,con la escala específica de Cioms. [Tesis doctoral] Universidad de Málaga. 2006. | Link | Entrevista a naturópata chileno
Entrevista a naturópata chileno