 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
La esterilización es el conjunto de operaciones destinadas a eliminar cualquier forma de vida en un material sanitario. Es una de las tareas en que se apoya la seguridad de los pacientes, ya que para su atención se necesitan elementos estériles. El presente artículo tiene como objetivos identificar las etapas del flujograma de trabajo en la central de esterilización, describir algunas consideraciones importantes en cada una de las etapas y servir como herramienta para unificar criterios entre las personas que tienen esta gran responsabilidad en su quehacer diario. Es fundamental que las personas encargadas de estas tareas conozcan todo lo relacionado con este proceso, para que así puedan dirigir sus esfuerzos a garantizar que el producto termine y se mantenga con la condición de esterilidad.
Durante el siglo XIX, se descubrió que muchas enfermedades y dolencias son causadas por bacterias y microorganismos que generalmente están presentes en nuestro entorno, originando problemas cuando se perturba su equilibrio natural o cuando ingresan al cuerpo humano, produciendo la enfermedad.
En los hospitales se presentan muchas ocasiones para que los microorganismos invadan el cuerpo humano; un método importante para evitarlo es mediante la esterilización de todos los instrumentos sanitarios (1), entendida como el conjunto de operaciones destinadas a eliminar todos los microorganismos contenidos en un objeto o sustancias (2), siendo ésta una de las tareas prioritarias para conseguir la seguridad y protección que demanda la atención de los pacientes, ya que la mayoría de las técnicas ejecutadas requieren de elementos estériles.
La esterilización es el resultado de un proceso, no sólo de la exposición al agente esterilizante. Para conseguir material estéril se deben realizar una serie de procedimientos independientes, que deben ser identificados en el momento de establecer el flujograma de trabajo y que tienen importancia en el resultado. Si existe una falla en cualquiera de ellos, el material no podrá considerarse estéril, aunque haya sido sometido a un método de esterilización.
El conocimiento de que existen infecciones intrahospitalarias documentadas, ocurridas en relación a procedimientos inapropiados de descontaminación, limpieza y/o esterilización de distintos materiales utilizados en los pacientes, ha hecho que surja la necesidad de revisar este tema.
El presente trabajo pretende identificar las etapas del flujograma de trabajo en la central de esterilización, describir algunas consideraciones en las distintas etapas y servir para unificar criterios y evitar procedimientos inadecuados, en especial entre los encargados de las tareas de esterilización.
La Central de Esterilización debe estar ubicada en un lugar de fácil acceso, especialmente desde el quirófano. Cuando exista comunicación directa con el quirófano se establecerán dos circuitos, uno para el material sucio, comunicado con el área de lavado, y otro limpio para el material estéril, comunicado con el almacén estéril.
Para que el trabajo del servicio sea eficiente, se deben delimitar las zonas en las que se desarrollan sus actividades, de manera que en ningún momento pueda existir confusión entre material limpio y sucio.
Es importante definir las siguientes zonas:
La Central de Esterilización tiene la función de proporcionar a los servicios y unidades el material en condiciones idóneas de esterilidad a su debido tiempo, así como su correcta protección para la realización de diversos procedimientos (3). Para conseguir esto, están determinadas las etapas del flujograma de trabajo en la Central de Esterilización.
Es la reducción de la cantidad de microorganismos, con el fin de disminuir el riesgo de infección y la carga bacteriana de los efluentes. Es necesario que el material sea sometido a este procedimiento en el lugar en que se utilizó, para evitar que se adhieran restos de materia orgánica (pus, sangre, tejidos) y sustancias medicamentosas en las superficies.
Para esto se utiliza agua con detergente, que debe cubrir todo el material durante media a una hora; es preferible usar detergente enzimático, si se cuenta con el mismo. Este material es recibido en la central de esterilización limpio, separado y protegido individualmente. Todos los elementos utilizados con pacientes deben ser considerados contaminados, lo que depende del uso que se le dio (maniobras críticas, semicríticas y no críticas (2, 5, 6, 12).
Es la eliminación de todos los microorganismos vegetativos, no así las esporas bacterianas, en un objeto inanimado o en tejido vivo (2). En este proceso se distinguen distintos niveles (4).
El nivel de desinfección alto, que se realiza en condiciones estrictamente controladas, elimina los virus, hongos y formas vegetativas bacterianas, incluyendo las micobacterias (tuberculicida). Solamente admite la presencia de algunas esporas bacterianas, convencionalmente consideradas no patógenas.
El nivel intermedio inhibe y, en condiciones muy controladas, destruye las bacterias tuberculínicas y elimina a la mayoría de los hongos, fundamentalmente a los lipofílicos de mediano tamaño, pero no necesariamente a las esporas bacterianas.
En el nivel bajo, se pueden inhibir o destruir la mayoría de las bacterias en estado vegetativo y algunos hongos y virus. Este procedimiento es poco confiable si se desconoce la biocarga, o si el riesgo es de consideración.
Para seleccionar el desinfectante adecuado para cada situación en particular, es fundamental respetar el tiempo de actuación recomendado, que varía según los tipos de microorganismos a eliminar, el número preexistente de éstos y el nivel de desinfección que se pretenda, según lo señalado en la lista anterior.
Es fundamental usar los medios de protección cuando se tenga contacto con los desinfectantes
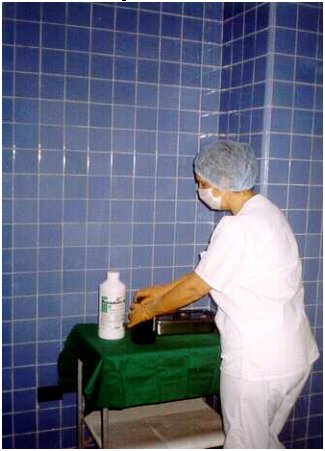
Figura 1. Preparación de soluciones desinfectantes.
Un aspecto importante es la categoría de los instrumentos según su contaminación (4).
En el año 1961, Spaulding estableció tres categorías, basadas en el riesgo de contaminación de los elementos y equipos usados con los pacientes, al igual que los niveles de desinfección. Es importante tener en cuenta estas categorías a la hora de seleccionar el desinfectante.
Las categorías son:
Es la eliminación del material extraño (tierras, detritus orgánicos, etc.) de la superficie inerte o viva, mediante un efecto de barrido que elimina también a los agentes biológicos superficiales. Los elementos básicos del proceso son el agua, el jabón o detergente y el secado posterior. También son determinantes la temperatura algo elevada, la calidad del limpiador químico, que incluye desincrustantes, el pH del medio y la técnica del lavado.
Los objetivos de la limpieza son reducir la contaminación microbiana, remover restos de tejidos, sangre u otra materia orgánica, evitar el deterioro acumulativo y evitar la presencia de gérmenes gramnegativos y pirógenos.
Existen tres tipos de limpieza. El primero de ellos es la limpieza manual, que se realiza con guantes resistentes destinados a ese fin, ropa adecuada, delantal plástico y protección ocular y nasal, además de calzado impermeabilizado. Se utilizan cepillos de cerdas blandas para el instrumental que presente estrías, y paños para tales efectos. Los detergentes biodegradables facilitan la limpieza; actualmente se reconoce que la limpieza interna y externa de los instrumentos con detergente enzimático es un paso importante, ya que las enzimas actúan sobre los iones internos de las proteínas, rompiendo las macromoléculas en trozos pequeños, que son fácilmente arrastradas. Los cepillos de limpieza, una vez usados, deben ser lavados, desinfectados y secados.
La limpieza mecánica se realiza en máquinas destinadas a ese fin, para el lavado y desinfección de material quirúrgico. El proceso puede hacerse en bachas separadas o como un proceso continuo, a través de un túnel, sobre una cinta transportadora. Un ciclo clásico incluye los siguientes pasos: enjuague con agua fría, lavado con agua caliente (2 minutos), enjuague caliente (10 minutos) y secado. Se debe realizar una limpieza diaria y desinfectar sin retener agua, para evitar la contaminación con bacterias gramnegativas.
La limpieza ultrasónica se hace con lavadoras ultrasónicas, que aplican ondas sonoras de alta frecuencia, entre 20 y 35 KHZ o vibraciones por segundo, en soluciones acuosas con detergentes. Estas ondas de alta frecuencia no son percibidas por el oído humano, ya que están sobre el limite superior de la frecuencia audible.
Esta limpieza no sirve para remover manchas resistentes, por lo tanto es un suplemento de la limpieza manual y mecánica. La frecuencia utilizada no produce la muerte microbiana, y puede provocar aerosoles contaminantes, a menos que se tape el tanque durante el proceso. No puede ser usada en instrumental óptico, goma, PVC, madera, ni se pueden poner diferentes metales juntos en el tanque, ni metales y plásticos en la misma carga.
Para que la limpieza ultrasónica sea eficaz, se deben tener en cuenta algunos puntos, como airear la cuba ultrasónica antes del ingreso del instrumental, de manera de eliminar todos los gases, elevar el nivel del instrumental sobre el piso del tanque, recordar que el instrumental debe ser colocado abierto, evitar que los instrumentos de gran tamaño produzcan zona de sombra sobre los más pequeños y mantener la temperatura del agua a no más de 55ºC, porque con mayor temperatura se forma vapor en vez de burbujas.
El material debe enjuagarse con abundante agua, para arrastrar todo tipo de residuos que pudieran ser tóxicos para los pacientes. Es necesario preocuparse de la calidad del agua; para evitar todo tipo de manchas en los elementos, el agua debe ser totalmente desmineralizada. Esto se logra con equipos ablandadores de agua o con equipos más sofisticados de intercambio iónico, que entregan agua equivalente a la biodestilada.
Se realiza para evitar la corrosión y las manchas en el instrumental metálico. Se hace por medio de aire caliente forzado.
La corrosión en el instrumental puede tener varias causas: lavado manual o automático insuficiente, restos de productos de limpieza o desinfectantes, composición del agua, no respetar las dosis del producto de limpieza, mala calidad del instrumental y del vapor, errores en la organización, restos de medicamentos y el hecho de mezclar instrumental viejo y nuevo durante la descontaminación.
Durante el secado, los materiales deben quedar sin restos de humedad, ya que en el caso del óxido de etileno, la unión del agua con el gas produce una reacción química resultante en etilenglicol; en el caso del plasma, se produce gas de peróxido de hidrógeno.
Si quedan restos de humedad, el equipo puede cancelar el ciclo, para evitar la corrosión de los materiales (2, 3, 9, 11, 13, 14, 15, 16).
Antes del empaquetamiento, se debe inspeccionar el material con una lupa para asegurarse de que no le queden restos de suciedad y de que está minuciosamente limpio. La elección de la envoltura depende del material que se va a empaquetar y del proceso de esterilización al que será sometido.
La envoltura debe poseer las siguientes propiedades:
Las envolturas más utilizadas son las siguientes:
Existe una gran variedad de controles físicos, químicos y biológicos. Los controles fisicos se utilizan para verificar las condiciones físicas del equipo; en la actualidad, la mayoría de los equipos disponen de gráficos que indican la temperatura, presión y duración del ciclo.
Los dispositivos utilizados para el control físico son:
Es importante efectuar una observación constante antes, durante y después del proceso de esterilización, para saber cómo progresa ésta. Los registros deben archivarse durante un tiempo prudente, por cualquier dificultad que se pueda presentar (2, 6).
Los controles químicos son indicadores fundibles colorimétricos, que usados en forma adecuada, indican las temperaturas alcanzadas y la duración del tiempo en que se mantiene el calor en el grado programado. Estos controles consisten en sustancias químicas impresas en cartulina o papel, que cambian de color al ser expuestas al calor. La intensidad del viraje depende del tiempo de exposición, permitiendo determinar si el proceso se ha efectuado de forma correcta y detectar fallas mecánicas. Estos controles pueden utilizar como método el vapor saturado, el calor seco, el óxido de etileno o las radiaciones.
Existe una variedad de tipos de controles químicos. Los más simples son las cintas o tiras con control de esterilización, que consisten en rectángulos que llevan impresos sellos indicadores en cada extremo y contienen información sobre la tonalidad que debe tener una vez finalizado el proceso. Se usan en el centro de cada paquete de prueba (set de cirugía, guantes, textil) y en lugares de difícil acceso del agente esterilizante, en las llamadas zonas frías.
También existen envases de papel con control de esterilización, que tienen en su cara exterior un sello de esterilización que cambia según el color recomendado por el fabricante.
Las cintas autoadhesivas o engomadas con control de esterilización sirven para sellar los paquetes; llevan impresas tintas que viran de color en presencia del calor y se usan específicamente como control externo y para distinguir a simple vista paquetes procesados y no procesados.
Otro tipo de control químico es la lámina de control test Bowie-Dick, que indica el grado de penetración del vapor dentro del bulto. Consiste en una hoja de papel que tiene impreso, con tinta sensible al vapor, círculos concéntricos o líneas a través de toda la superficie; se coloca en el centro de un paquete. La presencia de aire es detectada al no producirse un viraje de color en los círculos del indicador. El paquete de prueba debe realizarse con toallas o paños de dimensiones 30x30x30cm ó 43x24x25cm, realizándose a 134ºC durante 3,5 minutos, en horas tempranas. Los paños o toallas deben lavarse y airearse sin usar sustancias químicas; la hoja se introduce en medio de las dos capas.
Otro dispositivo para control químico es el termómetro de máxima, cuyo uso es muy limitado, ya que sólo indica la temperatura más elevada que se ha alcanzado, pero no su tiempo de duración. Permite pesquisar la falta de llegada hasta el centro del paquete, de la cantidad de calor programada. Consta de un tubo de vidrio que contiene mercurio, que sube en función de la temperatura y empuja un trozo de metal que está flotando en el líquido.
Finalmente, existen los controles integradores, que son más recientes y de un nivel más alto. Están diseñados para imitar aproximadamente la respuesta de los indicadores biológicos de todos los parámetros críticos del proceso de esterilización, integrando tiempo, temperatura y vapor saturado. Una cavidad abollonada de poil almacena una tableta compuesta de una sustancia termosensible que se funde en presencia de vapor y difunde a través de un medio poroso. La difusión es observable por medio de una ventana. Se sitúan en el interior del paquete de prueba.
Los controles biológicos son dispositivos inoculados con esporas de microorganismos especialmente resistentes a lo distintos agentes de esterilización. Los microorganismos utilizados son el Bacillus stearothemorphilus, para proceso de vapor y folmalhehído, el Bacillus subtillis, para calor seco y óxido de etileno, y el Bacillus pumillis, para rayos gamma.
Existen diversos tipos de controles biológicos, como las tiras de papel inoculadas y envueltas individualmente, permeables a los agentes esterilizantes, que deben ser cultivadas en un laboratorio de microbiología.
Otros dispositivos para control biológico son las ampollas con medio de cultivo incorporado, en las cuales, el disco inoculado con los microorganismos entra en contacto con el medio de cultivo una vez activado el dispositivo, mediante la ruptura del contenedor, que generalmente es una ampolla de cristal contenida en el interior de la ampolla principal de plástico de dicho medio de cultivo. El cultivo se realiza en pequeñas incubadoras de sobremesa y el resultado positivo o negativo se determina por la presencia o ausencia de cambio del color inicial del medio de cultivo incorporado.
Estos controles se colocan semanalmente en vapor a presión, óxido de etileno y formaldehído. El equipo se prepara en set de prueba conformado por textil, cirugía y de guantes para vapor y en dos jeringuillas plásticas que van colocadas inversamente; dentro de las mismas van situados los controles biológicos para óxido de etileno (2, 3, 7, 10, 15).
Para acomodar la carga, se deben seguir correctamente una serie de instrucciones:
Figura 2. Extracción del material estéril.
Los métodos de esterilización pueden ser físicos o químicos. Entre los primeros están el calor seco, que puede aplicarse con flameado o en horno seco, y el calor húmedo, que se puede aplicar mediante vapor de agua a presión o mediante ebullición.
Entre los métodos químicos están los que utilizan el frío, como las radiaciones gamma, los gases, como el óxido de etileno, y los líquidos, como los aldehídos y glutáricos.
El vapor a presión es el método más usado, por ser económico, rápido, eficaz y no tóxico. Se utiliza en la mayoría de los objetos que toleran temperaturas de 121 a 138ºC y su éxito depende del tiempo, la temperatura, la distribución homogénea del vapor y las variaciones de presión.
Otro método utilizado con frecuencia es el óxido de etileno, que es un proceso de esterilización a baja temperatura(30 a 60ºC), en el cual las temperaturas y los tiempos varían según el fabricante. Una ventaja es que permite esterilizar materiales que se deterioran con el calor, es decir, termolábiles. Se presenta como gas o líquido incoloro, puro o con mezcla (en general, freones).
Entre sus inconvenientes están su toxicidad, pues está considerado en el grupo de los productos probablemente cancerígenos en seres humanos, su alto costo, la necesidad de airear los materiales por tiempos prolongados antes de usarlos, el hecho de que requiere de personal adiestrado para su manejo y la necesidad de una instalación separada del resto, así como de medidores ambientales de residuos tóxicos del material. La concentración permitida es 1 ppm en una jornada de 8 horas (3).
Existen otros métodos recientes, como el Gas Plasma de peróxido de hidrógeno, que consiste en la difusión de peróxido de hidrógeno en fase plasma (estado entre líquido y gas), que ejerce la acción biocida. Es útil para la esterilización de material termolábil a una temperatura menor a 50ºC. El tiempo del proceso es de aproximadamente 90 minutos y no deja residuos tóxicos en los materiales biomédicos; además, el personal no requiere protección y el material no precisa aireación.
El vapor a baja temperatura con formaldehído también es un método reciente. La clave de la esterilización a baja temperatura radica en la mínima concentración de formaldehído que se utiliza (2%), combinado con el vapor, en un ambiente de vacío constante, en ciclos de 4 a 6 horas, dependiendo de si se trabaja a 60 ó a 50ºC. No necesita instalación especial ni ventilación y no requiere separación de otros equipos si existe renovación del aire por hora.
La mayoría de los fabricantes de endoscopios flexibles recomiendan la esterilización por formol. Es importante el estudio ambiental y de residuos del material, ya que este producto está en el grupo de productos probablemente cancerígenos en humanos, considerándose más tóxico que el óxido de etileno.
Algunos esterilizantes usados en la desinfección de alto nivel
El ácido peracético, también llamado ácido peroxiacético, es un agente oxidante que en la actualidad sólo puede ser utilizado en la esterilización. Necesita un tiempo de 20 minutos a 50ºC, con una dilución de 0,2%. Su costo es elevado, puesto que no se reutiliza. La solución concentrada es tóxica para la piel y los ojos, por lo que se necesitan elementos de barrera. Sólo puede ser usado en máquinas automáticas.
También existe la combinación de ácido peracético 0,08% y peróxido de hidrógeno 1%, que tiene la capacidad de inactivar todas las formas microbianas, salvo las esporas bacterianas, en 25 minutos a una temperatura de 20ºC. Puede ser usado de forma manual o automática. Es tóxica para los ojos, por lo que exige el uso de gafas por parte del operador.
El ortoftaldehído (opa) es un nuevo producto, cuyos estudios han demostrado que tiene una excelente actividad antimicrobiana, mayor que la del glutaraldehído. No es irritante para los ojos ni para la nariz. La concentración recomendada es de 0,55% y el tiempo de exposición es de 10 minutos a 20ºC, para alcanzar una desinfección de alto nivel. Puede ser usada de forma manual y automática.
Para elegir uno de estos productos, ya sea como esterilizantes o como desinfectantes de alto nivel, se deben considerar las siguientes características:
Además de estas características, se deben respetar las recomendaciones dadas por el fabricante y la fecha de preparación y de vencimiento (5, 9, 13).
En este trabajo se identificaron las etapas del flujograma de trabajo en la central de esterilización y se analizaron algunas consideraciones en los procedimientos.
La capacitación continua y la protocolización de todas las normas y procedimientos a ejecutar en este departamento constituyen herramientas fundamentales para lograr un resultado de alta eficiencia, calidad y productividad.
A lo anterior se une el interés y el amor que cada persona entregue a la hora de asumir la gran responsabilidad de efectuar estas tareas, recordando que están destinadas a preservar la salud de las personas, por lo que deben ser de máxima calidad.



 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La esterilización es el conjunto de operaciones destinadas a eliminar cualquier forma de vida en un material sanitario. Es una de las tareas en que se apoya la seguridad de los pacientes, ya que para su atención se necesitan elementos estériles. El presente artículo tiene como objetivos identificar las etapas del flujograma de trabajo en la central de esterilización, describir algunas consideraciones importantes en cada una de las etapas y servir como herramienta para unificar criterios entre las personas que tienen esta gran responsabilidad en su quehacer diario. Es fundamental que las personas encargadas de estas tareas conozcan todo lo relacionado con este proceso, para que así puedan dirigir sus esfuerzos a garantizar que el producto termine y se mantenga con la condición de esterilidad.
 Autores:
Martha Rodríguez G.[1], Maylen Pérez G.[1], Miriam Valdés F.[1]
Autores:
Martha Rodríguez G.[1], Maylen Pérez G.[1], Miriam Valdés F.[1]

Citación: Rodríguez M, Pérez M, Valdés M. General considerations on work flowchart in the sterilization unit. Medwave 2004 May;4(4):e2678 doi: 10.5867/medwave.2004.04.2678
Fecha de publicación: 1/5/2004
Citaciones asociadas
1. Barragán N, Chafla S. Evaluación del cumplimiento de las normas de asepsia y antisepsia y su relación con las infecciones post-cesárea, en el servicio de Gineco-Obstetricia, en el Hospital José María Velasco Ibarra, de Febrero-Abril del 2011 [Tesis Magister enfermería quirúrgica]. Ambato-Ecuador: Universidad Regional Autónoma De Los Andes, 2012 | Link |

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Cristopher CM. Esterilización. Su evolución hasta la actualidad. Revista interna Nueva medica. Ene 1998; (4): 1-4.
Cristopher CM. Esterilización. Su evolución hasta la actualidad. Revista interna Nueva medica. Ene 1998; (4): 1-4.  Clara L, Fornas C, Lizzi A, Almanda G. Curso de esterilización práctico. Comité de Control de Infecciones Hospitalarias. Buenos Aires: Hospital Italiano; 1993:2-18.
Clara L, Fornas C, Lizzi A, Almanda G. Curso de esterilización práctico. Comité de Control de Infecciones Hospitalarias. Buenos Aires: Hospital Italiano; 1993:2-18.  Guía para la prevención y control de la infección nosocomial. Hospital Universitario de la Princesa. (3): 89-93.
Guía para la prevención y control de la infección nosocomial. Hospital Universitario de la Princesa. (3): 89-93.  Manual técnico para la preparación de soluciones antisépticas y desinfectantes. Cuba: Minsap, 2000: 6-20.
Manual técnico para la preparación de soluciones antisépticas y desinfectantes. Cuba: Minsap, 2000: 6-20.  Almada G, Lizzi A. Nuevas alternativas para la desinfección y esterilización de los endoscopios. Revista de enfermería Hospital Italiano, 2000 Abr; 9(3): 27-29.
Almada G, Lizzi A. Nuevas alternativas para la desinfección y esterilización de los endoscopios. Revista de enfermería Hospital Italiano, 2000 Abr; 9(3): 27-29.  Manual de normas y procedimientos. Cuba: Minsap, 1998.
Manual de normas y procedimientos. Cuba: Minsap, 1998.  Poder popular. Indicadores para el control de los equipos de esterilización. La Habana, Cuba: Centro provincial de higiene y epidemiología.
Poder popular. Indicadores para el control de los equipos de esterilización. La Habana, Cuba: Centro provincial de higiene y epidemiología.  Política de uso de los agentes esterilizantes, desinfectantes y antisépticos. Cuba: Minsap, 1995:16-19.
Política de uso de los agentes esterilizantes, desinfectantes y antisépticos. Cuba: Minsap, 1995:16-19.  Maimores S. Selección y uso de desinfectantes. Visión 1997, Sep; 2(56).
Maimores S. Selección y uso de desinfectantes. Visión 1997, Sep; 2(56).  Peregrin GF. Definiciones y Concepto. Control de procesos hospitalarios de Esterilización. Madrid, España, 1986:5-12.
Peregrin GF. Definiciones y Concepto. Control de procesos hospitalarios de Esterilización. Madrid, España, 1986:5-12.  Labarca J. El óxido de etileno como agente esterilizante .Visión general de la esterilización con óxido de etileno. Chile: Seminario 1990-1991:31-33.
Labarca J. El óxido de etileno como agente esterilizante .Visión general de la esterilización con óxido de etileno. Chile: Seminario 1990-1991:31-33.  Bartellini M, Cano R. Descontaminantes físicos, Manual de Bioseguridad. Departamento técnico C.a.d.i.m.e, 1997:2-9.
Bartellini M, Cano R. Descontaminantes físicos, Manual de Bioseguridad. Departamento técnico C.a.d.i.m.e, 1997:2-9.  Clara L, Fronas C, Lizzi A, Almada G , Dilonato M. Nuevas tecnologías para la esterilización de materiales termolábiles. IV Curso práctico de esterilización y desinfección hospitalaria. Buenos Aires: Hospital Italiano, 1993: 3-5.
Clara L, Fronas C, Lizzi A, Almada G , Dilonato M. Nuevas tecnologías para la esterilización de materiales termolábiles. IV Curso práctico de esterilización y desinfección hospitalaria. Buenos Aires: Hospital Italiano, 1993: 3-5.  Rubilotti S. Limpieza de materiales. El secreto en Esterilización. Fudesa, Año 2, Nº6 p. 19-20.
Rubilotti S. Limpieza de materiales. El secreto en Esterilización. Fudesa, Año 2, Nº6 p. 19-20.  Insalud. Limpieza, descontaminación y selección del material. Manual de gestión de los procesos de esterilización. Madrid, España, 1997:43.
Insalud. Limpieza, descontaminación y selección del material. Manual de gestión de los procesos de esterilización. Madrid, España, 1997:43.  PIDOUXH. Factores físicos químicos que influyen en el instrumental de acero inoxidable. Esterilización para el Mercosur. Buenos Aires:6-8.
PIDOUXH. Factores físicos químicos que influyen en el instrumental de acero inoxidable. Esterilización para el Mercosur. Buenos Aires:6-8.