 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Los trastornos electrocardiográficos secundarios a ictus isquémicos son conocidos, aunque menos manifiestos que en los ictus hemorrágicos. Se realizó un estudio descriptivo prospectivo de 74 pacientes hospitalizados en la unidad de enfermedad cerebrovascular del Hospital “Miguel Enríquez” con el diagnóstico de ictus isquémico de diferente topografía y de diferentes factores etiológicos. De ellos, 37 pacientes presentaron alteraciones cardíacas (50%). El eje carotídeo fue el más afectado (67, 6%) y hubo predominio del sexo masculino (56,8%). 100% de los pacientes con enfermedad cardíaca previa desarrollaron complicaciones posteriores. Los pacientes con ictus de etiología aterotrombótica presentaron más cambios electrocardiográficos que los pacientes afectados por otras etiologías. Las alteraciones del ritmo predominaron sobre las alteraciones morfológicas del electrocardiograma, siendo la más frecuente la taquicardia sinusal (35,13 %) seguida de los extrasístoles ventriculares (13,5%) y extrasístoles auriculares (6,8% de los pacientes). Los cuidados de enfermería son esenciales para prevenir las complicaciones cardiovasculares en las primeras 72 horas de instaurado un ictus cerebrovascular.
Palabras clave: Enfermedad cerebrovascular, trastornos electrocardiográficos.
Hace más de cinco siglos el padre de la medicina, Hipócrates, reconoció y describió el accidente cerebrovascular como “el inicio repentino de parálisis” (1). Hasta hace poco se podía hacer muy poco frente a esta condición, pero esto está cambiando y gracias a las nuevas terapias algunas de las personas que sufren un accidente cerebrovascular pueden salir del mismo con escasa o nula incapacidad. En tiempos antiguos el accidente cerebrovascular se conocía como apoplejía, un término general que los médicos aplicaban a cualquier persona afectada repentinamente por parálisis, sin indicar diagnóstico o causa específica (2). La primera persona en investigar los signos patológicos de la apoplejía fue Johann Jacob Wepfer, nacido en Schaffhausen, Suiza en 1620; él identificó los signos post-mortem de la hemorragia en el cerebro de los pacientes fallecidos de apoplejía; de los estudios de autopsias obtuvo conocimiento sobre las arterias carótidas y vertebrales que suministran sangre al cerebro y fue la primera persona en sugerir que la apoplejía podría ser causada no sólo por una hemorragia, sino también por un bloqueo de una de las arterias cerebrales principales, de lo cual devino el concepto de enfermedad cerebrovascular (1-3). En las dos últimas décadas los investigadores básicos y clínicos, muchos de ellos patrocinados y financiados en parte por el Instituto Nacional de Trastornos Neurológicos y Accidentes Vasculares (National Institute of Neurological Disorders and Stroke, NINDS), identificaron los principales factores de riesgo de esta condición médica, entre ellos la hipertensión, la enfermedad cardíaca, la diabetes y el consumo de cigarrillos; y formularon medidas farmacológicas y quirúrgicas, así como técnicas de rehabilitación para la prevención tratamiento y recuperación de estos pacientes. El acontecimiento nuevo más interesante en el campo de la investigación del accidente cerebrovascular es el desarrollo de un tratamiento farmacológico que puede invertir el curso del evento si se administra en las primeras horas después de aparecer los síntomas (3). Estudios en animales han demostrado que la lesión cerebral ocurre dentro de unos minutos después de ocurrir un accidente cerebrovascular y se puede hacer irreversible en tan sólo una hora. En los seres humanos el daño cerebral comienza en el momento en que ocurre el accidente cerebrovascular y a menudo continúa avanzando después de varios días, pero existe una “ventana de oportunidad”, aunque reducida, durante la cual se puede evitar el daño y lograr que el paciente sobreviva y se recupere (4).
Desde tiempos remotos se ha reconocido la participación del corazón en la producción de enfermedades neurológicas, pero sólo a principios del siglo XX se describió la aparición de cambios electrocardiográficos en la fase aguda en pacientes con hemorragia subaracnoidea y trauma cerebral (1-4). En 1930, Beatlle provocó extrasístoles por estimulación del hipotálamo posterior en gatos anestesiados (2); en 1938, Aschenbreuner y Boddchtel reportaron lesiones neurológicas asociadas a hallazgos de anormalidades electrocardiográficas en pacientes jóvenes sin enfermedad cardiovascular previa (3); en 1947 Byer y Ashman describieron, en pacientes aquejados de hemorragia subaracnoidea, anormalidades electrocardiográficas consistentes en supradesnivel del ST, prolongación del QT, presencia de onda U y onda T patológica (4); en 1954 Burch describió por primera vez alteraciones electrocardiográficas secundarias a infarto cerebral, hemorragia subaracnoidea y hematoma intraparenquimatoso (5). En 1959-1960 Weinberg y Fuentes provocaron distorsión de la onda T y varios tipos de arritmias por la estimulación del hipotálamo lateral (6, 7). Oppenheimer realizó investigaciones estimulando la corteza insular izquierda de la rata; la persistencia del estímulo produjo bloqueo AV, prolongación del intervalo Q-T y depresión del segmento ST, lo que demostró que la corteza insular de la rata tiene un centro de control de la función cronotrópica cardíaca (8-10). En la actualidad se continúan realizando estudios experimentales para evidenciar con mayor grado de precisión las áreas cerebrales que repercuten sobre los patrones cardiovasculares.
En suma, en la actualidad se sabe que las alteraciones electrocardiográficas son una expresión de complicaciones cardiovasculares y que constituyen un factor de mal pronóstico en la evolución de los accidentes vasculares encefálicos, tanto isquémicos como hemorrágicos, especialmente cuando son secundarias a los mismos. Por ello es importante determinar la frecuencia con que se presentan alteraciones electrocardiográficas secundarias a ictus como expresión de complicaciones cardiovasculares, en la práctica médica y de enfermería diaria.
Los objetivos de esta investigación son:
Se realizó un estudio descriptivo prospectivo en el que se incluyó a todos los pacientes que ingresaron con diagnóstico de enfermedad cerebrovascular isquémica aguda a la Unidad de Enfermedad Cerebrovascular del Hospital Miguel Enríquez de la Ciudad de la Habana, durante el período de noviembre de 2006 a febrero de 2007. En total fueron 74 pacientes. Se excluyó a los pacientes con enfermedad cerebrovascular de etiología no isquémica. Se revisaron las historias clínicas para recoger las variables de caracterización individual como edad y sexo, así como los datos clínicos y antecedentes patológicos personales. Las variables estudiadas, tanto cualitativas como cuantitativas, se describieron a través de porcentajes de las categorías definidas previamente, como se resume a continuación.
Definición y operacionalización de variables:
Los análisis estadísticos incluyeron cálculos de porcentajes, medidas de tendencia central (media) y medidas de dispersión (rango).
A cada paciente se le realizó examen físico general, neurológico y neurovascular al ingresar a la unidad, por un equipo médico conformado por residentes de neurología, especialistas de neurología, médicos intensivistas y enfermeros intensivistas. Para distinguir certeramente el ictus isquémico del hemorrágico, así como de otras entidades neurológicas como causas tumorales, se realizó a todos los pacientes una tomografía axial computada (TAC) en las primeras 72 horas del ingreso al centro. Para precisar las alteraciones electrocardiográficas previas al ingreso y para obtener el dato de la enfermedad cardíaca se revisaron los registros electrocardiográficos (ECG) previos al ingreso; para ello se solicitó a todos los pacientes que trajeran a la unidad un electrocardiograma previo y a los que no lo tenían se les realizó uno en cuerpo de guardia. Para valorar las complicaciones durante la fase aguda de la enfermedad isquémica se tomó como base la observación de los registros ECG diarios efectuados en las primeras 72 horas mediante un electrocardiógrafo estándar. Para el análisis de estos trazados se realizaron ECG convencionales de 12 derivaciones, considerando los siguientes parámetros establecidos como norma:
Los datos recogidos de las historias clínicas se registraron en una base de datos en el sistema excel de Windows XP. El análisis de los resultados se plasmó en tablas de contingencia para su mejor comprensión. El informe de la investigación se efectuó en soporte electrónico y su informe final se presentó en soporte papel.
En esta serie de 74 pacientes con ictus isquémico monitorizado, siguiendo los parámetros establecidos para el estudio, 37 de ellos presentaron alteraciones electrocardiográficas posteriores (50%). Este porcentaje fue mayor que el esperado de acuerdo con las investigaciones consultadas previamente. Oppenheimer, en sus investigaciones en el año 1995 reportó que entre 5 y 20% de los pacientes con ictus isquémicos se complicaban (8, 9), lo que probablemente se debe a que en el presente estudio se monitorizó todos los pacientes con ictus isquémicos, independientemente de la gravedad del cuadro.
En la Tabla I se muestra la distribución por edad de los pacientes referidos en este estudio, así como el total de pacientes complicados por cada grupo de edad. El promedio de edad fue 65 años. La mayor cantidad de casos con ictus isquémico se concentró en el grupo de 61 a 70 años, con un total de 23 casos (31,08%) y en el grupo de 71 a 80 años, con un total de 22 casos (29,72%). Sin embargo, el mayor porcentaje de pacientes con alteraciones cardiovasculares se reportó en las edades de 81 años o más, donde 54,14% de los pacientes con ictus isquémico presentaron estas alteraciones; en segundo lugar, 56,5% de pacientes afectados en edades comprendidas entre 61 y 70 años fueron propensos a complicarse y 50% de los pacientes entre 51 y 60 años también presentaron alteraciones secundarias al ictus isquémico.
*Porciento del total de pacientes con Ictus por grupo de edad. **Pacientes con alteraciones electrocardiográficas. ***Pacientes con Ictus Isquémico.
En la Tabla II se muestra el comportamiento de este evento según sexo: 42 pacientes con enfermedad cerebrovascular isquémica eran de sexo masculino (56,8%) y sólo 32, de sexo femenino. Además hubo un predominio de las complicaciones definidas, pero se estima que en pacientes ancianos la coexistencia de enfermedad cerebrovascular y cardiovascular de tipo ateromatosa es mayor. Esta aseveración fue planteada por autores como Komrad y Guillum en el año 1984 (20-21).
*Porciento del total de pacientes con Ictus según sexo. **Pacientes con alteraciones electrocardiográficas. ***Pacientes con Ictus Isquémico.
En la Tabla III se muestra el comportamiento de la enfermedad cerebrovascular aguda en cuanto a topografía de la lesión y etiología del proceso en los 74 pacientes estudiados.
*Porciento del total de pacientes con Ictus por cada grupo patológico. **Pacientes con alteraciones electrocardiográficas.***Pacientes con Ictus Isquémico.
De ellos, 50 presentaron ictus de territorio carotídeo (67,6%) y el resto del territorio vertebrobasilar, siendo el mecanismo fisiopatológico menos frecuente el hemodinámico, con sólo 2 casos (2,8% del total). Estos datos representan elementos descriptivos de la muestra estudiada que serán analizados más adelante en relación con la presencia de alteraciones electrocardiográficas (Tabla IV).
Lo más llamativo es que 100% de pacientes con afecciones cardíacas previas presentaron complicaciones luego del evento isquémico cerebral, así como 50% de los pacientes con antecedentes de otros infartos cerebrales previos. 33,3% de los pacientes con alguna modalidad de enfermedad cerebrovascular previa, contemplando no sólo el infarto cerebral, sino también los episodios de ataques transitorios de isquemia, presentaron alteraciones electrocardiográficas. Estudios previos han demostrado que los factores de riesgo para la aparición de enfermedad cerebrovascular aguda varían con la edad: en pacientes jóvenes es muy frecuente encontrar migraña y prolapso de la válvula mitral como antecedentes importantes, mientras que en pacientes ancianos juegan un papel importante la hipertensión arterial, la diabetes mellitas y la hipercolesterolemia e hipertrigliceridemia. También en estos pacientes las enfermedades cardíacas como fibrilación auricular, hipertrofia ventricular izquierda y enfermedad coronaria son importantes (23). No obstante, la incidencia de estos factores en la aparición de complicaciones posteriores no ha sido profundizada en otros estudios. De estas complicaciones la que más se ha investigado es la fibrilación auricular como causa o consecuencia del proceso vascular cerebral. (24). Por otra parte hay un grupo de pacientes en los cuales no se detectan precozmente afecciones cardíacas o no se identifican en el examen físico corriente, sino que se diagnostican por sus complicaciones; de ellas la más temida es la enfermedad cerebrovascular aguda.
Autores como Joaquín Serena apelan a la necesidad de realizar ecocardiografía transesofágica o doppler transcraneal para hacer el diagnóstico de algunas de estas entidades, sobre todo el shunt de derecha a izquierda, que es conocido como causa de enfermedad cerebrovascular isquémica (25).
En la Tabla V se muestran las principales alteraciones previas y posteriores al ictus; en ella se resume los patrones electrocardiográficos encontrados en aquellos pacientes que presentaban antecedentes de enfermedad cardíaca previa, sea manifestaciones de isquemia coronaria crónica, arritmias o valvulopatías. Se muestra comparativamente otras alteraciones electrocardiográficas añadidas al cuadro inicial, lo que permitió definir la existencia de otros patrones como complicación del evento isquémico posterior.
La tabla VI presenta la cantidad de pacientes con alteraciones electrocardiográficas con antecedentes o no de la enfermedad cardíaca previa, en dependencia de la etiología del proceso isquémico, planteando varios aspectos. De un total de 74 pacientes, 49 no tenían antecedentes de enfermedad cardíaca previa y 25 sí la presentaban (66,2% y 33,8% respectivamente) Ahora bien, todos los pacientes que presentaban antecedentes de enfermedad cardíaca previa desarrollaron complicaciones luego del evento isquémico, mientras que 50% de los pacientes estudiados no presentaban antecedentes cardiovasculares y no sufrieron variaciones electrocardiográficas, siendo la mayoría de los mismos. De los pacientes que presentaron variaciones electrocardiográficas registradas (un total de 37), 25 tenían antecedentes variables de enfermedad cardíaca antes del ictus, para un 67,6%.
Pacientes con antecedentes de enfermedades cardíacas que presentaron alteraciones electrocardiográficas posteriores*. Pacientes sin antecedentes de enfermedades cardíacas que presentaron alteraciones electrocardiográficas**. Pacientes con antecedentes de enfermedades cardíacas que no presentaron alteraciones electrocardiográficas ***. Pacientes sin antecedentes de enfermedades cardíacas que no presentaron alteraciones electrocardiográficas ****.
Con respecto al análisis de cada grupo etiológico, destaca el hecho de que en un alto porcentaje (53,8%) de los pacientes con ictus cardioembólicos que desarrollaron alteraciones electrocardiográficas posteriores se constató antecedentes previos de enfermedad cardíaca. En estos pacientes juega un papel primordial la coexistencia de fenómenos como fribilación auricular crónica, que se constató como causa y no como consecuencia, y valvulopatías previamente diagnosticadas. Sin embargo, 38,5% de los pacientes con ictus cardioembólicos no tenían previamente diagnosticada una enfermedad cardiovascular, lo que posteriormente se verificó por examen físico y otros medios complementarios, y sí presentaron alteraciones ECG después del ictus. En cuanto a los ictus de etiología aterotrombótica, 31,1% de ellos tenían antecedentes de enfermedad cardíaca previa y presentaron complicaciones posteriores, mientras que sólo 11,1% de dichos pacientes no tenían antecedentes de enfermedad cardíaca, pero tuvieron alteraciones electrocardiográficas. Es necesario señalar que la mayor cantidad de los pacientes estudiados no tenían antecedentes de enfermedad cardíaca y no presentaron complicaciones posteriores al evento isquémico aterotrombótico (57,8%), y que el ictus de etiología lacunar tuvo una incidencia muy baja en la aparición de complicaciones, ya que de un total de 14 pacientes solamente 5 presentaron alteraciones electrocardiográficas (35,3%) y de ellos 3 tenían antecedentes de enfermedad cardíaca.
Como se ha podido comprobar en otras series, alrededor de 90% de pacientes con accidentes cerebrales agudos presentan anormalidades electrocardiográficas consistentes en disturbios del ritmo cardíaco, que incluyen bradicardia sinusal, taquicardia sinusal, arritmias auriculares, ritmo de la unión y arritmias ventriculares, así como anormalidades de la repolarización consistentes en alteraciones del segmento ST y de la onda T y aparición de la onda U (26, 27).
La fibrilación auricular (FA) como causa o consecuencia de un proceso cerebrovascular agudo fue motivo de investigación del Departamento de Neurología de la Universidad de Lausana, Suiza, en 1998, donde se definió que es muy importante el tiempo en que aparecen las manifestaciones electrocardiográficas: cuando es la causa aparece desde inicio del monitoreo y en el examen físico se pesquisan variaciones de intensidad del primer ruido cardíaco, ausencia de ondas en el pulso yugular venoso y si hay respuesta ventricular rápida hay un pulso significativamente deficiente; mientras que cuando la FA es consecuencia de estos eventos se presenta luego de un lapso variable, desde pocas horas hasta 72 horas, con ausencia de síntomas y signos clínicos y electrocardiográficos (24). La menor predisposición a encontrar complicaciones cardiovasculares en pacientes con ictus lacunar se debe a la representación autonómica del corazón en la corteza cerebral, que hace que sea más frecuente que aparezcan complicaciones cuando se afectan áreas más específicas de la representación cronotrópica cardíaca, como ocurre en los infartos más extensos en que se afectan ramas más grandes, que en los infartos de territorios profundos como ocurre en los ictus lacunares (28).
La Tabla VII resume las manifestaciones electrocardiográficas en pacientes con antecedentes o no de la enfermedad cardíaca diagnosticada, en correspondencia con el territorio anatómico cerebral afectado por la isquemia cerebral. De un total de 50 pacientes con ictus de territorio carotídeo, 44% no presentaba antecedentes de enfermedad cardíaca ni complicaciones electrocardiográficas post ictus y 17 pacientes (34%) tuvieron antecedentes de enfermedad cardíaca y complicaciones ulteriores.
En los pasados 50 años se evidenció la asociación entre las relaciones anatómicas del encéfalo y la aparición de complicaciones cardiovasculares, particularmente cuando hay daño de la corteza insular humana. Estudios posteriores han confirmado que los infartos de hemisferios cerebrales producen alteraciones electrocardiográficas asociadas a cambios específicos patológicos miocárdicos llamados miocitolisis. Estos daños se basan en mecanismos de aferencias y eferencias simpáticas y parasimpáticas que parten de la corteza cerebral en su mayoría, cuyos estímulos producen las complicaciones ya mencionadas (28, 29). Lane, en 1996, describió la aparición de taquicardia supraventricular en pacientes con ictus isquémico de hemisferio cerebral derecho, corroborando así la relación entre estas dos estructuras (30). Hancock describió la presencia de complejos prematuros en pacientes con infartos de territorio carotídeo de mediano tamaño (31).
En cuanto a los ictus de territorio vertebrobasilar, que fueron un total de 24 (32,4%), su comportamiento fue similar: la mayor parte de los pacientes no tuvo complicaciones y no tenía antecedentes de enfermedad cardíaca (62,5%) y 33,3% de los pacientes tenía antecedentes y complicaciones posteriores. Arboix y Oppenheimer describieron un porcentaje mayor de complicaciones electrocardiográficas en infartos de territorio posterior, sobre todo de tallo cerebral (58 a 73%), lo que es atribuible a la presencia, en el tallo del núcleo del tracto solitario, de una importante estructura nuclear que recibe la aferencia de los nervios glosofaríngeo y vago, cuyo daño produce alteraciones electrocardiográficas severas que pueden conducir a la muerte. (32, 33). Los valores que se obtuvieron en este estudio fueron inferiores a los observados en estas series, lo que se atribuye a una distribución al azar.
La Tabla VIII pone de manifiesto las principales alteraciones morfológicas encontradas en pacientes con ictus isquémico. Estas alteraciones se manifestaron con más frecuencia en pacientes con ictus de territorio carotídeo, con una frecuencia de aparición de 15 complicaciones (62,5%), mientras que en el territorio VB solamente aparecieron 9 complicaciones (37,5%). Para ambos territorios fue más frecuente encontrarlas en los ictus de etiología aterotrombótica, con un total de 19 (79,2%). La alteración electrocardiográfica morfológica más frecuente fue la presencia de onda T plana o invertida, con 9 casos (37,5% del total de complicaciones morfológicas), seguida por el segmento ST plano y el supradesnivel del ST, con una frecuencia de aparición de 4 cada uno (16,7% respectivamente).
En la Tabla IX se muestran las alteraciones electrocardiográficas del ritmo en los pacientes estudiados, que se presentaron con mayor frecuencia que las alteraciones morfológicas, con un total de 46 (65,7% del total de complicaciones). La mayor cantidad de cambios en el ECG, al igual que las alteraciones morfológicas, ocurrieron en los ictus etiología aterotrombótica, con una frecuencia de aparición de 29 complicaciones (63%). De ellas, la mayor frecuencia se observó en los ictus del territorio carotídeo (75,9% del total de pacientes con ictus aterotrombótico). El trastorno del ritmo que apareció con más frecuencia fue la taquicardia sinusal, con un total de 26 veces (56,5% del total de trastornos del ritmo), seguida por los extrasístoles ventriculares con una frecuencia de aparición de 10 (21,7%). En tercer lugar se expresaron los extrasístoles auriculares, con una frecuencia de aparición de 5 (10,8%). En general los trastornos del ritmo prevalecieron sobre las alteraciones morfológicas.
Entre los reportes más consistentes de alteraciones electrocardiográficas secundarias a ictus están los estudios realizados por el doctor Patricio Mellado de la Universidad Católica de Chile, quien realizó un compendio de estos cambios en el cual señala que las principales alteraciones son el intervalo QT prolongado, el segmento ST plano, la onda T plana o invertida y la aparición de la onda U y menciona como las arritmias más frecuentes la taquicardia sinusal y las extrasístoles auriculares y ventriculares. Esto coincide plenamente con las manifestaciones encontradas en el presente estudio (34). La incidencia y tipo de patrón electrocardiográfico varía de un paciente a otro y depende en gran medida del estado cardiovascular previo. Otras arritmias como el flutter y las taquicardias ventriculares tipo torsades de pointes son causas frecuentes de muerte súbita o de pérdida de conciencia inicial. Ostábal describió las alteraciones encontradas en pacientes con hemorragia intraparenquimatosa pero mencionó como cambios más frecuentes, también para ictus isquémicos, las alteraciones del ritmo (35). En el más reciente estudio realizado por Kocan sobre las conexiones cerebro-corazón se expone también la aparición de trastornos del ritmo como principales alteraciones electrocardiográficas secundarias a ictus isquémicos (36).
Es necesario continuar las investigaciones en el campo de la neurocardiología y profundizar en este tema para reducir la mortalidad por enfermedad cerebrovascular, que hoy constituye en la tercera causa de muerte en Cuba.
La mitad de los pacientes estudiados con ictus isquémico tuvieron alteraciones electrocardiográficas secundarias al ictus. La totalidad de los pacientes que tenían antecedentes de enfermedad cardíaca previa desarrollaron alteraciones electrocardiográficas posteriores al ictus. La mayor cantidad de alteraciones se observó en pacientes entre 61 y 70 años y en el sexo masculino, en correspondencia con la cantidad de pacientes incluidos en el estudio. La mayor parte de los pacientes con alteraciones presentaron un ictus isquémico de etiología aterotrombótica y en segundo lugar cardioembólica, con antecedentes previos o no de enfermedad cardíaca. La mayoría de los pacientes con cambios electrocardiográficos presentaron un ictus de territorio carotídeo. Las principales alteraciones morfológicas del electrocardiograma fueron la onda T plana o invertida, el intervalo QT prolongado y el supradesnivel del ST. Las principales alteraciones del ritmo encontradas en los pacientes estudiados fueron la taquicardia sinusal, los extrasístoles ventriculares y los extrasístoles auriculares. Los cuidados de enfermería son esenciales para prevenir las complicaciones cardiovasculares en las primeras 72 horas de instaurado un ictus cerebrovascular.

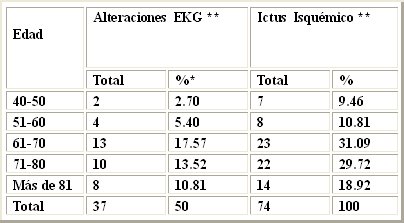 Tabla I. Distribución por edad de pacientes con ictus isquémico y alteraciones electrocardiográficas.
Tabla I. Distribución por edad de pacientes con ictus isquémico y alteraciones electrocardiográficas.

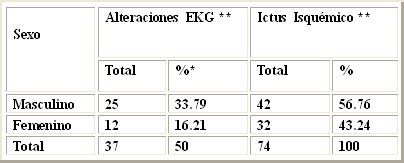 Tabla II. Distribución por sexo de pacientes con ictus isquémico y alteraciones electrocardiográficas.
Tabla II. Distribución por sexo de pacientes con ictus isquémico y alteraciones electrocardiográficas.

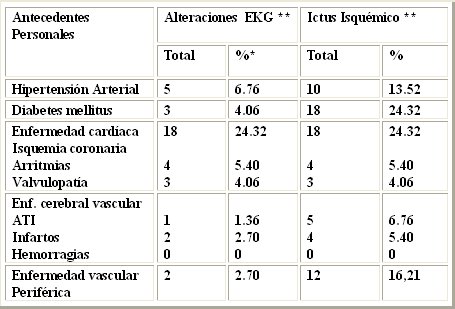 Tabla III. Principales antecedentes personales en pacientes con Ictus y alteraciones electrocardiográficas.
Tabla III. Principales antecedentes personales en pacientes con Ictus y alteraciones electrocardiográficas.

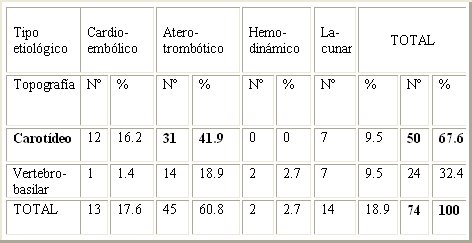 Tabla IV. Tipo etiológico de Ictus y territorio topográfico. Fuente: Historias Clínicas y Libro de datos estadísticos de la Unidad Cerebrovascular del Hospital “Miguel Enríquez”.
Tabla IV. Tipo etiológico de Ictus y territorio topográfico. Fuente: Historias Clínicas y Libro de datos estadísticos de la Unidad Cerebrovascular del Hospital “Miguel Enríquez”.

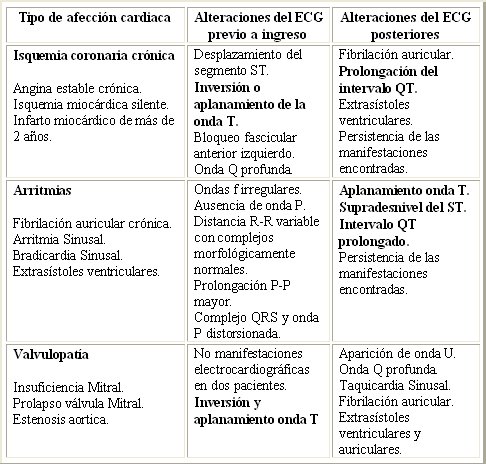 Tabla V. Alteraciones electrocardiográficas previas y posteriores al ingreso en pacientes con Ictus isquémicos. Fuente: Historias Clínicas y Libro de datos estadísticos de la Unidad Cerebrovascular del Hospital “Miguel Enríquez”.
Tabla V. Alteraciones electrocardiográficas previas y posteriores al ingreso en pacientes con Ictus isquémicos. Fuente: Historias Clínicas y Libro de datos estadísticos de la Unidad Cerebrovascular del Hospital “Miguel Enríquez”.

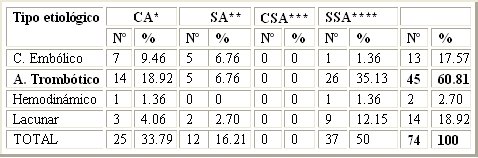 Tabla VI. Alteraciones electrocardiográficas y antecedentes de enfermedad cardiaca según tipo de Ictus. Fuente: Historias Clínicas y Libro de datos estadísticos de la Unidad Cerebrovascular del Hospital “Miguel Enríquez”.
Tabla VI. Alteraciones electrocardiográficas y antecedentes de enfermedad cardiaca según tipo de Ictus. Fuente: Historias Clínicas y Libro de datos estadísticos de la Unidad Cerebrovascular del Hospital “Miguel Enríquez”.

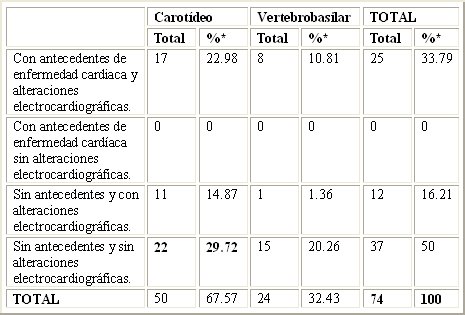 Tabla VII. Alteraciones electrocardiográficas y antecedentes de enfermedades cardiacas en pacientes según territorio anatómico. *Porciento sacado del total de pacientes de cada grupo topográfico.
Tabla VII. Alteraciones electrocardiográficas y antecedentes de enfermedades cardiacas en pacientes según territorio anatómico. *Porciento sacado del total de pacientes de cada grupo topográfico.

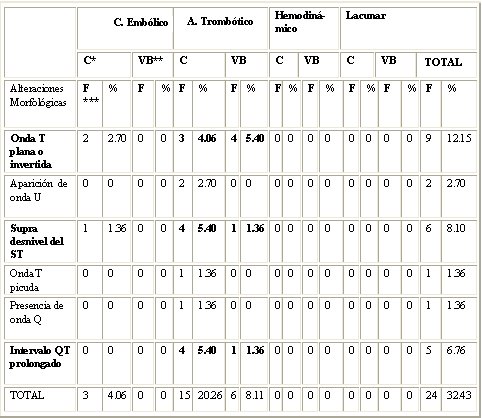 Tabla VIII. Alteraciones morfológicas según etiología del Ictus y territorio anatómico. *Carotídeo **Vertebro basilar ***Frecuencia de aparición.
Tabla VIII. Alteraciones morfológicas según etiología del Ictus y territorio anatómico. *Carotídeo **Vertebro basilar ***Frecuencia de aparición.

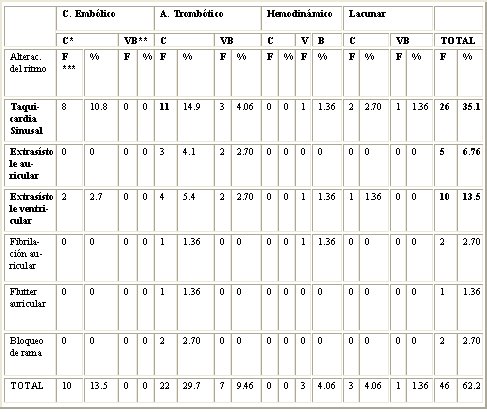 Tabla IX. Alteraciones morfológicas según tipo etiológico del Ictus y territorio anatómico. *Carotídeo **Vertebro basilar ***Frecuencia de aparición.
Tabla IX. Alteraciones morfológicas según tipo etiológico del Ictus y territorio anatómico. *Carotídeo **Vertebro basilar ***Frecuencia de aparición.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Los trastornos electrocardiográficos secundarios a ictus isquémicos son conocidos, aunque menos manifiestos que en los ictus hemorrágicos. Se realizó un estudio descriptivo prospectivo de 74 pacientes hospitalizados en la unidad de enfermedad cerebrovascular del Hospital “Miguel Enríquez” con el diagnóstico de ictus isquémico de diferente topografía y de diferentes factores etiológicos. De ellos, 37 pacientes presentaron alteraciones cardíacas (50%). El eje carotídeo fue el más afectado (67, 6%) y hubo predominio del sexo masculino (56,8%). 100% de los pacientes con enfermedad cardíaca previa desarrollaron complicaciones posteriores. Los pacientes con ictus de etiología aterotrombótica presentaron más cambios electrocardiográficos que los pacientes afectados por otras etiologías. Las alteraciones del ritmo predominaron sobre las alteraciones morfológicas del electrocardiograma, siendo la más frecuente la taquicardia sinusal (35,13 %) seguida de los extrasístoles ventriculares (13,5%) y extrasístoles auriculares (6,8% de los pacientes). Los cuidados de enfermería son esenciales para prevenir las complicaciones cardiovasculares en las primeras 72 horas de instaurado un ictus cerebrovascular.
Palabras clave: Enfermedad cerebrovascular, trastornos electrocardiográficos.
 Autora:
Luanda Miyares Paz[1]
Autora:
Luanda Miyares Paz[1]

Citación: Miyares L. EKG changes in the acute phase of stroke: nursing management. Medwave 2009 Nov;9(11):e4258 doi: 10.5867/medwave.2009.11.4258
Fecha de publicación: 1/11/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Bramnell, C. Head injuries can cause auricular fibrillation? The Journal of Nervous and Mental Disease: 1934; 80 (6):716.
Bramnell, C. Head injuries can cause auricular fibrillation? The Journal of Nervous and Mental Disease: 1934; 80 (6):716.  Beatlle J, Brow G R, Long C N. Physiological and anatomical evidence for existence of nerve tracts: Connecting the hypothalamus with spirial sympathetics centers. Proc–Roy, SOC. Series B. London: 1930; 2(1): 106-253.
Beatlle J, Brow G R, Long C N. Physiological and anatomical evidence for existence of nerve tracts: Connecting the hypothalamus with spirial sympathetics centers. Proc–Roy, SOC. Series B. London: 1930; 2(1): 106-253.  Aschenbrenner R, Bodechtel G. Ueber EKG Veranderungen veihirntumor Kranken klin. 1938; 7(4): 298.
Aschenbrenner R, Bodechtel G. Ueber EKG Veranderungen veihirntumor Kranken klin. 1938; 7(4): 298.  Byer E, Ashman R, Toth LA. Electrocardiograms with large, upright T waves and long Q-T intervals. Am Heart J. 1947 Jun;33(6):796-806. | PubMed |
Byer E, Ashman R, Toth LA. Electrocardiograms with large, upright T waves and long Q-T intervals. Am Heart J. 1947 Jun;33(6):796-806. | PubMed | Burch GE, Meyers R, Abildskov JA. A new electrocardiographic pattern observed in cerebrovascular accidents. Circulation. 1954 May;9(5):719-23. | PubMed |
Burch GE, Meyers R, Abildskov JA. A new electrocardiographic pattern observed in cerebrovascular accidents. Circulation. 1954 May;9(5):719-23. | PubMed | Weinberg SJ, Fuster JM. Hypothalamic control of heart function as manifested in an electrocardiographic study. Arch Int Physiol Biochim. 1959 Oct;67:699-704. | PubMed |
Weinberg SJ, Fuster JM. Hypothalamic control of heart function as manifested in an electrocardiographic study. Arch Int Physiol Biochim. 1959 Oct;67:699-704. | PubMed | Weinberg SJ, Fuster JM. Electrocardiographic changes produced by localized hypothalamic stimulations. Ann Intern Med. 1960 Aug;53:332-41. | PubMed |
Weinberg SJ, Fuster JM. Electrocardiographic changes produced by localized hypothalamic stimulations. Ann Intern Med. 1960 Aug;53:332-41. | PubMed | Oppenheimer SM, Hachinski VC. The cardiac consequences of stroke. Neurol Clin. 1992 Feb;10(1):167-76. | PubMed |
Oppenheimer SM, Hachinski VC. The cardiac consequences of stroke. Neurol Clin. 1992 Feb;10(1):167-76. | PubMed | Oppenheimer SM, Cechetto DF. Cardiac chronotropic organization of the rat insular cortex. Brain Res. 1990 Nov 12;533(1):66-72. | PubMed |
Oppenheimer SM, Cechetto DF. Cardiac chronotropic organization of the rat insular cortex. Brain Res. 1990 Nov 12;533(1):66-72. | PubMed | Oppenheimer SM, Wilson JX, Guiraudon C, Cechetto DF. Insular cortex stimulation produces lethal cardiac arrhythmias: a mechanism of sudden death? Brain Res. 1991 May 31;550(1):115-21. | PubMed |
Oppenheimer SM, Wilson JX, Guiraudon C, Cechetto DF. Insular cortex stimulation produces lethal cardiac arrhythmias: a mechanism of sudden death? Brain Res. 1991 May 31;550(1):115-21. | PubMed | Svigelj V, Grad A, Tekavcic I, Kiauta T. Cardiac arrhythmia associated with reversible damage to insula in a patients with subarachnoid hemorrhage. Stroke. 1994 May;25(5):1053-5. | PubMed |
Svigelj V, Grad A, Tekavcic I, Kiauta T. Cardiac arrhythmia associated with reversible damage to insula in a patients with subarachnoid hemorrhage. Stroke. 1994 May;25(5):1053-5. | PubMed | Welch KM, Levine SR. Migraine-related stroke in the context of the International Headache Society classification of head pain. Arch Neurol. 1990 Apr;47(4):458-62. | PubMed |
Welch KM, Levine SR. Migraine-related stroke in the context of the International Headache Society classification of head pain. Arch Neurol. 1990 Apr;47(4):458-62. | PubMed | Samuels M A. Neurocardiology in Stein: Internal Medicine. St. Louis: Mosby, 1994. 4 Ed 10(3): 1183-88.
Samuels M A. Neurocardiology in Stein: Internal Medicine. St. Louis: Mosby, 1994. 4 Ed 10(3): 1183-88.  Oppenheimer S, Norris J. Cardiac manifestations of acute neurological lesions. Livingstone. New York :Churchill, 1995; 4 (1): 183-200.
Oppenheimer S, Norris J. Cardiac manifestations of acute neurological lesions. Livingstone. New York :Churchill, 1995; 4 (1): 183-200.  Talman WT, Kelkar P. Neural control of the heart. Central and peripheral. Neurol Clin. 1993 May;11(2):239-56. | PubMed |
Talman WT, Kelkar P. Neural control of the heart. Central and peripheral. Neurol Clin. 1993 May;11(2):239-56. | PubMed | Koskelo P, Punsar S, Sipilae W. Subendocardial haemorrhage and E.C.G. changes in intracranial bleeding. Br Med J. 1964 Jun 6;1(5396):1479-80. | PubMed | PMC |
Koskelo P, Punsar S, Sipilae W. Subendocardial haemorrhage and E.C.G. changes in intracranial bleeding. Br Med J. 1964 Jun 6;1(5396):1479-80. | PubMed | PMC | Burch GE, Sun SC, Colcolough HL, DePasquale NP, Sohal RS. Acute myocardial lesions; following experimentally-induced intracranial hemorrhage in mice: a histological and histochemical study. Arch Pathol. 1967 Nov;84(5):517-21. | PubMed |
Burch GE, Sun SC, Colcolough HL, DePasquale NP, Sohal RS. Acute myocardial lesions; following experimentally-induced intracranial hemorrhage in mice: a histological and histochemical study. Arch Pathol. 1967 Nov;84(5):517-21. | PubMed | Tobias SL, Bookatz BJ, Diamond TH. Myocardial damage and electrocardiographic changes in acute cerebrovascular hemorrhage: a report of three cases and review. Heart Lung. 1987 Sep;16(5):521-6. | PubMed |
Tobias SL, Bookatz BJ, Diamond TH. Myocardial damage and electrocardiographic changes in acute cerebrovascular hemorrhage: a report of three cases and review. Heart Lung. 1987 Sep;16(5):521-6. | PubMed | Hernández Meilán, O. Alterations electrocardiographics secondary an ictus hemorrhagic [tesis doctoral]. Ciudad de La Habana. 1980.
Hernández Meilán, O. Alterations electrocardiographics secondary an ictus hemorrhagic [tesis doctoral]. Ciudad de La Habana. 1980.  Komrad MS, Coffey CE, Coffey KS, McKinnis R, Massey EW, Califf RM. Myocardial infarction and stroke. Neurology. 1984 Nov;34(11):1403-9. | PubMed |
Komrad MS, Coffey CE, Coffey KS, McKinnis R, Massey EW, Califf RM. Myocardial infarction and stroke. Neurology. 1984 Nov;34(11):1403-9. | PubMed | Gillum RF, Fortmann SP, Prineas RJ, Kottke TE. International diagnostic criteria for acute myocardial infarction and acute stroke. Am Heart J. 1984 Jul;108(1):150-8. | PubMed |
Gillum RF, Fortmann SP, Prineas RJ, Kottke TE. International diagnostic criteria for acute myocardial infarction and acute stroke. Am Heart J. 1984 Jul;108(1):150-8. | PubMed | Robert M, Herndon MD. Handbook of Neurologic Rating Scales. New York : Demos Medical Pub, 1997.
Robert M, Herndon MD. Handbook of Neurologic Rating Scales. New York : Demos Medical Pub, 1997.  Zeiler K, Siostrzonek P, Lang W, Gössinger H, Oder W, Ciciyasvilli H, et al. Different risk factor profiles in young and elderly stroke patients with special reference to cardiac disorders. J Clin Epidemiol. 1992 Dec;45(12):1383-9. | PubMed |
Zeiler K, Siostrzonek P, Lang W, Gössinger H, Oder W, Ciciyasvilli H, et al. Different risk factor profiles in young and elderly stroke patients with special reference to cardiac disorders. J Clin Epidemiol. 1992 Dec;45(12):1383-9. | PubMed | Vuilleumier P, Bogousslavsky J, Henriques I, Kappenberger L. Poststroke atrial fibrillation bursts with sinus rhythm at stroke onset: what was the cause of stroke? Cerebrovasc Dis. 1998 May-Jun;8(3):144-7. | PubMed |
Vuilleumier P, Bogousslavsky J, Henriques I, Kappenberger L. Poststroke atrial fibrillation bursts with sinus rhythm at stroke onset: what was the cause of stroke? Cerebrovasc Dis. 1998 May-Jun;8(3):144-7. | PubMed | Serena J, Segura T, Perez-Ayuso MJ, Bassaganyas J, Molins A, Dávalos A. The need to quantify right-to-left shunt in acute ischemic stroke: a case-control study. Stroke. 1998 Jul;29(7):1322-8. | PubMed |
Serena J, Segura T, Perez-Ayuso MJ, Bassaganyas J, Molins A, Dávalos A. The need to quantify right-to-left shunt in acute ischemic stroke: a case-control study. Stroke. 1998 Jul;29(7):1322-8. | PubMed | Lindgren A, Wohlfart B, Pahlm O, Johansson BB. Electrocardiographic changes in stroke patients without primary heart disease. Clin Physiol. 1994 Mar;14(2):223-31. | PubMed |
Lindgren A, Wohlfart B, Pahlm O, Johansson BB. Electrocardiographic changes in stroke patients without primary heart disease. Clin Physiol. 1994 Mar;14(2):223-31. | PubMed | Valeriano J, Elson J. Electrocardiographic changes in central nervous system disease. Neurol Clin. 1993 May;11(2):257-72. | PubMed |
Valeriano J, Elson J. Electrocardiographic changes in central nervous system disease. Neurol Clin. 1993 May;11(2):257-72. | PubMed | McLeod AA, Neil-Dwyer G, Meyer CH, Richardson PL, Cruickshank J, Bartlett J. Cardiac sequelae of acute head injury. Br Heart J. 1982 Mar;47(3):221-6. | PubMed | PMC |
McLeod AA, Neil-Dwyer G, Meyer CH, Richardson PL, Cruickshank J, Bartlett J. Cardiac sequelae of acute head injury. Br Heart J. 1982 Mar;47(3):221-6. | PubMed | PMC | Myers MG, Norris JW, Hachinski VC, Weingert ME, Sole MJ. Cardiac sequelae of acute stroke. Stroke. 1982 Nov-Dec;13(6):838-42. | PubMed |
Myers MG, Norris JW, Hachinski VC, Weingert ME, Sole MJ. Cardiac sequelae of acute stroke. Stroke. 1982 Nov-Dec;13(6):838-42. | PubMed | Lane RD, Wallace JD, Petrosky PP, Schwartz GE, Gradman AH. Supraventricular tachycardia in patients with right hemisphere strokes. Stroke. 1992 Mar;23(3):362-6. | PubMed |
Lane RD, Wallace JD, Petrosky PP, Schwartz GE, Gradman AH. Supraventricular tachycardia in patients with right hemisphere strokes. Stroke. 1992 Mar;23(3):362-6. | PubMed | Hancock EW. Premature beats after a mild stroke. Hosp Pract (Minneap). 1998 Jul 15;33(7):37-8. | PubMed |
Hancock EW. Premature beats after a mild stroke. Hosp Pract (Minneap). 1998 Jul 15;33(7):37-8. | PubMed | Arboix A, Alió J. Brain-heart interaction: a controlled prospective study of the electrocardiographic disorders in 100 consecutive patients with acute ischemic cerebrovascular pathology. Med Clin (Barc). 1991 Feb 9;96(5):165-8. | PubMed |
Arboix A, Alió J. Brain-heart interaction: a controlled prospective study of the electrocardiographic disorders in 100 consecutive patients with acute ischemic cerebrovascular pathology. Med Clin (Barc). 1991 Feb 9;96(5):165-8. | PubMed | Oppenheimer S. The insular cortex and the pathophysiology of stroke-induced cardiac changes. Can J Neurol Sci. 1992 May;19(2):208-11. | PubMed |
Oppenheimer S. The insular cortex and the pathophysiology of stroke-induced cardiac changes. Can J Neurol Sci. 1992 May;19(2):208-11. | PubMed | Mellado P. Alteraciones cardíacas secundarias a enfermedades del sistema nervioso central. En: cuadernos de Neurología. Univ. Católica de Chile. 1999; 15(7): 15-18.
Mellado P. Alteraciones cardíacas secundarias a enfermedades del sistema nervioso central. En: cuadernos de Neurología. Univ. Católica de Chile. 1999; 15(7): 15-18.  Ostábal MI, Sanz-Sebastián C, Suárez-Pinilla MA, del Río-Ligorit A. Estudio de las alteraciones electrocardiográficas durante la fase aguda de una hemorragia intraparenquimatosa y sus implicaciones pronósticas. Rev Neurol. 1996 Oct;24(134):1229-32. | PubMed |
Ostábal MI, Sanz-Sebastián C, Suárez-Pinilla MA, del Río-Ligorit A. Estudio de las alteraciones electrocardiográficas durante la fase aguda de una hemorragia intraparenquimatosa y sus implicaciones pronósticas. Rev Neurol. 1996 Oct;24(134):1229-32. | PubMed | Kocan MJ. The brain-heart connection: cardiac effects of acute ischemic stroke. J Cardiovasc Nurs. 1998 Oct;13(1):57-68; quiz 97. | PubMed |
Kocan MJ. The brain-heart connection: cardiac effects of acute ischemic stroke. J Cardiovasc Nurs. 1998 Oct;13(1):57-68; quiz 97. | PubMed | Donnan G. The treatment of acute ischemic stroke. Program and abstracts 17th World Congress of Neurology : Neurol Sci. London 2001; 17(6): 187.
Donnan G. The treatment of acute ischemic stroke. Program and abstracts 17th World Congress of Neurology : Neurol Sci. London 2001; 17(6): 187.  Alonso de Leciñana M, Díez Tejedor E, Frank A, Barreiro P. Guía para el manejo del paciente con enfermedad vascular cerebral aguda. Rev Neurol. 1995 Mar-Apr;23(120):363-9. | PubMed |
Alonso de Leciñana M, Díez Tejedor E, Frank A, Barreiro P. Guía para el manejo del paciente con enfermedad vascular cerebral aguda. Rev Neurol. 1995 Mar-Apr;23(120):363-9. | PubMed |