 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es la transcripción editada de la conferencia dictada y revisada en el curso Desafíos y Oportunidades en Gastroenterología y Nutrición organizado por las ramas de nutrición y gastroenterología de la Sociedad Chilena de Pediatría. Este curso se llevó a cabo entre el 3 y 5 de mayo de 2007 y sus directores fueron la Dra. Sylvia Cruchet y el Dr. Francisco Moraga. Edición y publicación en Medwave gracias al auspicio de Nestlé Nutrition.
El daño hepático secundario a alimentación parenteral (AP) se considera como un fenómeno iatrogénico, ya que ocurre como consecuencia de un acto médico cuyo objetivo primario es promover la salud del paciente, pero puede tener efectos adversos. La patogenia del daño hepático secundario a alimentación parenteral no se conoce completamente, pero se sabe que su origen es multifactorial y que existe superposición de eventos causales; por esto, no existen medidas de prevención cien por ciento eficaces ni guías clínicas con base en evidencias tipo 1 sobre el tratamiento más indicado. Se ha relacionado con cinco factores potencialmente patogénicos:
Las enzimas pancreáticas se encuentran elevadas en 40 a 70% de los niños que reciben AP, en algún momento del tratamiento (1, 2). Se reconocen tres patrones de hepatopatía: la colestasia, que es el patrón hepatotóxico más frecuente en los niños; la esteatosis, más frecuente en adultos y la disfunción de la vía biliar y vesicular, común para ambos grupos. Esta clasificación es operativo-conceptual, ya que se pueden sobreponer los hallazgos en un mismo niño (3, 4).
La colestasia se define, desde el punto de vista fisiológico, como la disminución del flujo biliar; desde el punto de vista patológico, como la presencia de bilis en el hepatocito y los conductos; y en el aspecto clínico, como la acumulación, en la sangre y tejidos extrahepáticos, de sustancias que normalmente son excretadas en la bilis, como bilirrubina, ácidos biliares y colesterol (5).
La colestasia es un fenómeno histológico que se ve predominantemente en los niños; su incidencia es variable, entre 7,4% y 84%, dependiendo del criterio diagnóstico. La presencia de colestasia se debería definir a través de la medición de las sales biliares, pero este examen no está disponible en forma rutinaria, por lo que se utiliza el nivel de bilirrubina, que también es variable: algunos autores hablan de 1,5 mg/dl, otros, de 2,0 y otros, de 2,5 mg/dl; este último valor es el que se maneja en forma habitual. Debido a lo anterior, la incidencia descrita en la literatura también es variable. La primera descripción del fenómeno colestásico relacionado con la AP data de 1971 (6). Posteriormente se ha visto que en la mayoría de los casos es un fenómeno transitorio, que revierte al suspender la AP, pero en algunos casos puede llegar a fibrosis e insuficiencia hepática, siendo una de las causas de trasplante hepático. En la práctica, el diagnóstico de colestasia se hace cuando existe aumento de transaminasas, bilirrubina y fosfatasas alcalinas.
Desde el punto de vista patológico, la colestasia se caracteriza por la presencia de tapones biliares pericentrales y/o periportales dentro del parénquima hepático, de distribución centrolobular y distintas formas evolutivas. En biopsias al quinto día de AP ya se encuentra esteatosis, hematopoiesis y eosinofilia, que progresa a colestasia prominente centrolobular sin inflamación subjetiva ni esteatosis. Lo importante es que la acumulación de grasa dentro del hígado determina un proceso inflamatorio que deriva en fibrosis hepática, la cual implica un punto en que el fenómeno deja de ser reversible. Esta fibrosis rara vez aparece antes de tres meses, por eso se considera que la AP en niños no se debe prolongar más allá de ese lapso.
La esteatosis es un fenómeno que se observa predominantemente en adultos; su incidencia es variable, pero se supone alta, ya que 70% de los pacientes presenta elevación enzimática entre la primera y la cuarta semanas de AP y presentan remisión espontánea, a pesar de seguir con este tratamiento; sin embargo, con AP prolongada, mayor de 2000 días/paciente, hasta 15% de los casos evolucionan hacia insuficiencia hepática. Se ha descrito que el fenómeno de daño hepatotóxico en los niños es más precoz y grave, pero desde que se implementó la AP domiciliaria por períodos prolongados se ha visto que la evolución con daño hepático secundario no es tan diferente entre niños y adultos. En la anatomía patológica se observa esteatosis macrovesicular de inicio periportal, sin inflamación, pero con elevación de enzimas. La aparición de cambios inflamatorios y fibrosis se asocia a duración prolongada de la AP.
Se describe la presencia de colelitiasis y barro biliar en 2% de los niños y 42% de los adultos que reciben AP. La forma fundamental es la acumulación de sarro biliar y cuando existen cálculos, son de bilirrubinato de calcio. También puede ocurrir la colecistitis acalculosa, que se ve en 4% a 19% de los casos. Debido a lo anterior, algunos cirujanos consideran que se debe extirpar la vesícula biliar en el mismo acto cuando es probable que el paciente evolucione con intestino corto y siempre que las condiciones clínicas lo permitan, pero esta conducta es discutible (7, 8).
En la Fig. 1 se resumen los factores involucrados en las alteraciones secundarias a AP. Cuando se administra AP los nutrientes no llegan al intestino delgado en forma regular, es decir, en bolos, de modo que no se produce la estimulación fisiológica del sistema enterohormonal y ocurre una situación anómala en el tubo digestivo; en cambio, hay muchos nutrientes en circulación, con altas cargas plasmáticas de glucosa, aminoácidos y lípidos, en especial ácidos grasos. El aporte excesivo de calorías en forma de carbohidratos o grasas, sumado al impedimento en la secreción de triglicéridos por alteración de la relación insulina-glucagón a nivel de la vena porta, que favorece la acumulación de triglicéridos y lípidos a nivel intrahepático, conduce al fenómeno de esteatosis.
Por otra parte, en los niños existe una inmadurez del sistema bilio-excretor, lo que, junto al desbalance insulina-glucagón, lleva a la acumulación en el hígado de elementos que se deberían eliminar a través del flujo biliar. Además existe un patrón aminoacídico anormal, con disminución de taurina, que es un aminoácido importante para la detoxificación y conjugación de algunas sales biliares; como resultado, se empiezan a acumular sales biliares tóxicas. Junto a lo anterior, la sobrecarga de lípidos, el sobrecrecimiento bacteriano y la traslocación bacteriana secundaria a la alteración anatómica y fisiológica del intestino, producen la colestasia. Finalmente, la contracción vesicular defectuosa, debido a la falta del estímulo enteral mediado por la colecistoquinina, se suma a la alteración en la secreción biliar para generar espesamiento biliar, fenómeno precursor de la formación de cálculos y barro biliar.
Figura 1. Daño hepático y alimentación parenteral.
La duración prolongada de la alimentación parenteral, la sepsis, la hipoalbuminemia al inicio de la AP y la prematurez, son condiciones que favorecen la aparición del daño hepático secundario (9).
Duración: se ha demostrado que a las dos primeras semanas de administración, 35% de los niños presenta elevación enzimática y ésta está presente en 75% de los niños a los noventa días (10, 11). Las evidencias indican que la gravedad clínica e histológica se relaciona con la duración del procedimiento.
Sepsis: los principales involucrados son los gérmenes gramnegativos, cuyo lipopolisacárido estimula, a nivel hepático, a los macrófagos y células de Küpfer, induciendo la producción de sustancias pro-inflamatorias como interleuquina 1 beta (IL-1 beta), IL-6 y factor de necrosis tumoral, que alteran la expresión genética de los factores responsables del fenómeno excretor a nivel del canalículo y la membrana basolateral (12).
Hipoalbuminemia: se sabe que su presencia al inicio de la AP se asocia a mayor riesgo de colestasia, pero no está claro si se debe a la gravedad de la enfermedad que justifica el inicio de la AP o es un factor causal de daño hepático (13).
Prematurez y bajo peso al nacer: casi 50% de los neonatos de menos de 1.000 g que reciben AP desarrollan colestasia, lo que ocurre en sólo 7% de los que pesan más de 1.500 g. La diferencia también es notable según la edad gestacional: bajo 32 semanas, 13,7% tiene o desarrolla colestasia, la que se presenta en sólo 1,4% de los niños de más de 36 semanas. La inmadurez del sistema hepatobiliar, la menor reutilización y síntesis de sales biliares, la reducción de la circulación enterohepática producto de la condición que generó la AP, la menor capacidad de conjugación de esta vía biliar inmadura y la menor disponibilidad del sistema glutatión-dependiente son los factores que explican esta asociación (14, 15).
Dado que no se sabe bien cuál es la causa básica y la fisiopatología de este daño, los mecanismos propuestos son múltiples: sobrecarga calórica; componentes de la AP; ayuno enteral; sepsis; deficiencias nutricionales de taurina, colina y carnitina; toxicidad por constituyentes de la AP; fitoesteroles, manganeso; factores hormonales, como aumento de la relación portal insulina/glucagón, enterohormonas, estasia biliar; estrés oxidativo y alteración de la composición biliar. Lo más probable es que no exista una sola causa, sino que múltiples factores estén involucrados en el resultado final (16, 17, 18).
La sobrecarga calórica favorecería el daño hepático, especialmente si proviene de carbohidratos o por aumento de la cantidad de lípidos que supere la capacidad de clearence biliar; esto es dosis dependiente, es decir, a medida que aumenta la sobrecarga calórica, la toxicidad aumenta. Probablemente lo que más se ha relacionado con esto es la alteración insulina-glucagón a nivel de la vena porta, y en algunas oportunidades se ha usado glucagón como un factor que contribuye a tratar el daño hepático establecido, con buena respuesta, pero sólo hay comunicaciones de casos y series de casos, por lo que aún no se puede hacer una recomendación formal al respecto (19, 20, 21).
En cuanto a los componentes individuales de la alimentación parenteral, existen varias teorías que involucran a los aminoácidos, los lípidos y otros constituyentes de la alimentación, pero sin resultados concluyentes.
El exceso de proteínas es uno de los factores que más se ha estudiado y se sabe que la sobrecarga proteica induce esteatosis a través de la liberación de insulina y otros mecanismos (22). Se ha descrito un fenómeno relacionado con la exposición a la luz de las proteínas contenidas en la bolsa de AP, como ocurre en los recién nacidos en fototerapia o en cunas radiantes; con las bolsas más modernas, fabricadas con tecnología trilaminar, esto es menos importante. Asimismo, existen estudios que demuestran que cuando la bolsa de AP queda a una temperatura mayor que la que corresponde a un ambiente térmico neutral, se producen alteraciones de los isómeros de ciertos componentes, lo que contribuye al daño hepático.
El alto porcentaje de calorías provenientes de grasas e hidratos de carbono sería un factor de riesgo para daño hepático (23), al igual que cierta composición y perfil aminoacídico (24). En la actualidad los aminoácidos pediátricos contienen cisteína como precursor de los aminoácidos necesarios para labores de deconjugación a nivel hepático y biliar, por lo que ha disminuido el uso de metionina, que es un precursor de taurina y cisteína, aminoácidos involucrados en la amidación vía glicina de los ácidos biliares tóxicos, especialmente del litocólico, que es hepatotóxico.
Los fitoesteroles tienen algunas ventajas cuando se usan por vía enteral, pero el contenido en ciertas preparaciones o formulaciones parenterales también se ha relacionado con algún grado de daño hepático (25).
El manganeso y el cobre son responsables de daño secundario, es decir, cuando ya está establecida la esteatosis y el daño hepatotóxico, ya que estos elementos, que se eliminan por la vía biliar, se acumulan en valores incluso mayores que los que se observan en la enfermedad de Wilson; pero esto es más bien un fenómeno secundario, que probablemente contribuye al daño posterior (26, 27).
El ayuno enteral provoca daño, o contribuye a provocarlo, a través de muchos mecanismos (28). En la medida en que no existe estímulo enteral, la pared celular intestinal se va atrofiando, se genera hipoplasia vellositaria y la ateración progresa hasta llegar a las capas más basales, con el consiguiente daño de las tight-junctions y permeación de las bacterias que crecen en el tubo digestivo. Como consecuencia de esta atrofia disminuye la inmunidad local, lo que favorece el sobrecrecimiento bacteriano y permite la traslocación y paso de toxinas.
La sepsis asociada a alimentación parenteral es sumatoria, es decir, el daño que podría producir el fenómeno séptico y la alimentación parenteral por separado se suman, de modo que la sepsis en pacientes que están recibiendo alimentación parenteral es más perjudicial para el hígado que la sepsis como evento aislado (29, 30).
En cuanto al déficit de taurina, colina y carnitina, la literatura no es concluyente, porque hay muchos estudios en animales, pero pocos estudios clínicos y ningún estudio controlado; la mayoría son series o estudios de asociación, pero no de causa-efecto. La taurina es un aminoácido esencial, que en los lactantes protege contra el daño hepático mediante la conjugación de algunas sales biliares; es indetectable en neonatos fallecidos por colestasia, pero cuando se ha usado en fórmulas no se ha obtenido la respuesta esperada, de modo que su administración en la fórmula parenteral no parece ser la solución (31, 32, 33). El déficit de colina, que también es un derivado de metionina, se asocia a disminución de la síntesis de lipoproteínas de muy baja densidad (VLDL) y aumento de la concentración de triglicéridos en el hígado, pero todavía no hay elementos para tomar una decisión definitiva sobre su rol beneficioso como elemento terapéutico (34). Con la carnitina, glutamina, vitamina E y selenio ocurre lo mismo: se sabe que la glutamina participa como nutriente en el cuerpo del enterocito, la carnitina, en su relación con el metabolismo de los ácidos grasos y la vitamina E y el selenio como antioxidantes, pero tampoco hay elementos comprobatorios decisivos de su utilidad en el tratamiento (35).
El estrés oxidativo está presente en muchos tipos de enfermedades, ya que es parte del fenómeno inflamatorio, por lo tanto está presente en la colestasia y la esteatosis, que tienen una base o son consecuencia de la inflamación. El ácido tiobarbitúrico, que se utiliza para evaluar el estrés oxidativo, reacciona con muchos elementos que tienen que ver con el fenómeno inflamatorio, los cuales se encuentran elevados en la orina cuando hay alteración de las enzimas pancreáticas, reflejando la presencia de un fenómeno oxidativo (36). La homocisteína, como precursor del glutatión, que es un gran detoxificador del organismo, podría ayudar, pero tampoco hay evidencia concluyente.
La estasia biliar es consecuencia de la falta del estímulo enteral, al igual que la disminución de las enterohormonas. Se sabe que la colecistoquinina es importante por su función en vesícula y flujo biliar, y que la falta de este estímulo facilita el desarrollo de barro biliar, cálculos y atonía; otras sustancias, como enteroglucagón, gastrina, motilina, secretina y péptido intestinal vasoactivo también se afectan (37).
La composición biliar alterada, secundaria a la estasia, se traduce en aumento del pH (alcalino) y de la concentración biliar, lo que favorece litogénesis y la acumulación de calcio; además aumenta el ácido litocólico, hepatotóxico, que se correlaciona con aumento de las enzimas hepáticas. Este fenómeno, más que inicial, se ha asumido como continuador del daño (38).
La evidencia actual sugiere que son útiles las siguientes medidas: minimizar la duración de la AP cuanto sea posible y ciclarla tan pronto sea fisiológicamente tolerable; prevenir, detectar precozmente y tratar adecuadamente la sepsis, principalmente a través de vigilancia del catéter venoso central; e iniciar la alimentación enteral tan pronto sea prudente.
Ciclar la AP significa dejar horas del día sin esta administración masiva de nutrientes al torrente sanguíneo, especialmente en lo que se refiere a la carga calórica derivada de carbohidratos, permitiendo que se normalice la relación insulina-glucagón a nivel de la vena porta y que el hígado pueda empezar a funcionar en forma más fisiológica. Es importante ciclarla el mayor tiempo posible, porque muchas veces el gran impedimento es que no hay una vía enteral suficiente, de modo que los períodos de ayuno que se pueden mantener son breves y por lo tanto, el período de ciclado es muy escaso.
Se debe iniciar la alimentación enteral tan pronto sea posible utilizando cantidades tróficas para el intestino, es decir, que aporten entre 5 y 15% de las calorías totales por vía enteral, de manera que no represente un volumen importante en términos de aporte, pero que sea significativo para efectos del trofismo y la mantención del sistema enteral. Esto se debe correlacionar con el débito de la colostomía o el volumen de pérdida de deposiciones, para aumentar el aporte tan pronto la vía enteral sea tolerada.
Es importante prevenir y detectar precozmente la sepsis, cuya causa más importante es la infección del catéter venoso central, de modo que es muy importante su vigilancia. Se debe usar un catéter de larga vida y buen material, tipo Hickman o Broviac, de uso exclusivo y excluyente para alimentación parenteral, idealmente de un solo lumen, usando otras vías si es necesario administrar fármacos. Esto es importante no sólo para evitar la sepsis, sino también para evitar el daño vascular.
Recomendaciones que se pueden implementar, pero no tienen un sustento seguro, son la protección contra la luz, la protección contra el calor, la administración de taurina, glutamina o colecistoquinina y la colecistectomía profiláctica.
Entre las medidas disponibles para tratar la disfunción hepatobiliar por AP están las siguientes:
El ácido ursodeoxicólico o ácido dihidroxi (3a, 7b-dihidroxi-5b-colánico) tiene al menos cuatro funciones que protegen del daño hepático colestásico: protege al colangiocito dañado por el efecto tóxico de los ácidos biliares; estimula la secreción biliar afectada; estimula la detoxificación de los ácidos biliares hidrofóbicos, especialmente el litocólico; e inhibición de la apoptosis de los hepatocitos, fenómeno pre-mortem de esta célula y que precede a la fibrosis (39) (Fig. 2).
Figura 2. Acciones del ácido ursodeoxicólico (39).
El uso de drogas antiinflamatorias es lo más novedoso en el tratamiento. Se administran aquellas interleuquinas que controlan, regulan, suprimen o modulan el proceso inflamatorio, o se utilizan aquellos medicamentos o moléculas que atacan al efector final, que sería el factor de necrosis tumoral alfa. También se ha utilizado adiponectina. En la primera comunicación, realizada en el año 2000, se describió el caso de un paciente adulto al que se administró infliximab para el manejo de una colestasia irreversible frente a todas las otras medidas y tuvo excelente respuesta terapéutica (40). Sin embargo,
también existen reportes contradictorios.
La colestasia daña al hígado y se ha demostrado que la presencia de bilirrubina directa sobre 2,5 mg/dl disminuye la sobrevida del paciente; por lo tanto, cuando un niño supera el cuadro crítico que motivó la indicación de AP por tiempo prolongado, sea una enterocolitis necrotizante, un vólvulo u otro proceso mórbido, se debe hacer todo lo posible para evitar que se produzca un desenlace fatal por esta causa iatrogénica.
Un caso clínico que ilustra el tema es el de A.M.Q., hijo de madre analfabeta, portador de asociación de Vater: monorreno, con malformaciones de la vía urinaria, malformaciones vertebrales e intestino ultra corto, de 10 centímetros; además tiene una vesicostomía, por lo tanto tiene que orinar a través de un ostoma y presenta una serie de problemas ortopédicos Está con AP domiciliaria nocturna, durante el día hace una vida prácticamente normal y está estable, en espera de un trasplante o de lograr abandonar el uso de AP.

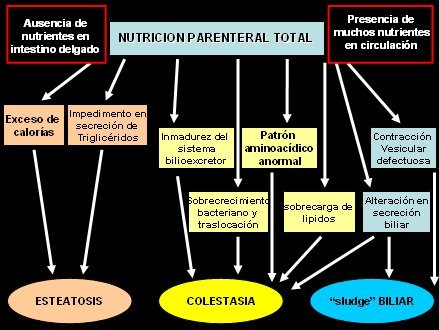 Figura 1. Daño hepático y alimentación parenteral.
Figura 1. Daño hepático y alimentación parenteral.

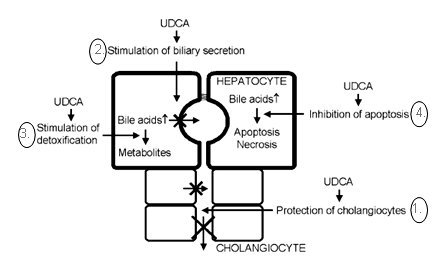 Figura 2. Acciones del ácido ursodeoxicólico (39).
Figura 2. Acciones del ácido ursodeoxicólico (39).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada de la conferencia dictada y revisada en el curso Desafíos y Oportunidades en Gastroenterología y Nutrición organizado por las ramas de nutrición y gastroenterología de la Sociedad Chilena de Pediatría. Este curso se llevó a cabo entre el 3 y 5 de mayo de 2007 y sus directores fueron la Dra. Sylvia Cruchet y el Dr. Francisco Moraga. Edición y publicación en Medwave gracias al auspicio de Nestlé Nutrition.
 Expositor:
Francisco Moraga[1]
Expositor:
Francisco Moraga[1]

Citación: Moraga F. Liver damage from parenteral nutrition. Medwave 2008 Jul;8(6):e503 doi: 10.5867/medwave.2008.06.503
Fecha de publicación: 1/7/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Angelico M, Della Guardia P. Review article : hepatobiliary complications associated with total parenteral nutrition. Aliment Pharmacol Ther. 2000 May;14 Suppl 2:54-7. | CrossRef | PubMed |
Angelico M, Della Guardia P. Review article : hepatobiliary complications associated with total parenteral nutrition. Aliment Pharmacol Ther. 2000 May;14 Suppl 2:54-7. | CrossRef | PubMed | Kaufman SS. .Prevention of parenteral nutrition-associated liver disease in children. Pediatr Transplant. 2002 Feb;6(1):37-42. | CrossRef | PubMed |
Kaufman SS. .Prevention of parenteral nutrition-associated liver disease in children. Pediatr Transplant. 2002 Feb;6(1):37-42. | CrossRef | PubMed | Quigley EM, Marsh MN, Shaffer JL, Markin RS. Hepatobiliary complications of total parenteral nutrition. Gastroenterology. 1993 Jan;104(1):286-301. | PubMed |
Quigley EM, Marsh MN, Shaffer JL, Markin RS. Hepatobiliary complications of total parenteral nutrition. Gastroenterology. 1993 Jan;104(1):286-301. | PubMed | Baker AL, Rosenberg IH. Hepatic complications of total parenteral nutrition. Am J Med. 1987 Mar;82(3):489-97. | CrossRef | PubMed |
Baker AL, Rosenberg IH. Hepatic complications of total parenteral nutrition. Am J Med. 1987 Mar;82(3):489-97. | CrossRef | PubMed | Gerbes AL, Ávila MA, Caselmann WH, Liver injury and liver protection: mechanisms and novel treatment strategies. Liver International 2006 Oct;26(8):902-3. | CrossRef |
Gerbes AL, Ávila MA, Caselmann WH, Liver injury and liver protection: mechanisms and novel treatment strategies. Liver International 2006 Oct;26(8):902-3. | CrossRef | Peden VH, Witzleben CL, Skelton MA. Total parenteral nutrition. J Pediatr. 1971 Jan;78(1):180-1. | CrossRef | PubMed |
Peden VH, Witzleben CL, Skelton MA. Total parenteral nutrition. J Pediatr. 1971 Jan;78(1):180-1. | CrossRef | PubMed | Messing B, Bories C, Kunstlinger F, Bernier JJ. Does total parenteral nutrition induce gallbladder sludge formation and lithiasis? Gastroenterology. 1983 May;84(5 Pt 1):1012-9. | PubMed |
Messing B, Bories C, Kunstlinger F, Bernier JJ. Does total parenteral nutrition induce gallbladder sludge formation and lithiasis? Gastroenterology. 1983 May;84(5 Pt 1):1012-9. | PubMed | Henkel AS, Buchman AL. Preservation of liver function in intestinal failure patients treated with long-term total parenteral nutrition Current Opinion in Organ Transplantation. 2006 Jun;11(3):251-255. | CrossRef |
Henkel AS, Buchman AL. Preservation of liver function in intestinal failure patients treated with long-term total parenteral nutrition Current Opinion in Organ Transplantation. 2006 Jun;11(3):251-255. | CrossRef | Kwan V, George J. Liver disease due to parenteral and enteral nutrition. Clin Liver Dis. 2004 Nov;8(4):893-913, ix-x. | CrossRef | PubMed |
Kwan V, George J. Liver disease due to parenteral and enteral nutrition. Clin Liver Dis. 2004 Nov;8(4):893-913, ix-x. | CrossRef | PubMed | Ginn-Pease ME, Pantalos D, King DR. TPN-associated hyperbilirubinemia: a common problem in newborn surgical patients. J Pediatr Surg. 1985 Aug;20(4):436-9. | CrossRef | PubMed |
Ginn-Pease ME, Pantalos D, King DR. TPN-associated hyperbilirubinemia: a common problem in newborn surgical patients. J Pediatr Surg. 1985 Aug;20(4):436-9. | CrossRef | PubMed | Bell RL, Ferry GD, Smith EO, Shulman RJ, Christensen BL, Labarthe DR, et al. Total parenteral nutrition-related cholestasis in infants. JPEN J Parenter Enteral Nutr. 1986 Jul-Aug;10(4):356-9. | CrossRef | PubMed |
Bell RL, Ferry GD, Smith EO, Shulman RJ, Christensen BL, Labarthe DR, et al. Total parenteral nutrition-related cholestasis in infants. JPEN J Parenter Enteral Nutr. 1986 Jul-Aug;10(4):356-9. | CrossRef | PubMed | Shamir R, Maayan-Metzger A, Bujanover Y, Ashkenazi S, Dinari G, Sirota L. Liver enzyme abnormalities in gram-negative bacteremia of premature infants. Pediatr Infect Dis J. 2000 Jun;19(6):495-8. | CrossRef | PubMed |
Shamir R, Maayan-Metzger A, Bujanover Y, Ashkenazi S, Dinari G, Sirota L. Liver enzyme abnormalities in gram-negative bacteremia of premature infants. Pediatr Infect Dis J. 2000 Jun;19(6):495-8. | CrossRef | PubMed | Nanji AA, Anderson FH. Relationship between serum albumin and parenteral nutrition-associated cholestasis. JPEN J Parenter Enteral Nutr. 1984 Jul-Aug;8(4):438-9. | CrossRef | PubMed |
Nanji AA, Anderson FH. Relationship between serum albumin and parenteral nutrition-associated cholestasis. JPEN J Parenter Enteral Nutr. 1984 Jul-Aug;8(4):438-9. | CrossRef | PubMed | Ginn-Pease ME, Pantalos D, King DR. TPN-associated hyperbilirubinemia: a common problem in newborn surgical patients. J Pediatr Surg. 1985 Aug;20(4):436-9. | CrossRef | PubMed |
Ginn-Pease ME, Pantalos D, King DR. TPN-associated hyperbilirubinemia: a common problem in newborn surgical patients. J Pediatr Surg. 1985 Aug;20(4):436-9. | CrossRef | PubMed | Belli DC, Albrecht R, La Scala GC, Desjeux JF, Pelissier MA. Homocysteine prevents total parenteral nutrition (TPN)-induced cholestasis without changes in hepatic oxidative stress in the rat. J Pediatr Gastroenterol Nutr. 2003 Feb;36(2):200-5. | CrossRef | PubMed |
Belli DC, Albrecht R, La Scala GC, Desjeux JF, Pelissier MA. Homocysteine prevents total parenteral nutrition (TPN)-induced cholestasis without changes in hepatic oxidative stress in the rat. J Pediatr Gastroenterol Nutr. 2003 Feb;36(2):200-5. | CrossRef | PubMed | Angelico M, Della Guardia P. Review article: hepatobiliary complications associated with total parenteral nutrition. Aliment Pharmacol Ther. 2000 May;14 Suppl 2:54-7. | CrossRef | PubMed |
Angelico M, Della Guardia P. Review article: hepatobiliary complications associated with total parenteral nutrition. Aliment Pharmacol Ther. 2000 May;14 Suppl 2:54-7. | CrossRef | PubMed | Grau T, Bonet A, Rubio M, Mateo D, Farré M, Acosta JA,et al. Liver dysfunction associated with artificial nutrition in critically ill patients. Crit Care. 2007;11(1):R10. | CrossRef | PubMed | PMC |
Grau T, Bonet A, Rubio M, Mateo D, Farré M, Acosta JA,et al. Liver dysfunction associated with artificial nutrition in critically ill patients. Crit Care. 2007;11(1):R10. | CrossRef | PubMed | PMC | Messing B, Colombel JF, Heresbach D, Chazouillères O, Galian A. Chronic cholestasis and macronutrient excess in patients treated with prolonged parenteral nutrition. Nutrition. 1992 Jan-Feb;8(1):30-6. | PubMed |
Messing B, Colombel JF, Heresbach D, Chazouillères O, Galian A. Chronic cholestasis and macronutrient excess in patients treated with prolonged parenteral nutrition. Nutrition. 1992 Jan-Feb;8(1):30-6. | PubMed | Campos AC, Oler A, Meguid MM, Chen TY. Liver biochemical and histological changes with graded amounts of total parenteral nutrition. Arch Surg. 1990 Apr;125(4):447-50. | CrossRef | PubMed |
Campos AC, Oler A, Meguid MM, Chen TY. Liver biochemical and histological changes with graded amounts of total parenteral nutrition. Arch Surg. 1990 Apr;125(4):447-50. | CrossRef | PubMed | Vileisis RA, Inwood RJ, Hunt CE. Prospective controlled study of parenteral nutrition-associated cholestatic jaundice: effect of protein intake. J Pediatr. 1980 May;96(5):893-7. | CrossRef | PubMed |
Vileisis RA, Inwood RJ, Hunt CE. Prospective controlled study of parenteral nutrition-associated cholestatic jaundice: effect of protein intake. J Pediatr. 1980 May;96(5):893-7. | CrossRef | PubMed | Meguid MM, Akahoshi MP, Jeffers S, Hayashi RJ, Hammond WG. Amelioration of metabolic complications of conventional total parenteral nutrition. A prospective randomized study. Arch Surg. 1984 Nov;119(11):1294-8. | CrossRef | PubMed |
Meguid MM, Akahoshi MP, Jeffers S, Hayashi RJ, Hammond WG. Amelioration of metabolic complications of conventional total parenteral nutrition. A prospective randomized study. Arch Surg. 1984 Nov;119(11):1294-8. | CrossRef | PubMed | Shirohara H, Tabaru A, Otsuki M. Effects of intravenous infusion of amino acids on cholecystokinin release and gallbladder contraction in humans. J Gastroenterol. 1996 Aug;31(4):572-7. | CrossRef | PubMed |
Shirohara H, Tabaru A, Otsuki M. Effects of intravenous infusion of amino acids on cholecystokinin release and gallbladder contraction in humans. J Gastroenterol. 1996 Aug;31(4):572-7. | CrossRef | PubMed | High serum phytosterol levels in short bowel patients on parenteral nutrition support. Ellegård L, Sunesson A, Bosaeus I. Clin Nutr. 2005 Jun;24(3):415-20. | PubMed |
High serum phytosterol levels in short bowel patients on parenteral nutrition support. Ellegård L, Sunesson A, Bosaeus I. Clin Nutr. 2005 Jun;24(3):415-20. | PubMed | Manganese toxicity in children receiving long-term parenteral nutrition. Lancet. 1996 May 4;347(9010):1218-21. | CrossRef | PubMed |
Manganese toxicity in children receiving long-term parenteral nutrition. Lancet. 1996 May 4;347(9010):1218-21. | CrossRef | PubMed | Blaszyk H, Wild PJ, Oliveira A, Kelly DG, Burgart LJ. Hepatic copper in patients receiving long-term total parenteral nutrition. J Clin Gastroenterol. 2005 Apr;39(4):318-20. | CrossRef | PubMed |
Blaszyk H, Wild PJ, Oliveira A, Kelly DG, Burgart LJ. Hepatic copper in patients receiving long-term total parenteral nutrition. J Clin Gastroenterol. 2005 Apr;39(4):318-20. | CrossRef | PubMed | Btaiche IF, Khalidi N. Parenteral nutrition-associated liver complications in children. Pharmacotherapy. 2002 Feb;22(2):188-211. | CrossRef | PubMed |
Btaiche IF, Khalidi N. Parenteral nutrition-associated liver complications in children. Pharmacotherapy. 2002 Feb;22(2):188-211. | CrossRef | PubMed | Wolf A, Pohlandt F. Bacterial infection: the main cause of acute cholestasis in newborn infants receiving short-term parenteral nutrition. J Pediatr Gastroenterol Nutr. 1989 Apr;8(3):297-303. | CrossRef | PubMed |
Wolf A, Pohlandt F. Bacterial infection: the main cause of acute cholestasis in newborn infants receiving short-term parenteral nutrition. J Pediatr Gastroenterol Nutr. 1989 Apr;8(3):297-303. | CrossRef | PubMed | Guertin F, Roy CC, Lepage G, Perea A, Giguère R, Yousef I, et al. Effect of taurine on total parenteral nutrition-associated cholestasis. JPEN J Parenter Enteral Nutr. 1991 May-Jun;15(3):247-51. | CrossRef | PubMed |
Guertin F, Roy CC, Lepage G, Perea A, Giguère R, Yousef I, et al. Effect of taurine on total parenteral nutrition-associated cholestasis. JPEN J Parenter Enteral Nutr. 1991 May-Jun;15(3):247-51. | CrossRef | PubMed | Heubi JE, Wiechmann DA, Creutzinger V, Setchell KD, Squires R Jr, Couser R, et al. Tauroursodeoxycholic acid (TUDCA) in the prevention of total parenteral nutrition-associated liver disease. J Pediatr. 2002 Aug;141(2):237-42. | CrossRef | PubMed |
Heubi JE, Wiechmann DA, Creutzinger V, Setchell KD, Squires R Jr, Couser R, et al. Tauroursodeoxycholic acid (TUDCA) in the prevention of total parenteral nutrition-associated liver disease. J Pediatr. 2002 Aug;141(2):237-42. | CrossRef | PubMed | Moran JM, Salas J, Botello F, Macià E, Climent V. Taurine and cholestasis associated to TPN. Experimental study in rabbit model. Pediatr Surg Int. 2005 Oct;21(10):786-92. Epub 2005 Oct 21. | CrossRef | PubMed |
Moran JM, Salas J, Botello F, Macià E, Climent V. Taurine and cholestasis associated to TPN. Experimental study in rabbit model. Pediatr Surg Int. 2005 Oct;21(10):786-92. Epub 2005 Oct 21. | CrossRef | PubMed | Buchman AL, Ament ME, Sohel M, Dubin M, Jenden DJ, Roch M, et al. Choline deficiency causes reversible hepatic abnormalities in patients receiving parenteral nutrition: proof of a human choline requirement: a placebo-controlled trial. JPEN J Parenter Enteral Nutr. 2001 Sep-Oct;25(5):260-8. | CrossRef | PubMed |
Buchman AL, Ament ME, Sohel M, Dubin M, Jenden DJ, Roch M, et al. Choline deficiency causes reversible hepatic abnormalities in patients receiving parenteral nutrition: proof of a human choline requirement: a placebo-controlled trial. JPEN J Parenter Enteral Nutr. 2001 Sep-Oct;25(5):260-8. | CrossRef | PubMed | Buchman AL, Iyer K, Fryer J. Parenteral nutrition-associated liver disease and the role for isolated intestine and intestine/liver transplantation. Hepatology. 2006 Jan;43(1):9-19. | CrossRef | PubMed |
Buchman AL, Iyer K, Fryer J. Parenteral nutrition-associated liver disease and the role for isolated intestine and intestine/liver transplantation. Hepatology. 2006 Jan;43(1):9-19. | CrossRef | PubMed | Belli DC, Albrecht R, La Scala GC, Desjeux JF, Pelissier MA. Homocysteine prevents total parenteral nutrition (TPN)-induced cholestasis without changes in hepatic oxidative stress in the rat. J Pediatr Gastroenterol Nutr. 2003 Feb;36(2):200-5. | CrossRef | PubMed |
Belli DC, Albrecht R, La Scala GC, Desjeux JF, Pelissier MA. Homocysteine prevents total parenteral nutrition (TPN)-induced cholestasis without changes in hepatic oxidative stress in the rat. J Pediatr Gastroenterol Nutr. 2003 Feb;36(2):200-5. | CrossRef | PubMed | Wang X, Soltesz V, Axelson J, Andersson R. Cholecystokinin increases small intestinal motility and reduces enteric bacterial overgrowth and translocation in rats with surgically induced acute liver failure. Digestion 1996; 57: 67-72. | CrossRef | PubMed |
Wang X, Soltesz V, Axelson J, Andersson R. Cholecystokinin increases small intestinal motility and reduces enteric bacterial overgrowth and translocation in rats with surgically induced acute liver failure. Digestion 1996; 57: 67-72. | CrossRef | PubMed | Dawes LG, Greiner M, Joehl RJ. Altered gallbladder bile acidification with long-term total parenteral nutrition. J Surg Res. 1999 Jan;81(1):21-6. | CrossRef | PubMed |
Dawes LG, Greiner M, Joehl RJ. Altered gallbladder bile acidification with long-term total parenteral nutrition. J Surg Res. 1999 Jan;81(1):21-6. | CrossRef | PubMed | Paumgartner G, Beuers U. Mechanisms of action and therapeutic efficacy of ursodeoxycholic acid in cholestatic liver disease. Clin Liver Dis. 2004 Feb;8(1):67-81, vi. | CrossRef | PubMed |
Paumgartner G, Beuers U. Mechanisms of action and therapeutic efficacy of ursodeoxycholic acid in cholestatic liver disease. Clin Liver Dis. 2004 Feb;8(1):67-81, vi. | CrossRef | PubMed | Tilg H, Kaser A, Moschen AR. How to modulate inflammatory cytokines in liver diseases. Liver Int. 2006 Nov;26(9):1029-39. | CrossRef | PubMed |
Tilg H, Kaser A, Moschen AR. How to modulate inflammatory cytokines in liver diseases. Liver Int. 2006 Nov;26(9):1029-39. | CrossRef | PubMed | Forrest EH, Oien KA, Dickson S, Galloway D, Mills PR. Improvement in cholestasis associated with total parenteral nutrition after treatment with an antibody against tumour necrosis factor alpha. Liver. 2002 Aug;22(4):317-20. | CrossRef | PubMed |
Forrest EH, Oien KA, Dickson S, Galloway D, Mills PR. Improvement in cholestasis associated with total parenteral nutrition after treatment with an antibody against tumour necrosis factor alpha. Liver. 2002 Aug;22(4):317-20. | CrossRef | PubMed |