Este texto completo es una transcripción editada y revisada de una conferencia dictada en el Curso de Educación Continua Actualización en Medicina Interna 2009, organizado por el Departamento de Medicina del Hospital Clínico de la Universidad de Chile y realizado entre el 29 de mayo y el 26 de septiembre de 2009. Su directora es la Dra. María Eugenia Sanhueza.
En la primera parte de esta presentación se analizarán los elementos fisiopatológicos asociados a las complicaciones crónicas de la diabetes mellitus en general, y a la nefropatía diabética en particular, con énfasis en el manejo de ésta. En la segunda parte se hablará sobre fisiopatología y manejo de la retinopatía, la neuropatía y las complicaciones macrovasculares propias de la diabetes.
Las complicaciones crónicas de la diabetes mellitus (DM) se clasifican, según el calibre del vaso sanguíneo afectado, en macroangiopáticas y microangiopáticas. Entre estas últimas se encuentran la nefropatía, la retinopatía y la neuropatía diabéticas. El daño ocurre en estos territorios debido a que las células no tienen mecanismos adecuados para enfrentar la hiperglicemia mantenida en el tiempo, de modo que los niveles de glucosa aumentan también a nivel intracelular, a diferencia de otras regiones del cuerpo que tienen mejores mecanismos defensivos frente a esta situación. La hiperglicemia produce alteraciones bioquímicas y funcionales que son reversibles en la primera etapa, en la cual la normalización metabólica de esta condición podría no sólo detener la progresión de las alteraciones, sino también revertirlas; cuando la hiperglicemia se mantiene en forma persistente en el tiempo se producen alteraciones estructurales que determinan el paso a una etapa irreversible.
Las complicaciones crónicas son determinadas por los siguientes grupos de factores condicionantes:
La hiperglicemia determina el desarrollo de complicaciones crónicas a través de varios mecanismos, entre ellos:
En la Fig. 1 se resume la forma en que funciona la vía del poliol. Normalmente la enzima aldosa-reductasa intracelular cumple la función de reducir los aldehídos tóxicos, pero frente al aumento de glucosa citoplasmática su función se reorienta hacia la producción de sorbitol y fructosa, con el consecuente consumo de NAD fosfato hidrogenado, un gran metabolito antioxidante cuyo consumo expone a la célula a daño por radicales libres y estrés oxidativo, que causa envejecimiento celular.
La glicosilación no enzimática es el proceso de unión de la glucosa a proteínas no mediada por enzimas, con formación de AGEs. Antes se pensaba que este proceso era muy lento y que se requería largo tiempo de exposición de las proteínas a la hiperglicemia para que éstas se impregnaran de glucosa; pero actualmente se sabe que las proteínas se glicosilan rápidamente en ambientes hiperglicémicos. Este proceso ocurre en diferentes niveles: cuando la glicosilación ocurre en los ácidos nucleicos, se asocia a producción de mutaciones y cuando ocurre en proteínas de las superficies celulares, se produce inmunogenicidad y se generan respuestas de tipo auto-inmune, con producción de anticuerpos e inflamación, la que tendría un rol importante en el desarrollo de ateroesclerosis. Además la glicosilación puede modificar proteínas intracelulares relacionadas con la transcripción de genes; puede alterar las señales entre las células y la matriz que las sostiene; y finalmente, puede transformar proteínas como la albúmina y LDL y desencadenar procesos inflamatorios debido al no reconocimiento de las proteínas circulantes por sus receptores.
La proteinquinasa C (PKC) aumenta frente a la hiperglicemia crónica debido a que ésta aumenta el flujo de las vías metabólicas alternas, lo que genera mayor cantidad de diacilglicerol, el cual estimula la síntesis de PKC e isoformas como la beta. Esta proteína aumenta la filtración capilar, lo que incrementa la excreción urinaria de albúmina y favorece la extravasación de otras macromoléculas; y por otra parte aumenta factores de crecimiento y citoquinas que provocan una expansión de la matriz mesangial, con posterior neovascularización (Fig. 2).
Figura 2. Mecanismo de daño de la hiperglicemia a través del incremento de la PKC.
La vía de la hexosamina es una de las más recientemente estudiadas en relación al desarrollo de complicaciones crónicas. Cuando hay un aumento de la glucosa intracelular se produce un metabolito que es la N-acetil-glucosamina que también se origina por una vía metabólica alterna Si bien es una vía muy compleja, lo principal es que produce una variación en la transcripción proteica que se refleja en una alteración en la proliferación de las células mesangiales, endoteliales y cardiomiocitos.
Figura 3. Vía de la hexosamina.
La nefropatía diabética es una complicación microangiopática de la DM. Se presenta tanto en pacientes diabéticos tipo 1 como tipo 2. Es la primera causa de insuficiencia renal y su primera manifestación es la aparición de microalbuminuria, por lo que es muy importante su detección precoz; puede evolucionar desde microalbuminuria a proteinuria e insuficiencia renal terminal en un largo período de tiempo. Además se asocia a aumento del riesgo cardiovascular, que llega a ser 4 veces mayor que en los pacientes diabéticos sin nefropatía. Es importante destacar que mientras más precoz es el tratamiento, mayor es el beneficio.
Los datos epidemiológicos indican que la nefropatía diabética ocurre en 20 a 30% de los pacientes con DM; en algunos países se ha descrito una reducción en la incidencia de esta complicación, probablemente debido a mejor control de la patología de base. Esta entidad se manifiesta entre los 15 y 20 años de evolución de la diabetes y las personas con más de 20 a 25 años de diabetes sin nefropatía es raro que la presenten en un futuro. La prevalencia de nefropatía en pacientes con DM tipo 2 es 5 a 10% en el momento del diagnóstico, manifestada como microalbuminuria o algún grado de alteración de la función renal; a los 20 años de evolución la cifra llega a 25% y 20% de estos pacientes desarrolla insuficiencia renal crónica a los 10 años. Los pacientes con insuficiencia renal y diabetes presentan , además, altas tasas de morbilidad y mortalidad por enfermedades cardiovasculares, especialmente en la etapa de diálisis.
En la Fig. 4 se resume el mecanismo de producción de la nefropatía diabética. La hiperglicemia aumenta la PKC, el sorbitol y los AGEs, los que a su vez producen disfunción endotelial y aumento de factores de crecimiento, angiotensina II, endotelinas que son sustancias inflamatorias que alteran los vasos sanguíneos y aumento de citoquinas inflamatorias. Por otra parte se produce un incremento del factor transformante beta (TGF-beta, que a su vez aumenta tanto la síntesis mesangial como el espesor de la membrana basal y disminuye la degradación mesangial, favoreciendo la acumulación mesangial y la glomeruloesclerosis.
Figura 4. Mecanismo de daño renal por la hiperglicemia.
El mecanismo potencial de daño renal inducido por proteinuria se inicia con las alteraciones previamente descritas, causadas por la diabetes: éstas producen hipertensión del capilar glomerular, aumento de la permeabilidad capilar a proteínas plasmáticas e incremento de su filtración glomerular. Luego se produce un exceso de reabsorción tubular de estas proteínas, lo que ocasiona su acumulación en las células de los túbulos proximales. Lo anterior provoca liberación de citoquinas inflamatorias que inducen fibrosis, daño renal y posteriormente, disminución de la masa de nefrones.
La detección de microalbuminuria es el screening para nefropatía diabética incipiente y es un marcador de disfunción endotelial. Se debe realizar anualmente en todos los pacientes con DM tipo 2 desde el momento del diagnóstico y en los DM tipo 1 con más de 5 años de evolución; el hallazgo de microalbuminuria en un paciente con DM 1 señala la presencia de nefropatía, mientras que en un diabético tipo 2 podría corresponder tanto a disfunción endotelial como a nefropatía. Se define normoalbuminuria el valor menor de de 30 mg/día en orina de 24 horas; microalbuminuria, entre 30 y 300 mg/día y macroalbuminuria, más de 300 mg/día. También se puede utilizar la relación microalbuminuria/creatininuria en muestra aislada con los mismos valores de referencia, lo que evita la recolección de orina de 24 horas. No se debe determinar que existe microalbuminuria en las siguientes condiciones: infecciones urinarias, hematuria, fiebre, ejercicio intenso, hiperglicemia grave, hipertensión arterial descompensada e insuficiencia cardíaca no compensada.
En la evaluación de los pacientes con nefropatía diabética es muy importante realizar un diagnóstico diferencial correcto. La proteinuria que se presenta antes de cinco años desde el momento del diagnóstico de DM tipo 1 es poco probable que se deba a una nefropatía diabética; en estos pacientes se puede establecer con mayor claridad el momento de inicio de la diabetes, a diferencia de los diabéticos tipo 2 en los cuales el diagnóstico se puede realizar diez años después del inicio. También se debe pensar en otros diagnósticos diferenciales cuando hay ausencia de retinopatía diabética, inicio agudo de insuficiencia renal sin otros factores asociados y hematuria macroscópica, en cuyo caso es fundamental descartar una glomerulopatía u otra causa, por lo que se debe derivar al nefrólogo para estudio. Además en estos pacientes es importante evaluar la presencia de comorbilidades, especialmente otras complicaciones microvasculares como la retinopatía, que en general se asocia con nefropatía y es susceptible de tratamiento oportuno mediante panfotocoagulación, en caso necesario. Asimismo se debe pesquisar la neuropatía diabética y educar precozmente al paciente con respecto a los cuidados que esto requiere para evitar las complicaciones del pie diabético. Finalmente, se debe interrogar al paciente en busca de complicaciones macrovasculares y evaluar la necesidad de una evaluación cardiológica.
La prevención y tratamiento de la nefropatía diabética se realiza mediante:
La hipertensión arterial es el principal factor de riesgo de progresión de la insuficiencia renal, es muy frecuente su asociación con DM tipo 2 y el tratamiento oportuno reduce el riesgo cardiovascular. Según datos del estudio United Kingdom Prospective Diabetes Study (UKPDS), la reducción de la presión arterial sistólica de 154 a 144 mmHg reduce en 29% el riesgo de desarrollar microalbuminuria y el control de la presión arterial es más efectivo que el control glicémico para evitar la progresión de la microalbuminuria. Todas las drogas antihipertensivas son capaces de enlentecer la progresión de la insuficiencia renal, pero las de elección son los inhibidores de la enzima convertidora de angiotensina (IECA) y los antagonistas de los receptores de angiotensina II (ARAII), por sus efectos hemodinámicos específicos y su acción sobre el sistema renina-angiotensina (SRA), que tiene un importante rol en el desarrollo de la nefropatía diabética. Los IECA y los ARAII pueden atenuar la glomeruloesclerosis progresiva y retardar el desarrollo de la enfermedad renal y sus efectos más importantes son: reducen la presión arterial, la presión intraglomerular y la micro y macroproteinuria; inhiben los efectos no hemodinámicos de la angiotensina II, entre ellos la proliferación, hipertrofia y expansión de la matriz mesangial; e inhiben la síntesis de citoquinas y factores de crecimiento. La espironolactona también tiene un rol en el bloqueo de este sistema a nivel de la aldosterona.
En la terapia nutricional se debe considerar: aporte calórico adecuado, considerando los hábitos de alimentación del paciente para mejorar su adherencia; reducción de las grasas saturadas y el colesterol, ya que estos no sólo aumentan el riesgo cardiovascular, sino que también aceleran el daño renal; restricción proteica de 0,8 a 1 g/kg/día, hasta que la nefropatía incipiente retrase la tasa de declinación de la filtración glomerular; con nefropatía clínica la restricción es de 0,8 g/kg/día; restricción del consumo de sodio.
En el tratamiento de estos pacientes la Aspirina® es fundamental, ya que previene eventos cardiovasculares; en casos de alergia o resistencia a este medicamento se puede utilizar otros antiagregantes plaquetarios.

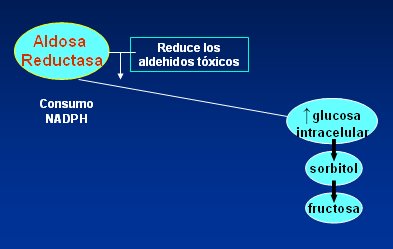 Figura 1. Vía del poliol.
Figura 1. Vía del poliol.

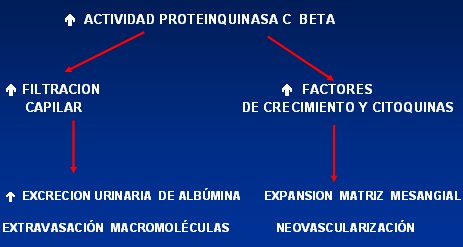 Figura 2. Mecanismo de daño de la hiperglicemia a través del incremento de la PKC.
Figura 2. Mecanismo de daño de la hiperglicemia a través del incremento de la PKC.

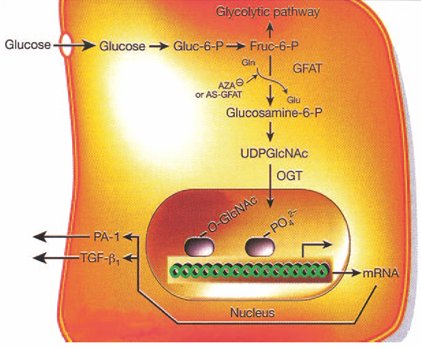 Figura 3. Vía de la hexosamina.
Figura 3. Vía de la hexosamina.

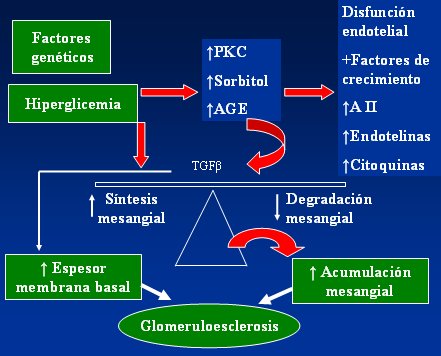 Figura 4. Mecanismo de daño renal por la hiperglicemia.
Figura 4. Mecanismo de daño renal por la hiperglicemia.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de una conferencia dictada en el Curso de Educación Continua Actualización en Medicina Interna 2009, organizado por el Departamento de Medicina del Hospital Clínico de la Universidad de Chile y realizado entre el 29 de mayo y el 26 de septiembre de 2009. Su directora es la Dra. María Eugenia Sanhueza.
 Autora:
María Gabriela Sanzana[1]
Autora:
María Gabriela Sanzana[1]

Citación: Sanzana MG. Chronic complications of diabetes mellitus: pathophysiology, diabetic nephropathy. Medwave 2009 Oct;9(10):e4214 doi: 10.5867/medwave.2009.10.4214
Fecha de publicación: 1/10/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión