 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto corresponde a un trabajo de revisión preparado por su autor en el desarrollo del Curso y Seminarios de Oncología Básica, realizado por el Centro de Oncología Preventiva y la Escuela de Postgrado de la Facultad de Medicina de la Universidad de Chile entre abril y agosto de 2008. El Director del Curso es el Dr. José Manuel Ojeda.
Hace treinta años el cáncer no era una causa de mortalidad tan relevante en la población; sin embargo, el aumento de los factores de riesgo a través del tiempo hizo que esta patología aumentara su frecuencia rápidamente, al punto que en la actualidad se la considera como una de las principales causas de muerte, superada solamente por las enfermedades cardiovasculares. En Chile las neoplasias representan la segunda causa de muerte (24,8%) y se cree que en el futuro será la primera causa en la mayoría de los países desarrollados (1).
A pesar de los adelantos en las últimas décadas en el campo de la oncología, existe una diversidad de neoplasias con tendencias de mortalidad variable. El cáncer de páncreas tiene una tasa de mortalidad estable, pero ocupa el primer lugar entre las neoplasias en cuanto a índice de gravedad (99%). Esta patología se caracteriza por un diagnóstico generalmente tardío y una supervivencia no superior a 20%. Si bien la biopsia pancreática es por excelencia uno de los mejores procedimientos en el diagnóstico del cáncer de páncreas, también es posible realizar un diagnóstico orientativo y menos invasivo a través de una serie de pruebas de laboratorio, permitiendo iniciar un tratamiento en el menor tiempo posible; entre estos exámenes se encuentran los marcadores tumorales como CA19-9, CA242 y CEA, entre otros; sin embargo estas determinaciones presentan diferencias considerables en cuanto a sensibilidad y especificidad, lo que sin duda va en desmedro de un diagnóstico temprano. Es por ello que hoy en día se está aplicando la Biología Molecular a la búsqueda de nuevos marcadores que permitan diagnosticar esta patología a tiempo.
El cáncer de páncreas es una patología menos común que otros carcinomas, como los de pulmón, mama, estómago, hígado y próstata; sin embargo posee una alta tasa de mortalidad, figurando como la octava causa de muerte por cáncer en el mundo. En Estados Unidos e Inglaterra es la sexta causa de muerte por cáncer y la incidencia es mucho más alta en los países orientales como China. En Chile la realidad no dista mucho de la mundial: el cáncer es la segunda causa de muerte y el cáncer de páncreas es la octava causa de muerte por cáncer, tanto en hombres como en mujeres.
Los factores de riesgo de cáncer de páncreas son:
En la actualidad existe una serie de exámenes que permiten diagnosticar y confirmar la presencia de un carcinoma pancreático. Entre ellos están los marcadores séricos, las biopsias y el estudio de imágenes.
La detección de marcadores tumorales séricos es una manera muy efectiva y no invasiva de diagnosticar cáncer de páncreas, pero lamentablemente no todos tienen un rendimiento adecuado, ya que muchos poseen sensibilidad y especificidad demasiado bajas. Muchos autores han realizado investigaciones sobre la combinación de una serie de marcadores tumorales con el objetivo de lograr mayor especificidad, sacrificando la sensibilidad.
Antígeno carcinoembrionario (CEA): El CEA es un grupo heterogéneo de glicoproteínas que se califica como un marcador tumoral de amplio uso clínico, aunque hasta el momento se desconoce cuál es su función específica. Ni realizó un estudio en el que se observó el rol diagnóstico de distintos marcadores tumorales asociados a cáncer de páncreas y se comprobó que el CEA tenía una sensibilidad de 45% y una especificidad de 75% (2). Por otra parte, Goonetilleke demostró que este marcador presentaba una sensibilidad media de 54% y una especificidad media de 79% (3). Con estos valores este marcador se puede considerar como una buena herramienta diagnóstica de carcinoma pancreático en etapa avanzada, pero no como prueba de detección precoz.
CA19-9: Este marcador tumoral es por excelencia uno de los más usados en el diagnóstico de cáncer de páncreas. Es un glicolípido de alto peso molecular derivado de un anticuerpo monoclonal incubado en un ratón que fue inmunizado con una línea celular de colon humano. Goonetilleke reportó una sensibilidad media de 79% y una especificidad media de 82% en el diagnóstico de cáncer pancreático. No obstante, la principal limitación de este marcador es que se puede hallar en niveles altos en pacientes con ictericia obstructiva no asociada a tumores. Ni describió una sensibilidad de 80% y una especificidad de 43%, pero al combinarlo con CEA logró una sensibilidad de 37%, con especificidad de 84%. Además se observó que los valores individuales de CA19-9 son similares en pacientes con carcinoma ampular, por lo que no sería muy útil si quisiéramos diferenciar estas patologías. Googins considera que si bien ha sido ampliamente usado para diagnosticar cáncer pancreático, no es suficientemente sensible e incluso podría no detectar la patología en aquellos tumores pequeños y resecables (4).
CA 242: Es un glicoconjugado que se encuentra elevado en pacientes con cáncer pancreático. Goonetilleke observó una sensibilidad media de 75% y una especificidad media de 90% para esta patología, mientras que Ni reportó una sensibilidad de 60% y una especificidad de 76%. Al combinarlo con CEA aumenta drásticamente su especificidad a 92%, pero disminuyendo su sensibilidad a 30%, por lo que sería bastante ventajoso usar esta combinación para diferenciar el cáncer pancreático de patologías pancreáticas no malignas. Además se ha visto que CA242 podría servir para evaluar pronóstico y tasa de sobrevida, ya que los pacientes con este marcador positivo tienen tasas de sobrevida más cortas que pacientes con el resultado negativo.
Si bien los marcadores tumorales otorgan bastante información diagnóstica en el cáncer pancreático, sus niveles son detectables sólo en etapas avanzadas de la enfermedad. Se ha propuesto modificar los puntos de corte de los valores de referencia, pero esto llevaría a errores en el diagnóstico ya que se podría hallar valores elevados en patologías no malignas.
Biopsia: Es uno de los exámenes más importantes en la confirmación del diagnóstico de cáncer pancreático. Muchos oncólogos recurren a la confirmación histológica para asegurar un tratamiento exitoso. Un estudio realizado por Amin reveló que la biopsia percutánea posee una sensibilidad de 90% y una especificidad cercana a 100% (5). No obstante, este diagnóstico es invasivo y por ende está asociado a complicaciones en el paciente; se han descrito casos de fiebre, reacciones vasovagales, hematoma peripancreático, pancreatitis, abcesos, perforación duodenal y sangrado retroperitoneal, aunque todos con manejo médico satisfactorio.
Estudio por imágenes: Existen numerosos exámenes que permiten investigar un cáncer pancreático a través del análisis de imágenes: ultrasonografía, tomografía computada, resonancia magnética y, últimamente, la tomografía por emisión de positrones y la colangiopancreatografía endoscópica retrógrada. Todas estas técnicas tienen un amplio valor diagnóstico, ya que permiten observar tumores muy pequeños, no son invasivas, presentan valores de sensibilidad y especificidad razonables y en muchos casos guían al clínico en el momento de realizar una biopsia percutánea pancreática. Amin considera que la tomografía computada tiene un valor predictivo positivo de 98% y una especificidad cercana a 95% para diagnosticar adenocarcinoma pancreático. No obstante, la habilidad diagnóstica es dependiente de la presencia o ausencia de una masa pancreática.
Debido a que las herramientas diagnósticas actuales poseen muchas desventajas y no logran detectar la enfermedad en una etapa pre-neoplásica, es necesario desarrollar una serie de pruebas que logren una detección temprana del cáncer de páncreas. Es por ello que en los últimos años muchos investigadores se han centrado en comprender la biología del cáncer pancreático a través del estudio de los genes involucrados y su expresión. Los primeros estudios lograron poner en evidencia ciertas lesiones precursoras bien definidas que se presentaban a nivel intraductal y que se denominaron neoplasias intraepiteliales pancreáticas (PanIN). Considerando esto se pudo categorizar el progreso de las lesiones como PanIN-1, PanIN-2 y PanIN-3, en donde cada estado va acompañado de un cambio en la arquitectura epitelial, así como de alteraciones genéticas asociadas a cáncer. En la Fig. 1 se muestra un esquema de progresión de las neoplasias intraepiteliales pancreáticas (Pan-IN) y su asociación genética, tomado de Oliveira-Cunha y colaboradores (6).
Es así como se ha identificado una serie de genes involucrados en el carcinoma pancreático, que se analizarán a continuación.
K-ras: Es el gen más estudiado y que se ha vinculado con bastante propiedad al carcinoma pancreático. Se ubica en brazo corto del cromosoma 12 y pertenece a la familia de los genes p21-ras que codifican una proteína esencial para la señalización intracelular, tal como se muestra en la siguiente ilustración, tomada de Hezel y colaboradores (7) (Fig.2).
Este oncogen se ve envuelto en una mutación puntual que afecta generalmente a los codones 12, 13 y 61, terminando por activar el gen. La mutación de K-ras resulta en una ganancia de función que favorece la proliferación, el remodelamiento del citoesqueleto, la inhibición de apoptosis y la sobrevida celular. Esta mutación se encuentra en 90 a 95% de los pacientes con adenocarcinoma ductal pancreático. Este oncogen ha sido ampliamente investigado para determinar su utilidad como marcador de carcinoma pancreático, ya que sólo el codón 12 está mayoritariamente involucrado, pero no se ha logrado éxito debido a que éste también se encuentra en personas fumadoras, con pancreatitis crónica y neoplasias no pancreáticas tipo in-situ. En un principio esto desestimó el valor diagnóstico de este encogen; no obstante, han surgido nuevas tecnologías que permitirían ya no detectar, sino cuantificar los niveles de K-ras mutante en jugo pancreático, lo que le daría una nueva oportunidad a la utilidad diagnóstica de este gen. Berthelemy y sus colaboradores determinaron la importancia clínica de las mutaciones del gen K-ras, que se pueden detectar con un año de anterioridad a un cáncer pancreático en secreciones pancreáticas con células (8). Con estos antecedentes, se considera a las mutaciones en el gen K-ras como un requisito para el desarrollo de una carcinogénesis pancreática. En adición a esto, la señalización de ras aparece como un evento primordial para la mantención del cáncer pancreático como tal.
Gen TP53: Es un gen supresor de tumores ubicado en el brazo corto del cromosoma 17. Se ha observado que está presente en 43 a 76% de los pacientes con adenocarcinoma pancreático. Una de las principales funciones de este gen es controlar el ciclo celular en la fase G1-S. Además modula la respuesta celular ante estrés citotóxico, ya que contribuye a la detención del ciclo celular y favorece la apoptosis. Cuando ocurre una mutación de este gen se produce crecimiento celular inapropiado y aumenta la sobrevida celular. La mutación generalmente ocurre relativamente tarde, cuando el cáncer pancreático ya se ha hecho invasivo. Además se ve asociado a otros tipos de cáncer y por ello ha sido ampliamente investigado. Es un potencial marcador en el diagnóstico de cáncer de páncreas, pero es necesario que aumenten las tecnologías para facilitar la detección de esta mutación, y en baja concentración.
Gen p16: Es un gen que se encuentra en el brazo corto del cromosoma 9. La proteína es un inhibidor de la kinasa dependiente de ciclina (CDK) que se une a CDK4 y CDK6 y previene su asociación con ciclinas tipo D. Se ha visto que la inactivación de este gen ocurre aproximadamente en 90% de los carcinomas de páncreas, ocurriendo a través de deleción homocigota, mutación intragénica con pérdida del segundo alelo y silenciamiento epigenético por mutilación del promotor.
HER-2/neu: Her-2 (erbB-2) es una tirosina kinasa que se ubica en la transmembrana y se asocia a la familia de los receptores de EGF. El gen de estos receptores se encuentra en el brazo corto del cromosoma 7. El receptor de EGF es codificado por el proto-oncogen c-erbB-1, en donde normalmente se expresa C-ERBB-1 en los islotes de Langerhans. Este se ve sobreexpresado hasta en 85% de los adenocarcinomas ductales, debido a un aumento en la transcripción. Favorece la activación de vías downstream, que favorecen la proliferación celular, la angiogénesis, el desarrollo de metástasis y la mayor sobrevida celular.
SMAD4/DPC4: Es un gen supresor de tumores que se ubica en el brazo largo del cromosoma 18. Tiene bastante homología con la familia de la proteínas mad y se ha visto que está involucrado en la transducción de la señal a través del factor de crecimiento transformante beta (TGF-β). La inactivación de este gen se encuentra en alrededor de 55% de los pacientes con carcinoma pancreático. Este gen codifica una proteína que participa en la transcripción génica y en la detención del ciclo celular, por lo que las células se vuelven resistentes a los efectos inhibitorios de TGF-β. La inactivación de DPC4/SMAD4 se observa sólo en lesiones de tipo PanIN-3 y es raro que ocurra en neoplasias no ductales de páncreas o tumores malignos extrapancreáticos. (DPC es la sigla en inglés de deleted in pancreatic carcinoma), por lo que su uso como marcador diagnóstico es bastante probable.
BRCA1 y BRCA2: Son genes supresores de tumores encargados de la regulación transcripcional de la expresión génica, así como del reconocimiento y reparación del DNA dañado. Estos genes se ven involucrados en etapas avanzadas de lesiones pancreáticas intraepiteliales.
Actividad de telomerasa: Es bastante específica y común en pacientes con cáncer. Uehara realizó un estudio donde midió la actividad de la telomerasa y pudo comprobar que pacientes normales y con pancreatitis no presentaban una actividad tan evidente como la de pacientes con carcinoma pancreático (9).
Pero no sólo se ha investigado en el campo de la genómica, sino que también en el de la proteómica. Yu comparó el suero de pacientes con cáncer de páncreas y el suero de pacientes normales y halló al menos 56 proteínas que estaban incrementadas en el suero de los pacientes con malignidad (10). Por su parte, Sun y sus colaboradores identificaron dos proteínas que pueden actuar como potenciales marcadores en el carcinoma pancreático (11).
GDI2: GDI o inhibidores de la disociación de GDP son proteínas que regulan la reacción de intercambio entre GDP y GTP de miembros de la familia rab, que están envueltas en el tráfico de moléculas entre organelos celulares. A través de inmunohistoquímica se observó una expresión positiva de células con adenocarcinoma pancreático junto con células epiteliales benignas adyacentes, no así en tejidos pancreáticos normales.
Ciclina I: Se sabe que las ciclinas poseen un rol en el ciclo celular, favoreciendo la progresión y la proliferación. Con base en esto se ha observado que una desrregulación de la degradación de la ciclina I se asociada a un ciclo celular aberrante y/o resistencia a la apoptosis, lo cual es muy propio de los tumores invasivos. También se ha encontrado una asociación con el factor de crecimiento VEGF. Esto indicaría que la ciclina I estaría asociada de alguna forma al proceso de angiogénesis. Al realizar técnicas de inmunohistoquímica y electroforesis bidimensional se observó que la ciclina I está presente en los tejidos con cáncer pancreático.
En los últimos años se ha visto una asociación entre factores de crecimiento y el desarrollo de cáncer de páncreas.
FGF (Fibroblast growth factor): El factor de crecimiento fibroblástico aparece involucrado en los procesos de mitogénesis y angiogénesis del carcinoma pancreático. Además se han detectado numerosos receptores de FGF (FGFR) en muestras de adenocarcinoma pancreático ductal, así como la presencia de glypican-1, un proteoglicano que facilita las interacciones entre ligando y receptor. Al usar dominantes negativos del receptor FGFR-1 o glypican-1 antisentido se obtiene una inhibición in-vitro del crecimiento de células tumorales de páncreas y la supresión del efecto tumorigénico de los xenógrafos.
VEGF (Vascular-endothelial growth factor): El factor de crecimiento endotelial-vascular es uno de los factores más emblemáticos en la carcinogénesis, ya que está vinculado directamente al proceso de angiogénesis debido a que promueve la proliferación de las células endoteliales. Se ha demostrado que el VEGF está sobreexpresado en el carcinoma pancreático, donde su efecto es contrarrestado por medio de receptores solubles, anticuerpos anti-VEGF, quimeras de alta afinidad o ribozimas, ocasionando una fuerte supresión del crecimiento tumorigénico en xenógrafos de cáncer de páncreas.
HGF (Hepatocyte growth factor): HGF y su receptor, Met, regulan la motilidad celular, invasión y proliferación. Si bien el receptor Met se expresa en un bajo nivel en el páncreas exocrino, es objeto de una up-regulation en las lesiones PanIN y en adenocarcinoma pancreático ductal.
EGF (Epidermal growth factor): Se ha observado que la expresión tanto de ligandos como receptores se encuentra elevada en el adenocarcinoma pancreático ductal. Al ser usado como blanco terapéutico, a través de inhibidores del receptor de EGF, existe una disminución del crecimiento celular y de la tumorogénesis in-vitro.
IGF (Insulin-like growth factor): Este factor regula la sobrevida, invasión y angiogénesis de muchas neoplasias humanas. En el caso del carcinoma pancreático existe una elevada expresión de IGF-I, tanto en estroma como en las células tumorales, así como una activación aberrante de su receptor, IGF-IR. Al aplicar anticuerpos anti-IGF-IR se inhibe el crecimiento de xenógrafos y las células tumorales son más sensibles a la quimioterapia.
Recientemente se ha investigado un nexo entre la biología del desarrollo y el cáncer de páncreas a través de dos vías de señalización: Hedgehog y Notch.
Hedgehog es una familia de proteínas de señal secretadas en los mamíferos; está conformada por Sonic, Indian y Desert Hedgehog. Durante la embriogénesis estas moléculas cumplen muchas funciones que regulan el crecimiento y el patrón de diversos órganos, incluido el páncreas. Hedgehog actúa regulando negativamente a Patched (Ptc), que a su vez inhibe a Smoothened (Smo); cuando Hedgehog bloquea la acción de Patched, Smoothened es capaz de activar una serie de reguladores transcripcionales asociados a la familia Gli (Fig.3).
Figura 3. Mecanismo de acción de Hedgehog.
La activación anormal de la vía de Hedgehog está implicada tanto en la iniciación de carcinomas pancreáticos como la mantención de las neoplasias en estado avanzado. Sonic Hedgehog está ausente en un páncreas adulto normal, pero se activa cuando comienzan a aparecer las lesiones PanIN, exhibiendo un progreso gradual en las lesiones y carcinomas.
Notch: Es otra molécula de gran importancia durante la embriogénesis, ya que se encarga de la proliferación y destino celular. No obstante, cuando regula de manera anormal es capaz de contribuir a la transformación celular in vitro y al desarrollo de cáncer. La vía de señalización de Notch comprende la unión del ligando al receptor, provocando la proteólisis del receptor. Esto a su vez provoca una translocación nuclear del dominio intracelular de Notch (NICD), que se encarga de mediar la activación transcripcional de los genes tal como se observa en el esquema de la Fig. 4, tomado de Talora (12).
Figura 4. Vía de señalización canónica de Notch.
En el adulto los niveles de Notch son imperceptibles, pero se encargan de mantener un balance entre proliferación celular, diferenciación y apoptosis; cuando este equilibrio se rompe, como en lesiones PanIN y en adenocarcinoma pancreático, los niveles aumentan. Por otra parte, se ha observado una estrecha relación de Notch con Ras, tanto en la embriogénesis como en la tumorogénesis, lo que sugiere ampliar las investigaciones en este tipo de vías y hallar nuevos blancos terapéuticos.

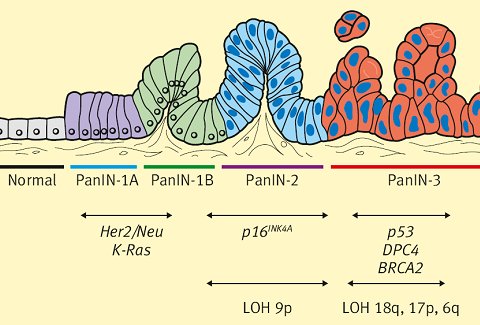 Figura 1. Esquema de progresión de las neoplasias intraepiteliales pancreáticas (Pan-IN) y su asociación genética.
Figura 1. Esquema de progresión de las neoplasias intraepiteliales pancreáticas (Pan-IN) y su asociación genética.

 Figura 2. Vías de señalización de Ras. Las estrellas indican el punto de inhibición de cada una de las cascadas.
Figura 2. Vías de señalización de Ras. Las estrellas indican el punto de inhibición de cada una de las cascadas.

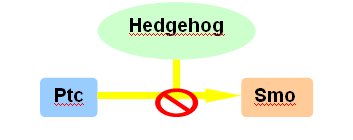 Figura 3. Mecanismo de acción de Hedgehog.
Figura 3. Mecanismo de acción de Hedgehog.

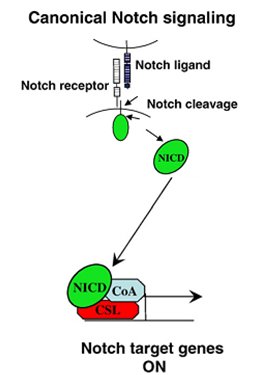 Figura 4. Vía de señalización canónica de Notch.
Figura 4. Vía de señalización canónica de Notch.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto corresponde a un trabajo de revisión preparado por su autor en el desarrollo del Curso y Seminarios de Oncología Básica, realizado por el Centro de Oncología Preventiva y la Escuela de Postgrado de la Facultad de Medicina de la Universidad de Chile entre abril y agosto de 2008. El Director del Curso es el Dr. José Manuel Ojeda.
 Autor:
Carlos Alberto Rosas Chuñil[1]
Autor:
Carlos Alberto Rosas Chuñil[1]

Citación: Rosas CA. Pancreatic cancer: new advances in molecular diagnosis. Medwave 2009 Jun;9(6):e3988 doi: 10.5867/medwave.2009.06.3988
Fecha de publicación: 1/6/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Medina E, Kaempffer AM. Mortalidad por cáncer en Chile: consideraciones epidemiológicas. Rev Med Chil. 2001 Oct;129(10):1195-202. | PubMed |
Medina E, Kaempffer AM. Mortalidad por cáncer en Chile: consideraciones epidemiológicas. Rev Med Chil. 2001 Oct;129(10):1195-202. | PubMed | Ni XG, Bai XF, Mao YL, Shao YF, Wu JX, Shan Y, et al. The clinical value of serum CEA, CA19-9, and CA242 in the diagnosis and prognosis of pancreatic cancer. Eur J Surg Oncol. 2005 Mar;31(2):164-9. | CrossRef | PubMed |
Ni XG, Bai XF, Mao YL, Shao YF, Wu JX, Shan Y, et al. The clinical value of serum CEA, CA19-9, and CA242 in the diagnosis and prognosis of pancreatic cancer. Eur J Surg Oncol. 2005 Mar;31(2):164-9. | CrossRef | PubMed | Goonetilleke KS, Siriwardena AK. Systematic review of carbohydrate antigen (CA 19-9) as a biochemical marker in the diagnosis of pancreatic cancer. Eur J Surg Oncol. 2007 Apr;33(3):266-70. Epub 2006 Nov 9. | CrossRef | PubMed |
Goonetilleke KS, Siriwardena AK. Systematic review of carbohydrate antigen (CA 19-9) as a biochemical marker in the diagnosis of pancreatic cancer. Eur J Surg Oncol. 2007 Apr;33(3):266-70. Epub 2006 Nov 9. | CrossRef | PubMed | Goggins M, Canto M, Hruban R. Can we screen high-risk individuals to detect early pancreatic carcinoma? J Surg Oncol. 2000 Aug;74(4):243-8. | CrossRef | PubMed |
Goggins M, Canto M, Hruban R. Can we screen high-risk individuals to detect early pancreatic carcinoma? J Surg Oncol. 2000 Aug;74(4):243-8. | CrossRef | PubMed | Amin Z, Theis B, Russell RC, House C, Novelli M, Lees WR. Diagnosing pancreatic cancer: the role of percutaneous biopsy and CT. Clin Radiol. 2006 Dec;61(12):996-1002. | CrossRef | PubMed |
Amin Z, Theis B, Russell RC, House C, Novelli M, Lees WR. Diagnosing pancreatic cancer: the role of percutaneous biopsy and CT. Clin Radiol. 2006 Dec;61(12):996-1002. | CrossRef | PubMed | Oliveira-Cunha M, Siriwardena A K, Byers R. Molecular diagnosis in pancreatic cancer. Diagnostic Histopathology. 2008 May;14(5): 214 – 22. | CrossRef | Link |
Oliveira-Cunha M, Siriwardena A K, Byers R. Molecular diagnosis in pancreatic cancer. Diagnostic Histopathology. 2008 May;14(5): 214 – 22. | CrossRef | Link | Hezel AF, Kimmelman AC, Stanger BZ, Bardeesy N, Depinho RA. Genetics and biology of pancreatic ductal adenocarcinoma. Genes Dev. 2006 May 15;20(10):1218-49. | CrossRef | PubMed |
Hezel AF, Kimmelman AC, Stanger BZ, Bardeesy N, Depinho RA. Genetics and biology of pancreatic ductal adenocarcinoma. Genes Dev. 2006 May 15;20(10):1218-49. | CrossRef | PubMed | Berthélemy P, Bouisson M, Escourrou J, Vaysse N, Rumeau JL, Pradayrol L. Identification of K-ras mutations in pancreatic juice in the early diagnosis of pancreatic cancer. Ann Intern Med. 1995 Aug 1;123(3):188-91. | PubMed |
Berthélemy P, Bouisson M, Escourrou J, Vaysse N, Rumeau JL, Pradayrol L. Identification of K-ras mutations in pancreatic juice in the early diagnosis of pancreatic cancer. Ann Intern Med. 1995 Aug 1;123(3):188-91. | PubMed | Uehara H, Nakaizumi A, Tatsuta M, Baba M, Takenaka A, Uedo N, et al. Diagnosis of pancreatic cancer by detecting telomerase activity in pancreatic juice: comparison with K-ras mutations. Am J Gastroenterol. 1999 Sep;94(9):2513-8. | CrossRef | PubMed |
Uehara H, Nakaizumi A, Tatsuta M, Baba M, Takenaka A, Uedo N, et al. Diagnosis of pancreatic cancer by detecting telomerase activity in pancreatic juice: comparison with K-ras mutations. Am J Gastroenterol. 1999 Sep;94(9):2513-8. | CrossRef | PubMed | Yu KH, Rustgi AK, Blair IA. Characterization of proteins in human pancreatic cancer serum using differential gel electrophoresis and tandem mass spectrometry. J Proteome Res. 2005 Sep-Oct;4(5):1742-51. | CrossRef | PubMed |
Yu KH, Rustgi AK, Blair IA. Characterization of proteins in human pancreatic cancer serum using differential gel electrophoresis and tandem mass spectrometry. J Proteome Res. 2005 Sep-Oct;4(5):1742-51. | CrossRef | PubMed | Sun ZL, Zhu Y, Wang FQ, Chen R, Peng T, Fan ZN, et al. Serum proteomic-based analysis of pancreatic carcinoma for the identification of potential cancer biomarkers. Biochim Biophys Acta. 2007 Jun;1774(6):764-71. Epub 2007 Apr 5. | PubMed |
Sun ZL, Zhu Y, Wang FQ, Chen R, Peng T, Fan ZN, et al. Serum proteomic-based analysis of pancreatic carcinoma for the identification of potential cancer biomarkers. Biochim Biophys Acta. 2007 Jun;1774(6):764-71. Epub 2007 Apr 5. | PubMed | Talora C, Campese AF, Bellavia D, Felli MP, Vacca A, Gulino A, et al. Notch signaling and diseases: an evolutionary journey from a simple beginning to complex outcomes. Biochim Biophys Acta. 2008 Sep;1782(9):489-97. Epub 2008 Jun 24. | PubMed |
Talora C, Campese AF, Bellavia D, Felli MP, Vacca A, Gulino A, et al. Notch signaling and diseases: an evolutionary journey from a simple beginning to complex outcomes. Biochim Biophys Acta. 2008 Sep;1782(9):489-97. Epub 2008 Jun 24. | PubMed |