Este texto completo es una transcripción editada de una conferencia dictada en el Curso CEDIP 2007 AUGE Perinatal y Ginecológico, organizado por el Centro de Diagnóstico e Investigaciones Perinatales, Hospital Sótero del Río, Universidad Católica de Chile, durante los días 23, 24 y 25 de Agosto de 2007, cuyos directores fueron los doctores Rogelio González, Ricardo Gómez, Juan Andrés Ortiz e Iván Rojas.
Desde su descubrimiento, en 1981, la expansión del SIDA ha sido tan rápida que en la actualidad se la considera como la principal enfermedad de transmisión sexual (ETS) en el mundo, debido a la magnitud de la morbimortalidad que ocasiona, principalmente en países pobres y subdesarrollados de África. En un primer momento se llamó a esta enfermedad “el cáncer rosa”, porque se presentaba principalmente en pacientes homosexuales; pero, si bien todavía es más frecuente en varones de esta condición, con el tiempo se ha observado un aumento sostenido de las mujeres afectadas y se estima que en el futuro se llegará igualar la proporción de ambos sexos, como ya ha ocurrido en algunos países desarrollados.
El control de la infección por VIH en la mujer se puede analizar desde dos perspectivas: el manejo de la mujer infectada por el VIH y el control de la transmisión vertical de esta infección.
El VIH es un virus RNA provisto de una envoltura de lipopolisacáridos que contiene unas estructuras fundamentales para la infección: las espículas glicoproteicas, que le confieren al virus la capacidad virus para adherirse a las células. Además posee una cubierta proteica interna y un core viral en el que se encuentra el material genético RNA y las enzimas transcriptasas reversas, proteínas muy importantes tanto en la fisiopatología como en el tratamiento de la enfermedad. El virus circula por la sangre y se puede unir a cualquier célula que posea receptores CD4 a través de la glicoproteína 120 (gp120), permitiendo la activación de la gp 41 para permitir el ingreso del core del virus al interior de la célula que va a infectar. Cuando el virus ingresa al interior de la célula se produce la transcriptasa reversa a partir del material genético RNA, para ser transformado en DNA; esto lo hace la transcriptasa reversa y este punto es muy importante, porque es el primer blanco al que se dirigió la terapia anti-retroviral (TAR). Posteriormente este DNA ingresa al núcleo de la célula y se incorpora al material genético de ésta; a partir de ese momento son las propias proteínas de la célula las que permiten la replicación viral; una vez que se producen las hebras de RNA mensajero, el mismo sistema proteico de la célula permite la formación de nuevas proteínas, que son cortadas por proteasas en distintas regiones para formar nuevamente el core viral, el RNA y la transcriptasa reversa. Éste es un segundo punto importante al que se puede dirigir la terapia: la inhibición de las proteasas. Finalmente el virus sale de la célula y sigue infectando a otras células del organismo, con una tasa de replicación de 10^10 a 10^12 nuevas partículas por segundo.
En la Fig. 1 se grafica la evolución natural de la infección VIH-SIDA. Al inicio de la infección la mayoría de los pacientes tiene niveles de linfocitos CD4 normales (1000 a 1500 células/mm3). Una vez que el virus ingresa y se empieza a replicar al interior de las células se produce una caída importante del número de éstas, que en el gráfico llega a 500, pero puede llegar a 0 células, con el consiguiente riesgo de infecciones oportunistas graves. Al mismo tiempo que disminuyen las células CD4 aumenta la carga viral, es decir, la cantidad de virus que circula en la sangre, llegando a valores sobre 100.000 copias/ml. Posteriormente, la acción de la maquinaria inmune del organismo y las características de la patogenia viral interactúan de tal forma que se alcanza un equilibrio que permite que el número de linfocitos CD4 vuelva a aumentar lentamente, a medida que va disminuyendo la carga viral, lo que determina un período de latencia que puede durar entre 6 meses y 12 años, en pacientes conocidos como portadores crónicos. Finalmente llega el momento en que este equilibrio se rompe, los niveles celulares caen y aparecen las infecciones oportunistas, con aumento paralelo de la mortalidad.
Figura 1 Evolución natural de la infección VIH-SIDA.
Se debe tener en cuenta que no es lo mismo un paciente VIH positivo que un paciente con SIDA: 80% de los pacientes son VIH positivo, pero no tienen SIDA, que se define por un nivel de linfocitos CD4 menor de 200/mm3 o bien, por la presencia de enfermedades oportunistas o cánceres que aumentan la mortalidad de estos pacientes. El Programa Conjunto de las Naciones Unidas sobre el VIH/SIDA (ONUSIDA) ha establecido tres categorías de SIDA según diferentes aspectos clínicos y de laboratorio. Las categorías clínicas se dividieron en las letras A, B y C, siendo A el paciente asintomático, B el sintomático no A ni C y C, aquel paciente que tiene infecciones oportunistas que permiten catalogarlo como de alto riesgo. Las categorías de laboratorio se dividen en 1, 2 y 3 según el nivel de linfocitos CD4 en la sangre: es 1 cuando el recuento es mayor de 500/mm3 y 3 cuando es menor de 200/mm3. Se considera SIDA a todo paciente que esté en la categoría 3 y/o en la categoría C, es decir, que sea portador de alguna patología indicadora de SIDA (Tabla I).
Tabla I. Definición de casos de SIDA (ONUSIDA)
Las patologías indicadoras de SIDA son enfermedades complejas: la más importante y conocida es la neumonia por Pneumocystis jiroveci, pero hay muchas otras, como meningitis por criptococo, retinitis por citomegalovirus, sarcoma de Kaposi, toxoplasmosis cerebral, infecciones por Micobacterium avium complex, cáncer cervicouterino invasor y otras más. Dentro de la categoría C se incluye la tuberculosis diseminada, pero no la tuberculosis pulmonar ya que ésta se puede presentar con niveles de linfocitos mayores de 200/mm3 e incluso, mayores de 500, de modo que la presencia de tuberculosis pulmonar no significa que el paciente tenga SIDA. A continuación se menciona las patologías indicadoras de SIDA y la proporción de pacientes en que se presenta cada una de ellas:
Existen cuatro tipos de mecanismos de transmisión del VIH: la vía sexual, la más importante en los países subdesarrollados y en vías de desarrollo, dentro de la cual se considera de mucho mayor riesgo el individuo hombre que mujer, receptivo que insertivo y homo o bisexual, que heterosexual; la transmisión parenteral, que puede ocurrir a través de transfusiones infectadas (lo que actualmente casi no ocurre gracias a las medidas de control) o a través del uso de drogas endovenosas, que constituye la principal vía de infección en países desarrollados como los europeos, donde es mucho más importante que la vía sexual; la transmisión a través de otros fluidos, como leche materna, fluidos genitales y fluidos con sangre, importante en trabajadores de la Salud que sufren accidentes cortopunzantes; y la transmisión vertical, que se analizará con detalle más adelante.
Los tratamientos disponibles actualmente se clasifican en tres grandes grupos: inhibidores de la transcriptasa reversa (ITR), inhibidores de la transcriptasa reversa no nucleósidos (ITRNN) e inhibidores de la protesa (IPr). Los ITR, que inhiben la enzima que permite la síntesis de DNA a partir del RNA viral, pueden ser de tipo nucleótidos o nucleósidos; son semejantes a los ácidos nucleicos y permiten el bloqueo específico del sitio donde se unen éstos a la transcriptasa reversa, deteniendo con ello la transcripción; entre los más conocidos está la zidovudina (AZT), que tiene un papel importante en la prevención de la transmisión vertical de la infección. Los ITRNN se unen a la transcriptasa reversa en un sitio distinto al que utilizan los nucleósidos, provocando un cambio estérico de esta enzima lo que impide la unión de los nuevos nucleótidos; en Chile sólo se utilizan nevirapina y efavirenz. Los IPr inhiben la parte final del proceso, cuando el DNA se transforma en RNA mensajero para que posteriormente, en el complejo de Golgi y en el retículo endoplásmico, se produzcan las proteínas que permitirán el encapsulamiento. Existe un grupo de “otras” drogas como el enfuvirtide, que actúa como inhibidor de la fusión de la gp120 al receptor CD4, impidiendo el ingreso a la célula.
En este momento existen en Chile protocolos con anti-retrovirales que incluyen drogas que bloquean correceptores. Actualmente se recomienda comenzar la TAR con un esquema que contenga dos inhibidores de la transcriptasa reversa de tipo nucleótido, un inhibidor de tipo no nucleótido o un inhibidor de proteasa, según las condiciones del paciente. Las drogas más utilizadas se muestran en la Tabla II.
Tabla II. Tratamientos actuales para el VIH-SIDA.
Las indicaciones de TAR son las siguientes:
Según ONUSIDA, en el mundo existen 39,5 millones de personas que viven con el VIH/SIDA, de las cuales 45% son mujeres; durante el año 2006 se produjeron 4,3 millones de nuevas infecciones; se estima que la prevalencia en adultos (individuos de 15 a 49 años) durante 2006 alcanzó a 1% y el número de defunciones, a 2,8 millones; actualmente la epidemia afecta principalmente a jóvenes (40%), mujeres, que se han incrementado en más de un millón en dos años y a personas bajo el límite de pobreza.
En Latinoamérica, 1,6 millones de personas viven con la enfermedad; durante el año 2006 se produjeron 140.000 nuevas infecciones por el VIH; la prevalencia estimada en esta región, en adultos de 15 a 49 años, es de 0,5%; y en el año 2006 se produjeron 59.000 defunciones a causa del SIDA. En Latinoamérica hay una alta prevalencia en homosexuales y trabajadoras sexuales y se observa un aumento en mujeres y personas en condiciones de pobreza.
En Chile, de acuerdo con datos aportados por CONASIDA, en 2006 hubo 17.054 notificaciones, de las cuales 16% correspondían a mujeres. El total de defunciones en ese año fue 5.043, con 11,2% de mujeres y el incremento anual del VIH, 4%. Actualmente hay una tendencia a la disminución, tanto en número de casos de SIDA como en mortalidad; los casos están dados principalmente por la transmisión homo o bisexual; el crecimiento ha sido similar en hombres y mujeres; y los grupos predominantemente afectados son los adultos jóvenes y las personas de bajo nivel educacional. El análisis de grupos de población seleccionada muestra que, en 2006, la prevalencia en las embarazadas llegó a 0,05%; en trabajadoras sexuales controladas en cuanto a salud sexual, a 0,44% y en consultantes en un policlínico de enfermedades de transmisión sexual, a 1,4%.
En el Servicio de Salud Metropolitano Oriente (SSMO) se ha controlado, hasta el momento, a 1.562 pacientes en el policlínico de VIH, que es el segundo más importante del país en cuanto a número de pacientes, después de la Fundación Arriarán. De esos pacientes, 60% son activos, lo que significa que acuden a control por lo menos tres veces al año; 25% han fallecido; 9% son pasivos y 6% se han trasladado; 40,65% son homo-bisexuales; 42,4% son heterosexuales; 82% son hombres y 18%, mujeres (Fig. 2).
Figura 2. Distribución de los pacientes portadores de VIH en control, según factor de riesgo (SSMO).
En cuanto a los test de screening realizados en embarazadas, en el SSMO se realizaron 16.398 test durante el año 2006; 10.276 se realizaron en la atención primaria de salud; la cobertura alcanzó a 62,64%; 22 de los test del SSMO resultaron positivos y 7 fueron corroborados por el Instituto de Salud Pública (ISP), lo que da una tasa de pacientes embarazadas VIH (+) detectadas por screening de 0,068%.
En Chile, la atención a los portadores del VIH es un compromiso de Salud Pública que está incorporado a las metas de cobertura de Medicina Preventiva del Ministerio de Salud. La ley número 19.966 GES (AUGE) incorporó al VIH/SIDA dentro del primer grupo de enfermedades; dentro de los objetivos sanitarios de la década 2000-2010 se planteó disminuir la tasa de transmisión vertical a 5%; y dentro de las metas del milenio está conocer la verdadera prevalencia del VIH en las embarazadas.
El GES en el VIH asegura:
La Norma de Prevención de la transmisión vertical del VIH se implementó en 2005, con el objetivo de reducir la transmisión vertical a 1% mediante las siguientes medidas: detección universal de la infección VIH en las embarazadas; reducción de la carga viral materna a niveles indetectables o casi indetectables; disminución de la exposición del RN a sangre, secreciones genitales o líquido amniótico; y eliminación de la exposición del niño al VIH a través de la leche materna.
La Ley de Medicina Preventiva, a través del decreto 876 de 2006, garantiza el examen VIH en embarazadas y establece que se debe ofrecer el test de ELISA para VIH a todas las embarazadas en el segundo control del embarazo y si esta oferta es rechazada se debe seguir ofreciendo el examen en los controles posteriores. Asimismo, se debe ofrecer el test rápido de detección de VIH en el momento del parto a todas aquellas mujeres que no se realizaron el test de ELISA durante el embarazo.
Los datos epidemiológicos se basan más bien en cohortes masculinas, de modo que la información sobre la prevalencia de VIH en la mujer no embarazada es escasa, pero al parecer no habría diferencias en manifestaciones oportunistas no ginecológicas; y las infecciones vulvovaginales y las neoplasias son las manifestaciones ginecológicas más frecuentes en la mujer VIH. Por otra parte no habría diferencias en la TAR, excepto en los ITRNN, como la nevirapina, que en la mujer tiene más riesgo de provocar toxicidad hepática y el efavirenz, que tiene un efecto teratogénico, motivo por el cual habría que evitarlo en la mujer en edad fértil.
La candidiasis vulvovaginal es la manifestación inicial más frecuente en la mujer (38%), sin considerar a la neumonía por Pneumocystis jiroveci, que es la principal en la población general de enfermos de SIDA. La infección por virus papiloma es muy frecuente (75%) y hay mayor incidencia de NIE y de lesiones intraepiteliales escamosas, así como de úlceras genitales por sífilis y virus herpes. No hay información clara sobre alteraciones hormonales, pero algunos grupos sostienen que la mujer portadora de VIH tendría mayor riesgo de menopausia precoz.
En la Fig. 3 se muestra el protocolo de manejo de la transmisión vertical de VIH en Chile, que se encuentra en todos los servicios de salud y en todas las unidades de ginecología-obstetricia del país desde 2001. Este protocolo se reevaluó en 2003 y en 2005 apareció la última actualización.
El estudio ACTG 076, de 1994, reportó la eficacia de la administración de AZT durante el embarazo contra la transmisión vertical, que bajó de 25% en el grupo control a 8,3% en el grupo tratado, es decir, se redujo en 67%. Este estudio fue la base para elaborar el protocolo de prevención de la transmisión vertical, de la transmisión por accidentes cortopunzantes y de todas las situaciones de riesgo para adquirir la infección. Este protocolo se implementó en Chile en 1996 y permitió reducir la tasa de transmisión desde 26,4%, que era el porcentaje histórico nacional, a 5,6% global y a 2,6% cuando el protocolo se aplicó completo dos años después.
Se sabe que 35% de la transmisión del VIH se produce durante el embarazo y 65% durante el parto y lactancia (15% durante ésta). Por otra parte, el riesgo de transmisión depende de la carga viral de la madre durante el embarazo y no del recuento de linfocitos CD4. La transmisión se reduce en forma significativa cuando la carga viral es inferior a 1000 copias/ml, que es el objetivo de la prevención con AZT.
Los factores de riesgo para la transmisión vertical son:
Se debe ofrecer el test de ELISA a las embarazadas a partir del segundo control del embarazo, a más tardar en la semana 20 de edad gestacional. El test de ELISA debe incluir consejería pre y post examen y consentimiento informado y escrito, según lo que establece la ley. Se debe efectuar por lo menos un examen durante el embarazo. El test rápido de VIH adquiere importancia en aquellas mujeres que no se controlaron durante el embarazo, llegan sin el examen al trabajo de parto y no es posible realizar en el pre-parto el test de ELISA; también se debe acompañar de consejería y consentimiento informado. Si el resultado es positivo se debe proceder a la confirmación, de acuerdo con el algoritmo del ISP, que parte con una contramuestra, es decir, la muestra inicial más una segunda, a la que se hace inmunofluorescencia; si el resultado es positivo, se debe tomar una segunda muestra para corroborar la identidad del paciente. Es necesario llevar a cabo todos estos pasos para que el paciente ingrese al protocolo de tratamiento de VIH.
Con respecto a la atención del embarazo, la paciente debe tener un control en un policlínico de alto riesgo obstétrico que contemple la pesquisa oportuna de infecciones génitourinarias a través de sedimento de orina más urocultivo a las 14, 24 y 34 semanas de gestación, así como la pesquisa de otras enfermedades de transmisión sexual como herpes genital, sífilis y virus hepatitis B. También se debe establecer una coordinación con centros de atención de pacientes VIH pediátricos y adultos.
La atención del embarazo se realiza según el status, que puede estar dentro de tres grupos principales: embarazadas sin TAR previa y sin requerimiento propio de TAR; embarazadas sin TAR previa y con criterios de inicio de TAR; y mujeres en trabajo de parto sin uso previo de TAR.
En embarazadas sin TAR previa y sin requerimiento propio de TAR, el objetivo es reducir la carga viral materna a menos de 1000 copias/ml en el momento del parto; en lo posible se debe tomar siempre CD4 y carga viral basal antes del inicio de la TAR y repetir la carga viral a las 34 semanas de gestación; si no es posible realizar estas mediciones de todas formas se debe iniciar la terapia, que se basa en dos ITRNN, generalmente Combivir® inicialmente, que se puede cambiar a otro dependiendo de la toxicidad, y un IPr a partir de la semana 24 de gestación. En cuanto al ITRNN, la combinación de AZT más 3TC en coformulación (Combivir®) es el esquema más frecuentemente utilizado y dentro de los IP está el saquinavir reforzado con ritonavir. Las alternativas por toxicidad deben ser evaluadas por el infectólogo.
En junio de 2007 se presentó una contamination alert en pacientes en Europa que sintieron olor a ácido metílico en los comprimidos que estaban recibiendo, a raíz de lo cual ROCHE informó sobre probable contaminación de su medicamento viracept (nelfinavir) con etil-mesilato. Posteriormente se inició el retiro del medicamento del mercado nacional e internacional y se cambió la terapia por otros IP en embarazadas, como lopinavir/ritonavir (Kaletra®), atazanavir (Reyataz®) y, principalmente, saquinavir (Invirase®). Por lo tanto, si se detecta a una embarazada que esté utilizando nelfinavir se le debe suspender, ya el Ministerio de Salud emitió una resolución que señala que esta droga no puede seguir circulando.
En pacientes embarazadas sin TAR previa y con criterios de inicio de TAR la situación es muy parecida a la del grupo anterior: se debe evaluar carga viral y linfocitos CD4 antes de la semana 24 de gestación, pero en general se recomienda diferir la TAR hasta después de las 12 semanas de gestación, por el riesgo de teratogénesis. Se utiliza básicamente el mismo esquema que en el grupo anterior: dos ITRN más un IPr y después del parto se evalúa la terapia a seguir según tolerancia y toxicidad.
En pacientes con TAR en el momento del embarazo, las TAR previas al embarazo deben ser reevaluadas con CD4 y carga viral en el momento del diagnóstico de embarazo, para determinar la eficacia de la TAR; en caso de que ésta sea exitosa, es decir, que la paciente tenga una carga viral inferior a 1000 copias/ml y no signifique ningún riesgo para el feto, se debe reforzar la adherencia a la TAR y mantener el esquema de drogas en uso, excepto el efavirenz. Si la supresión de la carga viral es subóptima, es decir, hay más de 1000 copias/ml, se debe efectuar un estudio de genotipificación para evaluar el tipo de resistencia de la paciente, con el fin de instaurar la mejor terapia para disminuir la carga viral, porque una paciente que está utilizando la TAR adecuadamente no tiene porqué tener cargas virales sobre 1000, por lo que se hace necesario evaluar si existe algún grado de resistencia al tratamiento. En la semana 24 se debe iniciar una TAR efectiva basada en la interpretación del genotipo y la historia de uso de antiretrovirales.
En pacientes en trabajo de parto sin uso previo de TAR, se debe realizar un test rápido para VIH; si resulta positivo se le debe ofrecer TAR durante el parto. En esta situación se indica una dosis de nevirapina y dos semanas de tratamiento con AZT más 3TC coformulados. Hay que considerar que el test rápido no constituye un diagnóstico, por lo que se debe confirmar en el ISP y ofrecer test de ELISA a la paciente posteriormente. En caso de que el test de ELISA sea positivo, se debe derivar a la paciente a un centro de atención VIH después del parto. En la atención del parto, se recomienda efectuar cesárea electiva a las 38 semanas de gestación, aunque no hay evidencia científica suficiente para contraindicar el parto vaginal. La cesárea electiva a las 38 semanas de gestación se debe realizar en las mujeres sin TAR durante el embarazo y en aquéllas con TAR durante el embarazo, pero con una carga viral mayor de 1000 copias/ml a las 34 semanas de gestación. Se debe permitir el parto vaginal, si la condición obstétrica es favorable, en mujeres con trabajo de parto iniciado y carga viral inferior a 1000 copias/ml, evitando maniobras invasivas que favorezcan la transmisión del VIH durante el trabajo de parto y parto mismo, tales como monitoreos invasores, fórceps y episiotomía, en la medida de lo posible.
La TAR durante el parto se basa en el protocolo ACTG 076: se administra una dosis de carga de AZT endovenoso, de 2 mg/kg de peso a pasar en una hora, seguida de una infusión continua de 1 mg/kg/hora hasta el alumbramiento. La administración de AZT se debe iniciar 4 horas antes de la cesárea programada o desde el inicio del trabajo de parto, si éste es vaginal. Si no se dispone de AZT endovenoso, se puede utilizar AZT oral 300 mg o coformulado AZT-3TC al inicio del trabajo ó 4 horas antes de la cesárea y repetir la dosis 3 horas después. Este protocolo es independiente de la TAR recibida durante el embarazo. Por otra parte, se recomienda agregar, en vírgenes de TAR, nevirapina 200 mg por vía oral, porque de lo contrario se estaría dando biterapia, la que puede aumentar la resistencia a la terapia.
El diagnóstico en el recién nacido se realiza en las primeras hora de vida a través de una PCR; si es negativa se debe tomar una segunda muestra entre los 15 y 30 días de vida y una tercera a los 3 meses de edad; si es negativa se hace el diagnóstico de “negativo o no infectado”. Si la primera PCR es positiva, se toma una segunda muestra, si ésta es positiva se modifica la TAR y se toma la tercera muestra para PCR; si ésta es positiva se hace el diagnóstico de “infectado”. De todas maneras se debe tomar una antiginemia y un test de ELISA, pero es la PCR la que dirá si existe traspaso de anticuerpos de la madre al niño, por lo tanto, existen falsos positivos. Este protocolo es conocido por los pediatras y neonatólogos; en general, con dos resultados positivos se considera al recién nacido como infectado.
La TAR en el recién nacido se inicia entre 8 y 12 horas después de nacer y se mantiene durante las primeras seis semanas de vida, con AZT oral; se agrega nevirapina, 1 ó 2 dosis, si la madre no recibió protocolo o recibió esquema que la incluía, para evitar la biterapia. En caso de que se opte por otro esquema, éste deberá ser indicado por el infectólogo pediatra. Otro aspecto importante es que la lactancia materna se debe suspender siempre; la ley de VIH/SIDA establece la entrega de sucedáneos de la leche materna. Se debe derivar al niño al pediatra infectólogo para el control posterior.

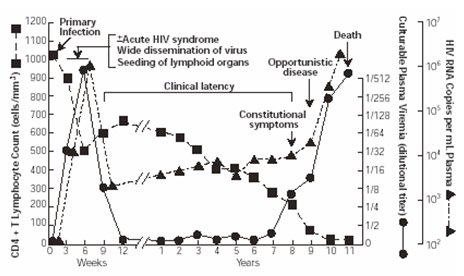 Figura 1 Evolución natural de la infección VIH-SIDA.
Figura 1 Evolución natural de la infección VIH-SIDA.

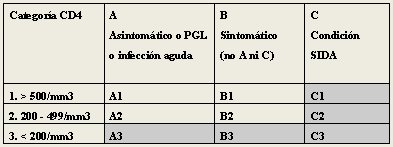 Tabla I. Definición de casos de SIDA (ONUSIDA)
Tabla I. Definición de casos de SIDA (ONUSIDA)

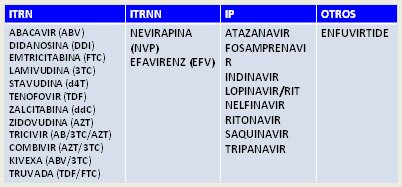 Tabla II. Tratamientos actuales para el VIH-SIDA.
Tabla II. Tratamientos actuales para el VIH-SIDA.

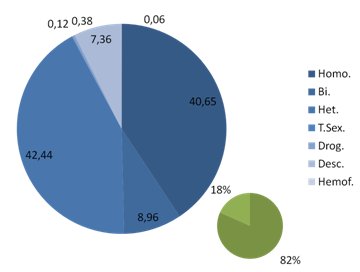 Figura 2. Distribución de los pacientes portadores de VIH en control, según factor de riesgo (SSMO).
Figura 2. Distribución de los pacientes portadores de VIH en control, según factor de riesgo (SSMO).

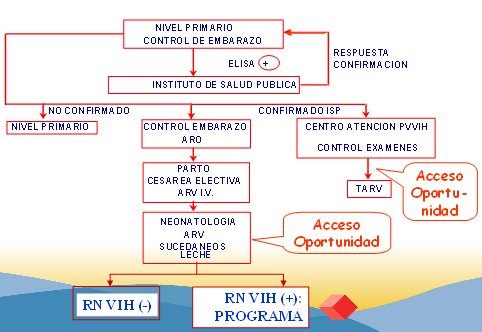 Figura 3.
Figura 3.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada de una conferencia dictada en el Curso CEDIP 2007 AUGE Perinatal y Ginecológico, organizado por el Centro de Diagnóstico e Investigaciones Perinatales, Hospital Sótero del Río, Universidad Católica de Chile, durante los días 23, 24 y 25 de Agosto de 2007, cuyos directores fueron los doctores Rogelio González, Ricardo Gómez, Juan Andrés Ortiz e Iván Rojas.
 Expositor:
Michel Serri V.[1]
Expositor:
Michel Serri V.[1]

Citación: Serri M. Women carriers of HIV-AIDS. Medwave 2008 Oct;8(9):e1712 doi: 10.5867/medwave.2008.09.1712
Fecha de publicación: 1/10/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión