Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del I Congreso Chileno de Medicina Nuclear, realizado en Santiago entre los días 4 al 6 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Comité Organizador
Prof. Dr. Patricio González (Presidente).
Dra. Teresa Massardo.
Dr. Juan Carlos Quintana.
Prof. Dr. Ismael Mena.
Edición Científica: Dra. Teresa Massardo.
La Tomografía de Emisión de Positrones (PET) puede utilizar diversos metabolitos marcados con emisores de positrones, lo cual permite efectuar imágenes de tipo funcional de gran utilidad, especialmente en oncología clínica.
Las imágenes que acompañan esta exposición pertenecen a nuestra experiencia en el Centro PET de Imágenes Moleculares del Hospital Militar.
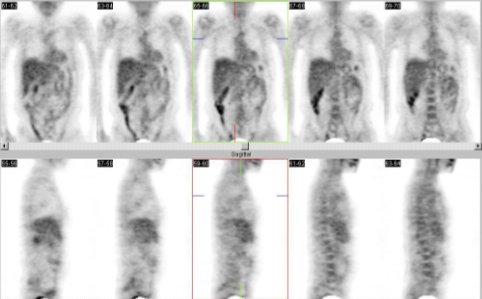
En relación con la preparación del estudio, el paciente debe tener por lo menos seis horas de ayuno; en el caso de pacientes diabéticos, si están en tratamiento con insulina, se continúa con el manejo habitual. La mayoría de los centros, incluso el nuestro, controlan la glicemia antes de la inyección. Se inyecta flúor 18 fluordeoxiglucosa por vía endovenosa, en dosis de 10 a 15 milicurie (mCi). Las imágenes se adquieren a los 45 a 60 minutos después de la inyección y durante este lapso el paciente debe permanecer en reposo. Se adquieren imágenes de cuerpo entero que, en general, van de cabeza a pelvis y abarcan las extremidades inferiores en el caso del melanoma maligno. La duración de estas imágenes oscila entre 60 y 75 minutos. El procesamiento es el habitual, con cortes coronales, sagitales, transaxiales e imágenes tridimensionales que se pueden revisar en cine (véase Figura 1).
Figura 1.
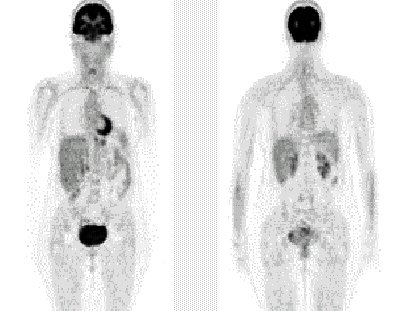
En la distribución habitual del F18-FDG (fluordeoxiglucosa), la mayor concentración se encuentra en el cerebro y corazón, con eliminación vía renal y vejiga, con actividad intestinal variable. En la figura 2 se puede observar dos cortes coronales.
Figura 2. Distribución normal FDGF-18.
Medicare, que es el sistema de reembolso de salud de los Estados Unidos, ha aprobado el estudio con PET de varios tipos de cáncer: cáncer pulmonar, incluso nódulo pulmonar solitario; cáncer esofágico; cáncer colorrectal; cáncer de mama; melanoma; linfoma; cáncer de cabeza y cuello; y cáncer de tiroides. Además, hay experiencia en otros tipos de tumores que aún no están aprobados por Medicare, pero que están en evaluación; de ellos no se tratará en esta exposición.
Entre las lesiones pulmonares, Medicare sólo cubre: (1) el diagnóstico diferencial del nódulo pulmonar solitario, para determinar si es benigno o maligno; y (2) la estadificación, pesquisa, recurrencia y evaluación de terapia en cáncer pulmonar de células no pequeñas. Aunque es posible evaluar el carcinoma de células pequeñas, todavía no está aprobado. También se realiza la búsqueda del tumor primario, en caso de metástasis pulmonares.
Nódulo pulmonar solitario: En un metaanálisis de Rohren EM y Lowe VJ (Semin Nucl Med 2004; 34: 134) se concluyó que el PET tiene una sensibilidad de 95% en el diagnóstico de nódulo pulmonar solitario, con una especificidad de 80%. Los falsos positivos corresponden a infecciones, sobre todo enfermedad granulomatosa, y los falsos negativos, a nódulos menores de 1 cm o a cáncer bronquioloalveolar o carcinoide. Es importante destacar que, en este metaanálisis, más de 14% de los pacientes presentaron, además, enfermedad tumoral extratorácica que no se sospechó en un principio.
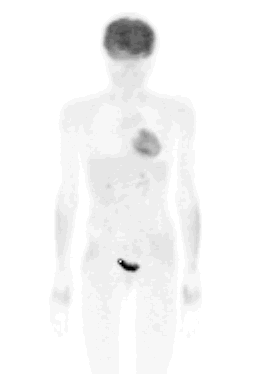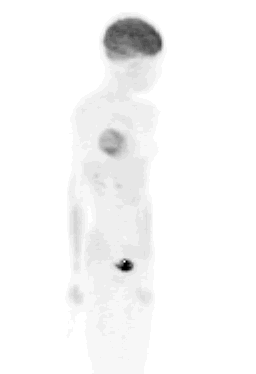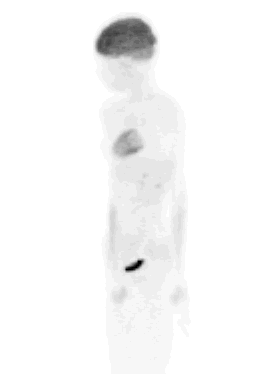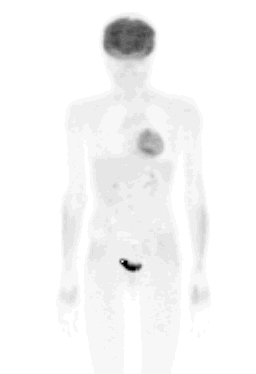
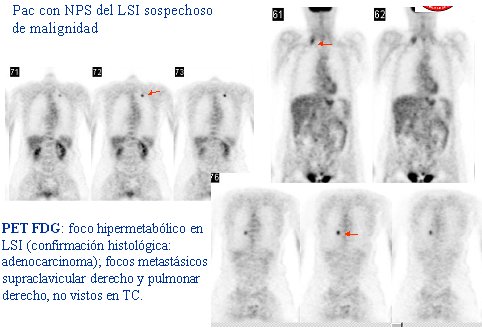
En la figura 3 se presenta una imagen que corresponde a una paciente derivada a nuestro centro por un nódulo pulmonar solitario del lóbulo superior izquierdo, sospechoso de malignidad. El nódulo capta el FDG, por lo tanto es maligno; pero además se encontró una lesión en la región supraclavicular derecha y otro nódulo en el pulmón derecho, que no se veían en la tomografía axial computada (TC). Con posterioridad, la paciente fue sometida a cirugía del nódulo pulmonar izquierdo y se confirmó la presencia de un adenocarcinoma.
Figura 3.
Cáncer pulmonar de células no pequeñas: El PET se ha utilizado para etapificar a estos pacientes, lo que ha significado cambios de etapa hasta en 61% de los pacientes. Permite etapificar mejor el mediastino, con una sensibilidad de 85% y una especificidad cercana a 90%; ambas son superiores a la TC y permiten evitar las mediastinoscopías, que son procedimientos invasivos. Respecto a la evaluación de recurrencia, la sensibilidad es muy alta, cercana a 97%, con especificidades variables, que pueden alcanzar hasta 100%.
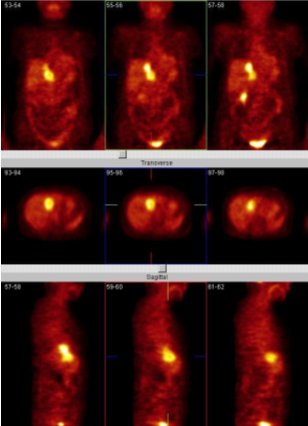
El equipo nuestro, si bien no cuenta con una TC asociada, tiene el software de fusión de imágenes. Las imágenes de TC y del PET, de un mismo paciente, se pueden fusionar y así permiten evaluar mejor las lesiones. En un paciente con una masa pulmonar posterobasal izquierda, la que se confirmó después como un adenocarcinoma, se puede observar que el volumen de captación del FDG es mayor que el de la masa vista en la TC (Figura 4). Esto es muy importante para los radioterapeutas cuando quieren planificar la radioterapia, porque permite irradiar sólo el volumen tumoral, sin afectar el tejido sano.
Figura 4. Cáncer pulmonar: etapificación. Paciente con cáncer pulmonar indiferenciado, diseminado.
Las indicaciones pueden ser múltiples: diagnóstico; estadificación; evaluación de recurrencia o reestadificación; evaluación de lesiones hepáticas o pulmonares metastásicas potencialmente resecables; cuando son únicas; evaluación de marcador tumoral antígeno carcinoembrionario (CEA) elevado, sin causa conocida; distinguir entre un cáncer y una cicatriz, especialmente en masas presacrales después de cirugía o radioterapia, porque se altera la anatomía y las imágenes anatómicas no sirven mucho para diferenciarlos; y, por último, seguir la respuesta al tratamiento.
En relación con la elevación del CEA, con imágenes anatómicas negativas, el PET ha demostrado sensibilidades que van de 93% a 100% y ha significado cambios de conducta, en metaanálisis de más de 500 pacientes, hasta en 36%. Los falsos positivos también se pueden deber a procesos inflamatorios y los falsos negativos, a tumores menores de 1 cm, cuando hay además lesiones necróticas cuyo anillo viable es delgado. Es importante destacar que la sensibilidad de los tumores mucinosos es mucho menor que la de los tumores no mucinosos, debido a la hipocelularidad relativa.
La figura 5 corresponde a la imagen de una paciente de 70 años, con un cáncer de recto operado en 2000, tratado con quimioterapia, que en la actualidad había presentado elevación del CEA. En la resonancia magnética (RM) se observaba una lesión hepática de 15 mm, que en un control había mostrado cierta regresión, pero el clínico no quedó conforme con este examen y solicitó un PET, en el que se aprecian dos masas confluentes en hígado, de intensa captación, que correspondían a metástasis hepáticas.
Figura 5. Paciente 70 años con cáncer de recto operado en 2000 y QT; elevación CEA.
Las indicaciones de PET son estadificación, por la posible diseminación del tumor, y evaluación de las recurrencias. La sensibilidad y especificidad descritas en la estadificación de los ganglios linfáticos son de 78% y 93%, respectivamente, valores superiores a los de la TC.
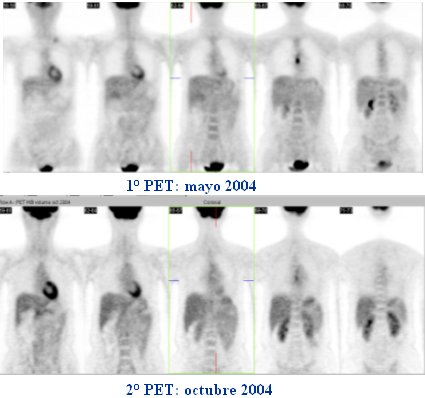
En la figura 6 se presenta el caso de una paciente de 38 años, con un cáncer esofágico in situ, de tercio medio, con una metástasis supraclavicular izquierda (de la cual se había tomado biopsia). Hay captación del FDG en el foco primario y además hay una metástasis supraclavicular izquierda; el estudio se realizó en mayo de 2004. La paciente fue sometida a quimioterapia preoperatoria y se hizo un segundo PET para ver si era posible una resección quirúrgica. Se observa regresión total de la lesión supraclavicular izquierda y parcial de la ubicada en esófago, pero en la actualidad la lesión presenta significativa menor intensidad.
Figura 6. Paciente mujer de 38 años con cáncer esofágico in situ y metástasis supraclavicular izquierda.
El PET está indicado para la detección de tumor primario, con sensibilidad y especificidad entre 80% y 100%. Las indicaciones principales son: mamas densas, en mujeres jóvenes, mamoplastías, implantes, biopsias o cirugías previas que alteran la anatomía, mamografía dudosa o enfermedad fibroquística. Los falsos negativos, como en otros casos, también pueden estar dados por lesiones menores de 1 cm o cuando existen tumores bien diferenciados (carcinoma lobular, carcinoma in situ); los falsos positivos se producen por procesos inflamatorios, biopsias o cirugías recientes.
En relación con la estadificación con PET para el cáncer de mama, permite identificar el compromiso axilar, pero no determina el número de ganglios, lo que es un factor pronóstico importante para los clínicos. Identifica las lesiones a distancia, que a veces no son sospechadas por otras técnicas y, asimismo, permite ver cuando existe compromiso de la mamaria interna.
Respecto a la detección de recurrencias, la sensibilidad es mayor de 90%, con especificidad cercana a 80%, el PET es superior para las metástasis osteolíticas y el cintigrama óseo es mejor para las lesiones osteoblásticas. En el control del tratamiento, el PET permite identificar a los pacientes que van a responder a quimioterapia; ya sea desde el primer ciclo o al término de la quimioterapia, se puede evaluar cuál fue la respuesta.
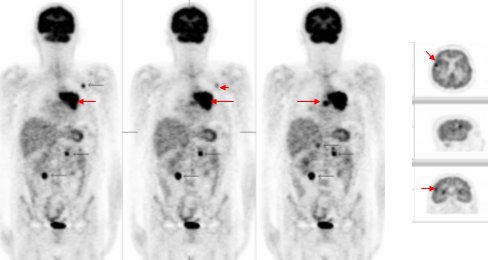
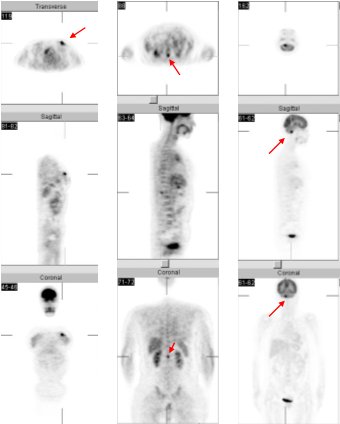
La imagen de la figura 7 corresponde a una paciente con cáncer de mama, a quien se había realizado una tumorectomía y que en la actualidad presentaba una lesión visible en la mamografía, en relación con la cicatriz quirúrgica. Se observa captación del FDG en el foco en la mama izquierda, en relación con la lesión de la mamografía y que corresponde a una recidiva local. Además, se encontró una lesión en columna dorsal, en la región posterior de D 10 y otra a nivel del cerebelo.
En la misma paciente, ya sometida a una mastectomía radical, se observa la desaparición del foco de la mama. Las otras lesiones se habían confirmado antes con RM y el médico determinó tratarlas con radioterapia, a nivel de la columna dorsal y del cerebelo. La lesión de la columna dorsal presenta marcadamente menos intensidad de captación; es decir, hay una respuesta significativa, pero no hay respuesta a nivel del cerebelo.
Figura 7. Paciente con cáncer de mama izquierda, lesión en cicatiz quirúrgica.
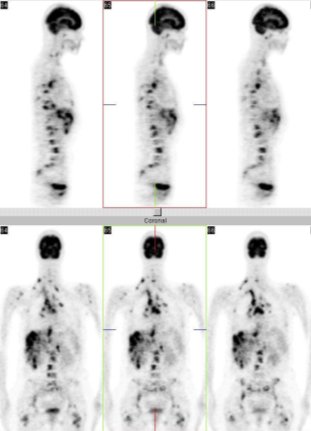
Una paciente de 36 años fue enviada para reetapificación, con diagnóstico de cáncer de mama derecha, que había debutado con metástasis (Figura 8). En abril de 2003 tenía todos sus controles de imágenes habituales negativos. En agosto la paciente presentó adenopatía cervical derecha y el médico tratante le recomendó hacerse un PET, pero sólo llegó a nuestro servicio en octubre. Hay diseminación metastásica extensa, con lesiones en mediastino, cervicales, axilares, en hígado, muchas de ellas confluentes, en toda la columna, pelvis, fémures, etc. La paciente falleció en diciembre.
Figura 8. Cáncer de mama: reetapificación.
Las indicaciones son: etapificación; reetapificación; evaluación de la respuesta al tratamiento, también desde el primer ciclo de la quimioterapia, para determinar si es un paciente respondedor o no, o si va a haber que cambiar de esquema; y evaluación de recurrencias de masas residuales. En un estudio publicado en 2000 de Jerusalem G y cols (Haematologica 2000;85:613) de pacientes con linfoma no Hodgkin (LNH), hay una correlación entre el resultado del PET al final del tercer ciclo de la quimioterapia, y la sobrevida; se destaca que los pacientes con PET positivo al año tienen 20% de sobrevida libre de enfermedad, en relación con 81% de sobrevida que tienen los pacientes con PET negativo. A los dos años, la diferencia es aún mayor: existe 0% de sobrevida libre de enfermedad con PET positivo y 62% con PET negativo, diferencia estadísticamente significativa. Se observa el mismo fenómeno en la sobrevida global.
En una paciente de 44 años (Figura 9), con LNH que ya llevaba cuatro ciclos de quimioterapia, sin PET basal, las TC mostraban masas a nivel retroperitoneal y cervicomediastínico. En la actualidad, después de los cuatro ciclos, en el PET-FDG se observa un foco supraclavicular derecho y algunos pequeños focos a nivel de mediastino, sin focos abdominales. La misma paciente, al terminar la quimioterapia, asistió a un control; se puede ver regresión de los focos del mediastino y supraclavicular derecho, compatible con una respuesta completa al tratamiento (Figura 10).
Figura 9. Paciente de 44 años con LNH en QT (4 ciclos). TC y PET.
Figura 10. Paciente de 44 años con LNH post tratamiento QT. PET: Desaparición de focos supraclavicular derecho y de mediastino, sin nuevos focos.
El PET sirve para etapificación, reetapificación, evaluación del compromiso linfático, recurrencias y respuesta al tratamiento. En un trabajo publicado recientemente de Fuster D y cols (J Nucl Med 2004; 45: 1323), en que se compara el PET con la TC en melanoma recurrente, la exactitud diagnóstica del PET es superior a la de la TC en pulmón, hígado, huesos, ganglios linfáticos y abdomen, aunque en pulmón la TC puede ser más sensible. No hay comparación a nivel cerebral, porque está claro que la TC o la RM tienen mejor rendimiento en cerebro. La sensibilidad del PET en cerebro es cercana a 50 ó 60%, pero el hecho de determinar una lesión ya orienta al médico, así que podría ser útil. El cambio estimado en el manejo es de 36% en los pacientes.
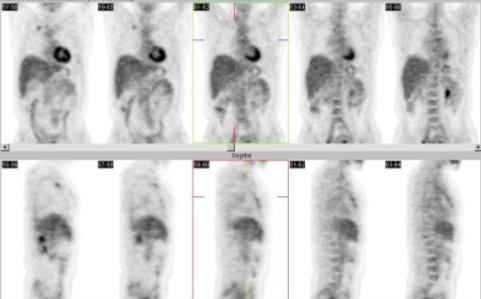
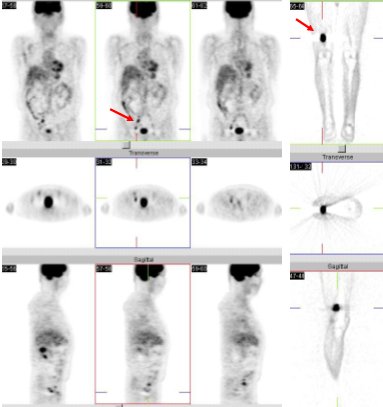
En la figura 11 se muestra el caso de un paciente de 55 años que tenía un melanoma de talón derecho, operado en 2003 y con ganglio centinela poplíteo positivo. Poco tiempo después ya tenía una recidiva del talón. Al realizar el estudio del PET, encontramos focos ilíacos derechos de intensa captación de FDG y una lesión en la región baja del muslo derecho que no se había sospechado.
Figura 11. Paciente de 55 años, melanoma de talón derecho.
En esta indicación se excluye el cáncer de tiroides y los tumores del sistema nervioso central. El PET permite determinar la localización y extensión del tumor primario, la etapificación, evaluar las recurrencias y la respuesta a tratamiento. En una comparación entre el PET, la TC y la RM, la sensibilidad, la especificidad y la seguridad diagnóstica del PET-FDG son superiores.
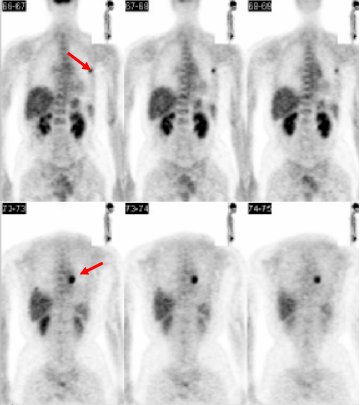
Otro paciente de 75 años con un cáncer de laringe operado en 2002 (Figura 12), presentó una recidiva cervical, por lo que el 2003 fue tratado con cirugía y radioterapia. En la actualidad presentaba un nódulo en el hombro derecho, cuya biopsia fue positiva. Se le tomó una TC de cuello, que sólo describía cambios postratamiento; se le realizó un PET y en las imágenes de cabeza y cuello se observa un área irregular de intenso hipermetabolismo cervical anterior bajo, compatible con recidiva local; en el resto del estudio, el paciente no presentaba otras lesiones.
Figura 12.
El PET está indicado en cáncer diferenciado de tiroides cuando hay rastreos con yodo negativos, pero hay elevación de los niveles de tiroglobulina. Está en estudio la indicación en cáncer medular de tiroides, cuando los rastreos con DMSA pentavalente o MIBG son negativos y hay elevación de los niveles de calcitonina. Es importante recordar que cuando el cáncer de tiroides es muy diferenciado, el yodo es positivo y el FDG negativo, y cuando el cáncer se desdiferencia, el yodo se hace negativo y el FDG positivo en un fenómeno que se llama flip flop.
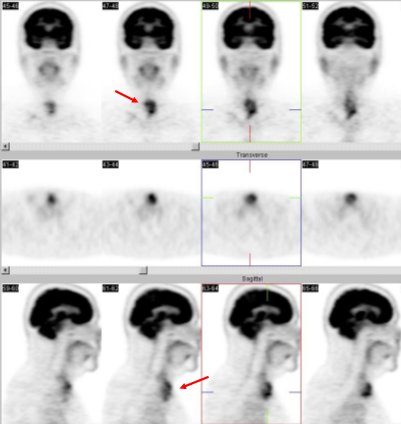
Otra paciente (Figura 13), con cáncer papilar tiroideo, operado en 1968 y tratado con radioyodo, tenía rastreos negativos con tiroglobulina discretamente elevada, pero en la actualidad, tenía anticuerpos antitiroglobulina, lo que no permitía seguir controlando con tiroglobulina. Se le hizo un PET y se observó que en el pulmón izquierdo había dos focos de intensa captación que eran compatibles con metástasis.
Figura 13.
Estos son algunos de los otros cánceres, en los cuales el PET ha demostrado cierta utilidad, si bien aún no los reconoce Medicare. Nosotros también tenemos algunos casos aislados de estos cánceres, en los que hemos tenido un buen rendimiento: Cáncer de cuello uterino, cáncer de páncreas, cáncer testicular, cáncer gástrico, cáncer de endometrio y ovárico, cáncer de vejiga, tumores cerebrales, cáncer hepatocelular, cáncer renal, cáncer de próstata, tumor primario desconocido, tumores musculares y de tejido conectivo (sarcomas).
Medwave. Año 5, No. 5, Edición Junio 2005. Derechos Reservados.













 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del I Congreso Chileno de Medicina Nuclear, realizado en Santiago entre los días 4 al 6 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Comité Organizador
Prof. Dr. Patricio González (Presidente).
Dra. Teresa Massardo.
Dr. Juan Carlos Quintana.
Prof. Dr. Ismael Mena.
Edición Científica: Dra. Teresa Massardo.
 Expositora:
María Josefina Jofré[1]
Expositora:
María Josefina Jofré[1]

Citación: Jofré MJ. Main indications of FDG PET. Medwave 2005 Jun;5(5):e1371 doi: 10.5867/medwave.2005.05.1371
Fecha de publicación: 1/6/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión