Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del I Congreso Chileno de Medicina Nuclear, realizado en Santiago entre los días 4 al 6 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Comité Organizador
Prof. Dr. Patricio González (Presidente).
Dra. Teresa Massardo.
Dr. Juan Carlos Quintana.
Prof. Dr. Ismael Mena.
Edición Científica: Dra. Teresa Massardo.
Las recomendaciones para el tratamiento de TN gastroenteropancreáticos se basan en esta información: se sabe que la eficacia de los protocolos disponibles de quimioterapia es baja para el tratamiento de los TN y, por esta razón, muchos pacientes no reciben tratamiento sistémico hasta que la enfermedad progresa. La experiencia acumulada ha demostrado que los tratamientos con análogos de somatostatina marcados con emisores beta son útiles y no tienen efectos adversos graves, dependiendo del protocolo, por lo que se recomienda usarlos sin esperar progresión de la enfermedad.
Este tratamiento, definido como terapia radiometabólica, tiene como objetivo administrar una dosis de radiación al tumor sin dañar los tejidos sanos, para lo cual es preciso efectuar mediciones en cada paciente por separado, debido a la variabilidad de la expresión de los receptores, entre pacientes y entre diferentes tipos de tumores. También es necesario aplicar modelos de dosimetría, para dar el mejor tratamiento posible.
El problema es que los diferentes análogos tienen distinta afinidad por los diversos subtipos de receptores, de manera que la información que se obtiene con uno no es forzosamente extrapolable a los otros; a pesar de esto, no es concebible administrar una dosis terapéutica de estas sustancias, sin realizar previamente un estudio diagnóstico y dosimétrico. En nuestro medio se dispone de dos tipos de análogos para diagnóstico, que son el Octreoscan (In111DTPA Octreotide) y el Y90DOTATOC.
Se ha visto que el uso terapéutico de estos análogos, en particular el Y90DOTATOC, conlleva riesgo de toxicidad renal irreversible, pero la coinfusión de carga de aminoácidos de carga positiva, en particular arginina y lisina, pueden disminuir la nefrotoxicidad. Se ha tratado de ajustar la dosimetría de manera de no sobrepasar los 27 Gy en riñones, que es el valor empírico que se obtiene de los estudios en radioterapia externa (aunque en realidad no está definida la dosis máxima que pueden recibir los riñones).
Para la protección renal en terapia radiometabólica, se ha utilizado varios esquemas para inhibir la recaptura tubular. Uno de los más eficaces es la mezcla de aminoácidos; por ejemplo, se ha administrado 2 l de solución Hartmann-HEPA al 8%, que contienen 26,4 g de lisina + arginina), en 4 h, partiendo 30 min antes del tratamiento, lo que disminuye la captación renal en 27% (9% a 53%). Los efectos colaterales son náuseas, vómitos e hipofosfatemia transitoria. Si la infusión se prolonga por 10 h, usando 4 l de esa solución, la captación renal disminuye en 18% más.
También se ha usado lisina pura, por ejemplo, 50 g de lisina pura, pero se ha visto que no es mejor que el protocolo anterior y, si bien produce menos náuseas, puede producir una hiperkalemia significativa. El uso de 75 g de lisina es muy eficaz, pero la hiperkalemia puede ser importante. La otra alternativa es una mezcla de lisina y arginina, que es mejor que dar 50 g de lisina sola. De todos estos métodos, el más eficaz es la mezcla de aminoácidos en 10 h, que es el que más disminuye la captación renal.
Respecto a la dosis máxima, algunos estiman que el umbral para producir nefrotoxicidad es 7,4 GBq/m2, lo que no está demostrado, pero hay algunas evidencias al respecto. El problema es que no se conoce con precisión la dosis máxima que puede recibir el riñón ni se puede estimar a priori basado en la dosis administrada solamente, porque la captación renal es variable y oscila entre 0,94 y 4,7 mGy/MBq, lo que indica que es necesario, por lo menos, tener una estimación de la dosis a riñón en cada paciente.
El radiofármaco que se utiliza es meta- yodo-bencil-guanidina (MIBG) . Algunas indicaciones son el feocromocitoma maligno y el paranganglioma maligno; también se ha utilizado en neuroblastoma, estadios III y IV, en carcinoma medular de tiroides y en tumor carcinoide. Las contraindicaciones absolutas, como en todos los tratamientos con radiaciones ionizantes son: el embarazo, la lactancia materna, que debe ser interrumpida, la mielosupresión grave y la insuficiencia renal grave; la contraindicación relativa sería el estado general del paciente.
La selección de los pacientes es similar a lo anterior: pacientes con tumores neuroendocrinos metastásicos, irresecables; con captación de MIBG; feocromocitoma con enfermedad metastásica progresiva; con o sin hipertensión; neuroblastomas inoperables al momento del diagnóstico; neuroblastomas en niños con enfermedad residual, recurrente o progresiva; carcinoma medular de tiroides metastásico o sintomático; tumor carcinoide metastásico o sintomático.
La preparación previa consiste en bloquear tiroides, ya que un porcentaje del yodo que marca el MIBG está libre y puede producir irradiación de esta glándula. Además, es necesario instruir al paciente sobre los conceptos de protección radiológica. En niños, es indispensable que los padres participen en su cuidado durante el tratamiento. Se requiere aislar al paciente por la emisión gamma del yodo 131.
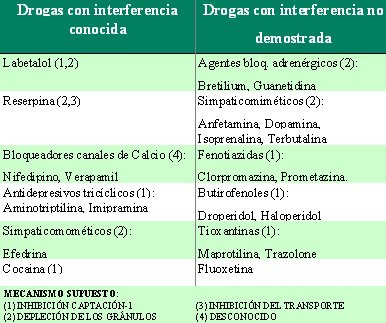
Los elementos que se deben evaluar previamente son los parámetros volumétricos y bioquímicos del tumor, para tener un basal con qué comparar y evaluar la respuesta al tratamiento. También es preciso conocer los parámetros hematológicos, de médula ósea y de función renal basales, para determinar si el paciente es candidato al tratamiento. Por último, se debe conocer la medicación que utiliza el paciente, para determinar si hay drogas que interfieran con la captación o la retención del MIBG, cuyo uso se debe suspender por lo menos dos semanas antes del tratamiento. Si es necesario, se puede cambiar a propranolol para controlar la hipertensión. En la Tabla I se enumeran las drogas con interferencia conocida y con interferencia posible, pero no demostrada, con MIBG.
Tabla I. Interferencia de drogas con MIBG (Protocol-[131I]MIBG Therapy. http:www.eanmrtc.org/Protocol/pmibg.htm).
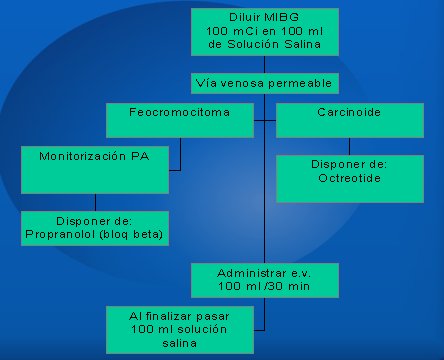
El esquema para la administración del MIBG se ve en la Figura 1. Se diluye en 100 ml de solución salina, se administra vía endovenosa en una pieza aislada, se monitoriza la presión arterial y se dispone de Octreotide. En caso de pacientes con carcinoide o feocromocitoma, es necesario tener un bloqueador beta como el propranolol. Se administra a una velocidad de 100 ml por 30 minutos, y al final se lava la bajada de suero con solución salina.
Figura 1. Esquema para la administración de MIBG.
Las dosis que hemos utilizado en niños están entre 100 y 200 mCi; en adultos, las dosis habituales varían entre 100 y 300, aunque a un paciente se le administró una dosis mayor, de 800 mCi/ciclo. Después de la administración, es necesario indicar antieméticos que no interfieran con la captación del MIBG (por ejemplo, domperidona) e hidratación abundante, controlando la presión arterial en feocromocitoma y el flushing, en carcinoide. Se recomienda no repetir el tratamiento por lo menos hasta cuatro semanas, en niños, o seis semanas, en adultos. Se debe posponer el embarazo por seis meses.
El seguimiento se realiza con cintigrafía con MIBG de cuerpo entero, se evalúan semanalmente los parámetros hematológicos hasta la sexta semana y se evalúa la presión arterial, ajustando la dosis de medicamentos. Se controla el peso en los niños, se controlan los parámetros volumétricos y bioquímicos del tumor y, al final del tratamiento, se realiza un MIBG diagnóstico.
La experiencia local del Hospital Clínico de la Pontificia Universidad Católica (Dr. Enrique Olea, datos no publicados), desde el año 1992 hasta el 2004, corresponde a un total de 47 pacientes que en su mayoría (22 pacientes) tenían tumores carcinoides, seguidos por feocromocitoma maligno (8), cáncer medular de tiroides (6) y neuroblastoma (5); el resto tenían paraganglioma, cáncer pulmonar de células pequeñas, insulinoma y ganglioneuroblastoma.
A un paciente con tumor carcinoide diagnosticado en 1990, que estuvo en tratamiento en Estados Unidos durante cinco años, se le administró el primer tratamiento con MIBG seis años después. El paciente sobrevivió hasta 1999, con múltiples lesiones y un síndrome carcinoide bastante invalidante. Este paciente mostró muy buena respuesta al tratamiento, desde el punto de vista sintomático.
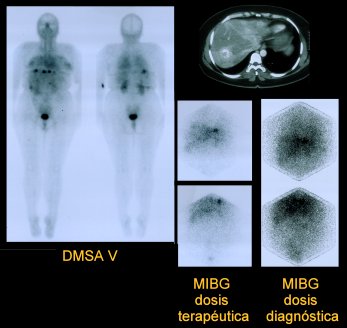
La Figura 2 corresponde a una paciente con cáncer medular de tiroides. En la imagen de la izquierda, con DMSA pentavalente, se ven las lesiones en la tomografía computada (TC); a la derecha se ve la captación del MIBG en dosis terapéutica y diagnóstica.
Figura 2. Paciente con cáncer medular de tiroides.
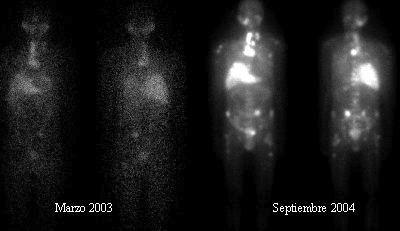
En la Figura 3, que corresponde a otro paciente con cáncer medular de tiroides, se ve el estudio diagnóstico realizado en marzo de 2003 y, después de la terapia, en septiembre de 2004; este paciente falleció un mes más tarde, sin síntomas; antes del tratamiento estaba muy sintomático y luego tuvo una regresión.
Figura 3. Paciente con cáncer medular de tiroides. Estudio diagnóstico antes y después de tratamiento.
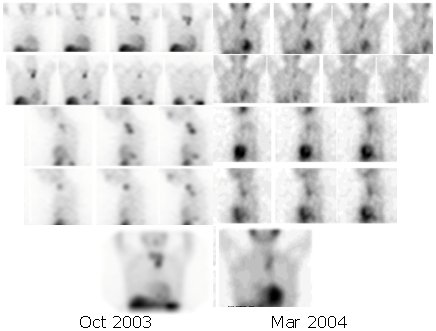
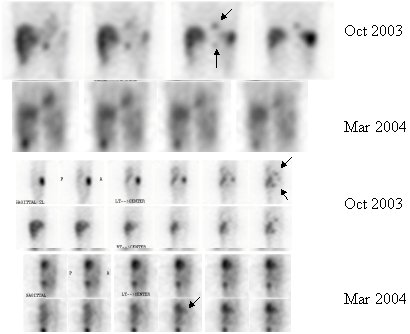
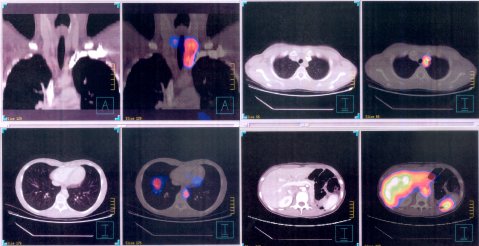
En una paciente portadora de feocromocitoma maligno con múltiples metástasis óseas en la calota y sustitución considerable del hígado, que recibió una dosis de 800 mCi y que tenía lesiones en región torácica alta, región retrocardíaca y detrás del diafragma, el estudio SPECT demostró que, entre octubre de 2003 y marzo de 2004, ocurrió una regresión parcial de la lesión torácica, con desaparición de la lesión retrocardíaca (véase Figura 4). El SPECT del abdomen mostró mejoría en el tiempo, con desaparición de algunas lesiones (Figura 5). La fusión con la TC permite mostrar la localización de las lesiones a nivel retrocardíaco, región torácica alta, cuello y lesión abdominal (Figura 6).
Figura 4. Paciente portadora de feocromocitoma maligno. SPECT de tórax antes y después de tratamiento con 800 mCi de I131 MIBG.
Figura 5. Feocromocitoma maligno. SPECT de abdomen antes y después de tratamiento con 800 mCi de I131 MIBG.
Figura 6. Feocromocitoma maligno. Tratamiento con 800 mCi de I131 MIBG. Fusión con TC.
Por el recuento de plaquetas, en esta paciente, previo al tratamiento, se hizo una cosecha de médula ósea y se realizó un autotransplante en el nadir de la curva de plaquetas; además se le administró factor estimulante de colonias. En ella, la única toxicidad significativa fue la medular.
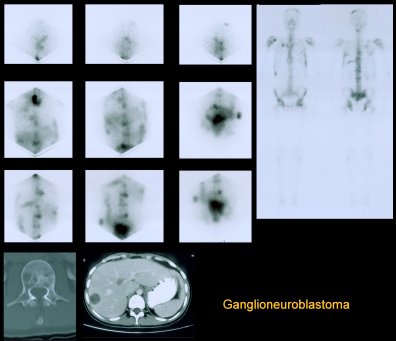
En la Figura 7 se muestra un paciente con ganglioneuroblastoma; las lesiones óseas son múltiples; se ven más lesiones con el MIBG, incluso, que en el cintigrama óseo.
Figura 7. Lesiones óseas múltiples en paciente con ganglioneuroblastoma.
Se sabe que el cáncer medular de tiroides y otros tumores pueden sobreexpresar receptores para colecistoquinina B (CCK), por lo que se han desarrollado análogos marcados para estos receptores. Behr utilizó minigastrina, que tiene gran afinidad por los receptores de CCK-B, marcada con itrio 90 (Y90-DTPA-D-glu-minigastrina), en 8 pacientes con enfermedad avanzada a quienes se administró dosis crecientes del radiopéptido, entre 30 a 50 mCi/m2, con 25% de respuesta parcial, buen resultado en este tipo de enfermedad. La mayor eficacia se relacionó con las dosis mayores y la dosis limitante estuvo dada por la toxicidad renal o hematológica, que se presentó cuando se llegó a 40 a 50 mCi/m2.
En cuanto a las aplicaciones futuras, es interesante plantear si es posible mejorar los resultados que hemos visto. Varios grupos están trabajando con otros análogos, por ejemplo, bombesina y neuropéptido, y que se expresan en cánceres comunes, como el cáncer de mama o de próstata. Hay también nuevos análogos de somatostatina, como el DOTA 1-NaI3, que tiene gran afinidad por los receptores sst2, sst3 y sst5 y se puede utilizar en tumores que no captan octreotide u octreotate; en ese sentido, se parece mucho más a la somatostatina natural. Otros cánceres pueden expresar receptores de somatostatina y por lo tanto, son susceptibles a tratamiento: los linfomas, melanomas, el cáncer de mama y el cáncer pulmonar de células pequeñas.
También se ha ocupado modalidades combinadas, es decir, terapia radiometabólica y cirugía, por ejemplo, como tratamiento complementario a la cirugía del tumor primario, para eliminar micrometástasis ocultas; en recurrencias más tardías o en tumores irresecables, seguido de cirugía, si es posible. En cuanto a combinaciones de péptidos marcados con diferentes radionúclidos y con análogos de diferentes receptores, por ejemplo, lo que se ha llamado el cóctel de receptores, hay experiencia preclínica interesante.
En modelos animales se ha observado una curación hasta de 100%, con una mezcla de lutecio 177 DOTATATE (Lu177-DOTATATE) e Y90 DOTATOC, según el tamaño tumoral. Como el rango de las partículas beta es diferente (el lutecio 177 es más corto que el itrio 90), el lutecio es el más apropiado para tumores pequeños, y se calcula que el diámetro óptimo es 2 cm; en cambio, el itrio es mejor para tumores de mayor tamaño, cuyo diámetro óptimo es 3,4 cm.
En otro modelo animal, en el que se simuló un tumor primario grande y una metástasis pequeña, se observó que, manteniendo la dosis constante, la mezcla de 50% de lutecio 177 DOTATATE y 50% de itrio 90 DOTATOC determina una curva de sobrevida significativamente mejor que el uso de cualquiera de ellos por separado. Cuando se usó la mezcla, el animal sobrevivía en promedio 146 días, versus 57 días con 100% DOTATOC y 50 días con 100% DOTATATE.
Hay evidencia in vitro de que el efecto tumoricida de la terapia radiometabólica con análogos de somatostatina puede aumentar si se utiliza análogos híbridos; es decir, análogos que se unen al receptor de somatostatina y al receptor de integrina (análogos somatostatina-receptor alfa beta 3-integrina) como, por ejemplo, péptido RGD-In111-DTPA-octreotate. Este efecto se debería a que el péptido denominado RGD (Arg-Gly-Asp) se une a un receptor de integrina y puede activar directamente la caspasa 3, enzima clave en el proceso de apoptosis. Al mezclar estos dos análogos en uno solo ocurre un efecto tumoricida, por la somatostatina, y de apoptosis, por el péptido RGD, pero aún no se cuenta con experiencia clínica con este péptido.








 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es la transcripción editada y revisada de la conferencia dictada en el marco del I Congreso Chileno de Medicina Nuclear, realizado en Santiago entre los días 4 al 6 de noviembre de 2004. El evento fue organizado por la Sociedad Chilena de Medicina Nuclear.
Comité Organizador
Prof. Dr. Patricio González (Presidente).
Dra. Teresa Massardo.
Dr. Juan Carlos Quintana.
Prof. Dr. Ismael Mena.
Edición Científica: Dra. Teresa Massardo.
 Expositor:
Juan Carlos Quintana[1]
Expositor:
Juan Carlos Quintana[1]

Citación: Quintana JC. Neuroendocrine tumors: radiometabolic therapy, with MIBG and others. Medwave 2005 Abr;5(4):e1365 doi: 10.5867/medwave.2005.04.1365
Fecha de publicación: 1/5/2005

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión