 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada y revisada de una conferencia que se dictó en el XXV Congreso Chileno de Medicina Intensiva, realizado en Pucón entre el 17 y el 20 de octubre de 2007. El congreso fue organizado por la Sociedad Chilena de Medicina Intensiva. El presidente de la Sociedad Chilena de Medicina Intensiva fue el Dr. Sebastián Ugarte y el secretario ejecutivo, el Dr. Antonio Hernández.
El objetivo de contar con sistemas de vigilancia y control de infecciones en las Unidades de Cuidado Intensivo (UCI) es proporcionar información apropiada para desarrollar medidas eficientes dirigidas a disminuir mortalidad, morbilidad y costos relacionados con las infecciones intrahospitalarias. Se asume que este objetivo se puede alcanzar mediante el descenso de las tasas de infección y la prevención de las infecciones ocasionadas por flora multirresistente. En definitiva, los sistemas de vigilancia y control de infecciones son sistemas de control de calidad.
En 1995, el Quality Indicator Study Group definió los aspectos más relevantes que se debe considerar al seleccionar indicadores de control de infecciones (1). El primer factor es la reproducibilidad, es decir, que permita hacer una definición clara de caso; por ejemplo, definir un caso de neumonía resulta más complejo que definir una bacteremia o una infección del tracto urinario. Otro factor es la facilidad de la toma de muestra. Por otro lado, para el ajuste de tasas debe ser posible utilizar denominadores que correspondan al número de días de uso de dispositivos y que, además, sean de fácil registro y conlleven una mínima carga laboral. Otros factores considerados como importantes fueron: la frecuencia del “suceso”, la importancia de la infección en cuanto a morbilidad y mortalidad, y la utilidad de las medidas de prevención (Tabla I).
En 1970, el Sistema Nacional de Vigilancia de Infecciones Nosocomiales estadounidense (NNIS) definió tres indicadores principales de infección:
Desde entonces, este organismo ha publicado periódicamente sus resultados comparando diferentes tipos de UCI (coronarias, quemados, pediátricas, medicoquirúrgicas, etc.) y sus respectivas tasas de infección, en percentiles. Sin embargo, esta apreciación es subjetiva y cada equipo debe establecer lo que considera como tasas aceptables para su unidad, teniendo en cuenta que es imposible que una UCI llegue a estar totalmente libre de infecciones nosocomiales.
Posteriormente el mismo organismo comenzó a registrar y evaluar la incidencia de resistencia bacteriana a los antimicrobianos, utilizando como indicador el porcentaje de resistencia de la flora infectante adquirida, sobre el total de la flora infectante. Los microorganismos sujetos a vigilancia son: S. aureus meticilino resistente (SAMR); enterococo resistente a vancomicina (ERV); P. aeruginosa resistente a imipenem, ceftazidima y quinolonas; Klebsiella sp, Enterobacter sp y E. coli resistentes a cefotaxima; con esta información se emiten reportes periódicos, de interés internacional, sobre los porcentajes de resistencia de los distintos patógenos. Los últimos datos, publicados en 2003, muestran aumento del porcentaje de resistencia, en comparación con el período 1998-2002, para todos los patógenos estudiados, excepto E. coli y Enterobacter sp resistentes a cefalosporinas de tercera generación (3).
El sistema NNIS ha sido adoptado, con algunas modificaciones, por un grupo de doce países europeos: Alemania, Austria, Bélgica, Francia, España, Luxemburgo, Lituania, Portugal, Escocia, Italia, Eslovaquia y Noruega, conformando el proyecto HELICS, cofinanciado por la Unión Europea. Este registro europeo constituye un sistema de vigilancia que actúa como indicador de calidad para las diferentes UCI.
Tradicionalmente, el sistema NNIS define a una infección como nosocomial cuando no existe evidencia de que estuviese presente o en incubación en el momento de admisión del paciente a la UCI (inicio luego de 48 horas post ingreso), y asume que las medidas preventivas para cada tipo de infección intrahospitalaria son siempre las mismas. El nuevo enfoque se basa en que las maniobras preventivas dependen del tipo de infección, según su patogenia. De este modo, las infecciones nosocomiales pueden derivar de patógenos propios del paciente o externos a él.
Algunas infecciones nosocomiales surgen a partir de la flora bacteriana de la cual el paciente es portador y que trae desde fuera de la Unidad, hacia el interior de ésta: son las llamadas infecciones primarias endógenas, cuya medida preventiva principal es la administración de un ciclo corto de antibióticos por vía parenteral, ya que de otra forma no es posible erradicar la flora que ingresa a las vías respiratorias al intubar al paciente. Cuando el enfermo adquiere esa flora a partir de otros reservorios, principalmente de otros pacientes de la unidad y desarrolla posteriormente una infección, ésta se conoce como infección secundaria endógena, que se puede prevenir si se evita el estado de portador, mediante higiene apropiada y antibióticos enterales. Por último, existen las infecciones exógenas, como la neumonía asociada a ventilación mecánica, en las que el patógeno se introduce directamente en el sitio de infección sin que el paciente sea portador de este agente en su aparato digestivo u orofaringe. Este grupo de infecciones se previene solamente mediante la optimización de las medidas de higiene (Fig. 1).
Figura 1. Clasificación de infecciones nosocomiales según estado de portación del agente causal.
Silvestri y colaboradores publicaron un trabajo en que compararon las tasas de infección respiratoria baja de acuerdo a los criterios tradicionales NNIS (punto de corte 48 horas), con los criterios de estado de portador mencionados en los párrafos anteriores (4). Según la clasificación NNIS, de los 27 casos que componían la muestra, 30% correspondió a infecciones adquiridas previamente, en la comunidad o nosocomiales, pero no en UCI, mientras que 70% de ellas se adquirió dentro de la UCI. Aplicando los criterios de estado de portador, 52% correspondió a infecciones primarias endógenas, por lo tanto se podrían haber evitado administrando ciclos cortos de antibióticos parenterales después de la intubación; en 37% de los casos se trató de infecciones secundarias endógenas, para cuya prevención son importantes la higiene y los antibióticos enterales; y sólo 11% de los casos correspondió a infecciones exógenas. Estos resultados son compatibles con casi todos los estudios que han utilizado la clasificación según estado de portación. Por lo tanto, es muy importante recordar que las medidas de prevención son diferentes según el tipo de infección.
En la Fig. 2 se observa el registro mensual de las tasas de neumonías asociadas a VM en la Unidad de Cuidados Intensivos del Hospital Universitario de Getafe, que cuenta con 20 camas y tiene una tasa media de 2,96 neumonías por cada 1000 días de VM. Esta tasa se encuentra en el percentil 25 respecto a las tasas del NNIS, es decir, son satisfactorias.
Además de lo anterior, los sistemas de vigilancia muestran la evolución temporal de las tasas, lo que permite evaluar las medidas que se adoptan. En el hospital universitario mencionado se observó una disminución importante de la tasa de neumonía asociada a VM con la introducción de la descontaminación digestiva selectiva, basada en los estados de portación. La vigilancia permanente del agente causal de la neumonía asociada a VM ha permitido establecer que el principal agente involucrado en las infecciones primarias endógenas es el S. aureus sensible a meticilina, lo que se puede explicar por el hecho de que durante un tiempo se utilizaron ciclos de tres días de cefotaxima para erradicar a este patógeno de la faringe y el sistema respiratorio, medida que resultó insuficiente; una vez que se volvió a ciclos de cuatro días de cefotaxima, este fenómeno se redujo. De lo anterior se desprende que, aunque las tasas de neumonía sean muy bajas, se pueden reducir todavía más si se presta atención a las fallas en las medidas de descontaminación que se utilizan para disminuir las infecciones secundarias endógenas. En la Fig. 3 se muestra el registro de la etiología y patogenia de las neumonías, en la misma unidad.
Figura 3. Etiología y patogenia de las neumonías, enero 2002 a diciembre 2006. Neumonías=52.
Es crucial distinguir aquellos patógenos adquiridos dentro de la UCI, de aquellos importados desde otros servicios del mismo hospital u otros hospitales, pues las medidas de prevención se enfocarán en aquellos enfermos que no son portadores ni están infectados por flora resistente cuando ingresan al servicio. Por ejemplo, en el caso de las enterobacterias resistentes a cefalosporinas de tercera generación, existen brotes de origen externo a la UCI; por lo tanto, mientras el resto de los servicios del hospital no controle esta situación, será difícil evitar la extensión de la resistencia dentro de la unidad (Fig. 4).
En la pesquisa de cepas resistentes, la tasa de detección aumenta significativamente si a la toma de muestras con fines de diagnóstico se agrega la toma de muestras de vigilancia (Fig. 5).
Además, este enfoque permitió demostrar que, en el caso de P. aeruginosa resistente, la aparición de nuevos casos en la Unidad depende casi totalmente de flora adquirida al interior de la misma (Fig. 6).
El análisis global de estos datos otorga la información necesaria para desarrollar nuevas investigaciones y diseñar posibles medidas de prevención.
Como recomendación general, es necesario partir construyendo tasas de infección, lo que resulta costo-efectivo y, en general, requiere poco tiempo de trabajo. Si las tasas no son altas, no es necesario hacer mayores cambios; si son altas, lo primero es descartar el sobrediagnóstico causado por aislamiento de agentes que no están provocando el cuadro clínico. Por ejemplo, la incidencia de neumonías por Candida es prácticamente despreciable: según un estudio realizado en el Hospital Clinic de Barcelona, sólo 4% de los enfermos que presenta crecimiento abundante de Candida tienen una neumonía comprobada microscópicamente (5). Otro ejemplo es el diagnóstico de neumonía por enterococo o estafilococo coagulasa negativo. Si las tasas son elevadas y no existe sobrediagnóstico, es necesario tomar muestras de vigilancia, idealmente por un periodo prolongado; además, es útil administrar cefotaxima si se trata de una infección primaria endógena, antibioterapia enteral y medidas de higiene en el caso de infecciones secundarias endógenas, o sólo medidas de higiene ante infecciones exógenas (Fig. 7).
Figura 7. Algoritmo general del sistema de vigilancia de infecciones nosocomiales en UCI.
Para vigilar la flora multirresistente, primero se debe determinar cuál es el microorganismo que causa más problemas dentro de la unidad, ya que no vale la pena gastar recursos en agentes que no afectan las tasas locales de infección nosocomial. Luego, al ingreso de cada paciente se deberá tomar muestras de vigilancia de mucosa rectal, nasal u orofaríngea, según corresponda a cada patógeno, para evaluar si el germen es importado o adquirido dentro de la unidad. Estas muestras de vigilancia se pueden repetir, con una frecuencia que dependerá de los recursos disponibles. En caso de que se detecte un portador de flora externa a la unidad en el momento del ingreso, se aislará y se realizará la descontaminación con base en antibióticos enterales no absorbibles; en caso de que se trate de flora adquirida dentro de la unidad, se deberá evaluar las medidas de higiene y las políticas de uso de antibióticos, junto con administrar antibioterapia enteral (Fig. 8).
Figura 8. Algoritmo de vigilancia de infecciones nosocomiales multirresistentes en UCI.

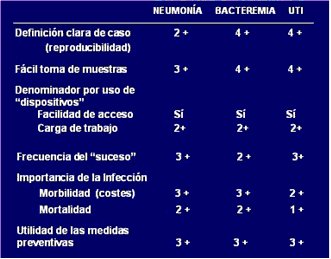 Tabla I. Comparación entre tasas de neumonía, bacteremia e infección del tracto urinario, según su idoneidad para constituir indicadores de control de infecciones.
Tabla I. Comparación entre tasas de neumonía, bacteremia e infección del tracto urinario, según su idoneidad para constituir indicadores de control de infecciones.

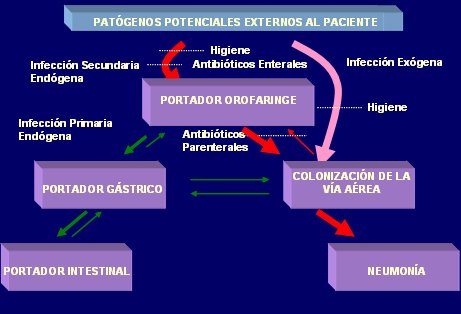 Figura 1. Clasificación de infecciones nosocomiales según estado de portación del agente causal.
Figura 1. Clasificación de infecciones nosocomiales según estado de portación del agente causal.

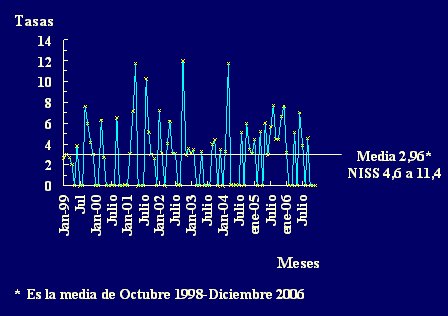 Figura 2. Tasas de neumonía asociada a Ventilación Mecánica (VM): número de neumonías por 1000 pacientes-días de VM. Unidad de Cuidados Intensivos del Hospital Universitario de Getafe, enero 1999 a julio 2006.
Figura 2. Tasas de neumonía asociada a Ventilación Mecánica (VM): número de neumonías por 1000 pacientes-días de VM. Unidad de Cuidados Intensivos del Hospital Universitario de Getafe, enero 1999 a julio 2006.

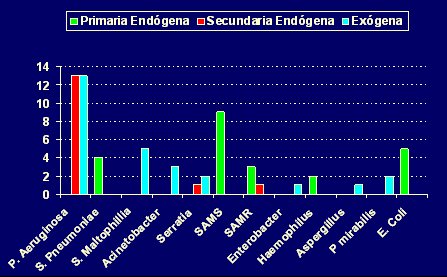 Figura 3. Etiología y patogenia de las neumonías, enero 2002 a diciembre 2006. Neumonías=52.
Figura 3. Etiología y patogenia de las neumonías, enero 2002 a diciembre 2006. Neumonías=52.

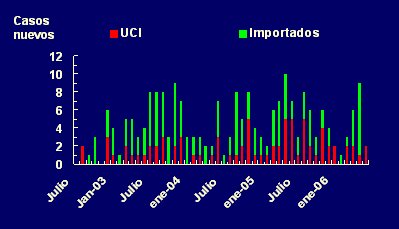 Figura 4. Incidencia de Enterobacteriaceae resistentes a cefalosporinas de tercera generación. Unidad de Cuidados Intensivos Hospital Universitario de Getafe, julio 2002 a junio 2006.
Figura 4. Incidencia de Enterobacteriaceae resistentes a cefalosporinas de tercera generación. Unidad de Cuidados Intensivos Hospital Universitario de Getafe, julio 2002 a junio 2006.

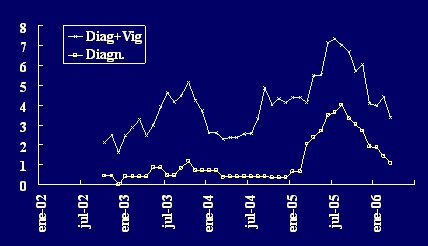 Figura 5. Enterobacterias resistentes a cefalosporinas de tercera generación, adquiridas en UCI. Tasas por 1000 días estancia (medias móviles).
Figura 5. Enterobacterias resistentes a cefalosporinas de tercera generación, adquiridas en UCI. Tasas por 1000 días estancia (medias móviles).

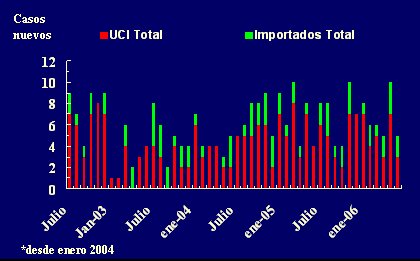 Figura 6. Incidencia de Pseudomona aeruginosa resistente a ceftazidima o TB o AMK o CIP o Gent*o Cefep* o IMP (Primer aislamiento: muestras clínicas + muestras de vigilancia) julio 2002 - junio 2006.
Figura 6. Incidencia de Pseudomona aeruginosa resistente a ceftazidima o TB o AMK o CIP o Gent*o Cefep* o IMP (Primer aislamiento: muestras clínicas + muestras de vigilancia) julio 2002 - junio 2006.

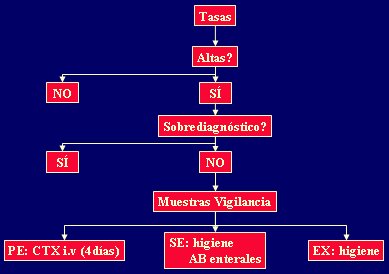 Figura 7. Algoritmo general del sistema de vigilancia de infecciones nosocomiales en UCI.
Figura 7. Algoritmo general del sistema de vigilancia de infecciones nosocomiales en UCI.

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada y revisada de una conferencia que se dictó en el XXV Congreso Chileno de Medicina Intensiva, realizado en Pucón entre el 17 y el 20 de octubre de 2007. El congreso fue organizado por la Sociedad Chilena de Medicina Intensiva. El presidente de la Sociedad Chilena de Medicina Intensiva fue el Dr. Sebastián Ugarte y el secretario ejecutivo, el Dr. Antonio Hernández.
 Expositor:
Miguel Ángel de la Cal[1]
Expositor:
Miguel Ángel de la Cal[1]

Citación: de la Cal MA. Surveillance and infection control in intensive care units. Medwave 2008 Ago;8(7):e549 doi: 10.5867/medwave.2008.07.549
Fecha de publicación: 1/8/2008

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 An approach to the evaluation of quality indicators of the outcome of care in hospitalized patients, with a focus on nosocomial infection indicators. The Quality Indicator Study Group. Am J Infect Control. 1995 Jun;23(3):215-22. | CrossRef | PubMed |
An approach to the evaluation of quality indicators of the outcome of care in hospitalized patients, with a focus on nosocomial infection indicators. The Quality Indicator Study Group. Am J Infect Control. 1995 Jun;23(3):215-22. | CrossRef | PubMed | National Nosocomial Infections Surveillance System. National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control. 2004 Dec;32(8):470-85. | CrossRef | PubMed |
National Nosocomial Infections Surveillance System. National Nosocomial Infections Surveillance (NNIS) System Report, data summary from January 1992 through June 2004, issued October 2004. Am J Infect Control. 2004 Dec;32(8):470-85. | CrossRef | PubMed | Suetens C, Morales I, Savey A, Palomar M, Hiesmayr M, Lepape A, et al. European surveillance of ICU-acquired infections (HELICS-ICU): methods and main results. J Hosp Infect. 2007 Jun;65 Suppl 2:171-3. | CrossRef | PubMed |
Suetens C, Morales I, Savey A, Palomar M, Hiesmayr M, Lepape A, et al. European surveillance of ICU-acquired infections (HELICS-ICU): methods and main results. J Hosp Infect. 2007 Jun;65 Suppl 2:171-3. | CrossRef | PubMed | Silvestri L, Sarginson RE, Hughes J, Milanese M, Gregori D, Van Saene HK. Most nosocomial pneumonias are not due to nosocomial bacteria in ventilated patients. Evaluation of the accuracy of the 48 h time cut-off using carriage as the gold standard. Anaesth Intensive Care. 2002 Jun;30(3):275-82. | PubMed |
Silvestri L, Sarginson RE, Hughes J, Milanese M, Gregori D, Van Saene HK. Most nosocomial pneumonias are not due to nosocomial bacteria in ventilated patients. Evaluation of the accuracy of the 48 h time cut-off using carriage as the gold standard. Anaesth Intensive Care. 2002 Jun;30(3):275-82. | PubMed | El-Ebiary M, Torres A, Fàbregas N, de la Bellacasa JP, González J, Ramirez J, et al. Significance of the isolation of Candida species from respiratory samples in critically ill, non-neutropenic patients. An immediate postmortem histologic study. Am J Respir Crit Care Med. 1997 Aug;156(2 Pt 1):583-90. | PubMed |
El-Ebiary M, Torres A, Fàbregas N, de la Bellacasa JP, González J, Ramirez J, et al. Significance of the isolation of Candida species from respiratory samples in critically ill, non-neutropenic patients. An immediate postmortem histologic study. Am J Respir Crit Care Med. 1997 Aug;156(2 Pt 1):583-90. | PubMed |