 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Este texto completo es una transcripción editada de la conferencia que se dictó en el XLVIII Congreso Chileno de Pediatría realizado en Viña del Mar entre el 26 y el 29 de Noviembre de 2008. El congreso fue organizado por la Sociedad Chilena de Pediatría bajo la presidencia de la Dra. Lidya Tellerías C.
La fisiopatología de la encefalopatía hipóxico-isquémica (EHI) se desencadena a partir de un fenómeno hipóxico que activa el proceso de glicólisis anaeróbica, punto de partida de diferentes líneas metabólicas que generan factores perjudiciales para el cerebro. Por una parte disminuye la molécula de ATP, lo que aumenta la cantidad de glutamato, el cual interactúa con el receptor N-metil D-aspartato (NMDA) para provocar un incremento de la concentración de calcio a nivel intracelular, con liberación de radicales libres a partir del ácido araquidónico e incremento del óxido nítrico. Por otra parte la glicólisis anaeróbica incrementa el nivel de adenosina y, a través de esto, el nivel de hipoxantina y xantina, que al igual que todos los otros factores mencionados producen daño neurológico. Para revertir este proceso se ha invertido mucho tiempo en el estudio y desarrollo de terapias específicas como: inhibidores de la xantina oxidasa (allopurinol) para reducir los niveles de xantinas; antioxidantes (lazeroides o superóxido dismutasa); bloqueadores de los receptores NMDA (sulfato de magnesio, dextrometorfano, ketamina), inhibidores del óxido nítrico y terapia con hipotermia, que también lograría los últimos dos objetivos. Sin embargo los avances en estas terapias aún son insuficientes (1) (Fig.1).
Figura 1. Proceso fisiopatológico de la EHI.
En el campo de la neuroprotección, lo que más se ha investigado es la hipotermia. Estudios experimentales han demostrado que la hipotermia disminuye el consumo cerebral de oxígeno, retarda la disminución de la relación energética fosfocreatín/fosforo inorgánico, suprime la actividad citotóxica de los aminoácidos excitatorios, inhibe la actividad sintetasa de oxido nítrico y disminuye los niveles de interleuquina 1 (IL-1) beta, disminuye la liberación de citoquinas tóxicas para la glía y disminuye la actividad de radicales libres, lo que a su vez reduce la apoptosis. Sin embargo, los trabajos de investigación que se han realizado aplicando esta teoría al campo clínico no han tenido los resultados esperados.
Gluckman estudió los efectos de la hipotermia sistémica en pacientes con encefalopatía neonatal en 116 pacientes en los que se aplicó enfriamiento selectivo de la cabeza mediante hipotermia sistémica leve. Los datos se compararon con los de un grupo control de 118 individuos. Como requisito de inclusión todos debían tener un electroencefalograma (EEG) previo, con el objetivo de determinar la gravedad de las lesiones antes de la intervención. En el análisis global no se encontraron diferencias significativas, pero al separar a los pacientes según nivel de gravedad al ingreso se encontró una diferencia significativa en muerte y daño grave a los dieciocho meses en aquellos con EEG intermedio. Se concluyó que en este estudio, el beneficio de la hipotermia se obtuvo en los pacientes con daño intermedio y por lo tanto, con alguna potencialidad de mejoría (2).
En una revisión sistemática de varios estudios relacionados con el uso de hipotermia para el tratamiento de la EHI neonatal (3) se logró identificar 16 estudios de los cuales seis se excluyeron por tratarse de estudios retrospectivos o series de casos; de los diez restantes sólo se incluyó a ocho estudios, de los cuales cuatro mostraban resultados según eficacia y los restante presentaban resultados sobre seguridad. Los criterios de inclusión consideraron determinados niveles de puntaje Apgar, pH y gases en sangre de cordón antes y después del nacimiento, más la necesidad de medidas de reanimación. Los criterios de exclusión incluyeron enfermedades metabólicas y congénitas, entre otras. En todos los estudios se determinó la forma de aplicar la hipotermia, la temperatura a alcanzar, la naturaleza aleatoria de la selección, la aplicación de un sistema ciego para los resultados y la realización de seguimientos completos. Los resultados mostraron diferencias significativas en cuanto a discapacidad neurológica en los sobrevivientes, a favor del grupo tratado, También se evaluó el resultado en cuanto a parálisis cerebral grave, índice de desarrollo mental y psicomotor alterados (<70), déficit visual y auditivo grave, presencia de epilepsia, necesidad de soporte vital y muerte. Al separar los resultados según gravedad de encefalopatía no se encontró diferencia significativa en los pacientes con encefalopatía grave, pero sí la hubo en aquellos con encefalopatía moderada, tanto en muerte y daño grave como en parálisis cerebral, en varios de los estudios (Tabla I).
En el año 2005 se publicó en New England Journal of Medicine un trabajo acerca de la hipotermia corporal global en recién nacidos con EHI que entregó resultados primarios sobre muerte y discapacidad y resultados secundarios en relación a sobrevivencia, presencia de parálisis cerebral y ceguera, entre otros aspecto (4). Posteriormente, en 2008, el mismo autor publicó en Pediatrics un segundo trabajo dedicado sólo a resultados secundarios (5). Lo interesante es que en el primer trabajo, en los resultados primarios se encontraron diferencias significativas respecto a muerte y discapacidad moderada o grave, mientras que en la publicación de 2008 no hubo diferencias significativas en muerte y discapacidad, ni tampoco las hubo al analizar las complicaciones o secuelas de las encefalopatías moderadas y graves por separado.
Un dato importante de este estudio es que la refrigeración de los pacientes se inició con una mediana de 35,5 minutos después de ser seleccionados para el estudio, pero el tiempo medio que tardó el proceso desde el nacimiento de los pacientes fue 5 horas, lo que demuestra que se cuenta con una ventana de tiempo determinado para inducir hipotermia. El problema surge en la práctica clínica, ya que, a diferencia de los estudios experimentales no siempre es posible reconocer el momento en que se produce la noxa que desencadena el fenómeno hipóxico isquémico, por lo tanto es difícil precisar el momento adecuado para iniciar la terapia. Otros datos importantes, que resultan alarmantes para aquellos centros que incorporan tanto la hipotermia activa mediante máquinas especializadas para inducción, como la pasiva, mediante la manipulación de los controles de incubadoras o cunas radiantes, indican que un recién nacido nunca alcanzó la temperatura de equilibrio y que ocurrieron 40 eventos con temperatura <32° C después de logrado el enfriamiento inicial, es decir, hubo sobreenfriamiento, en 27% de los pacientes; y 10 lactantes tuvieron temperatura <32º C tras lograr el equilibrio, es decir, de los pacientes que se sobreenfriaron previamente 10 volvieron a desarrollar el mismo estado. En el grupo sometido a hipotermia 43 pacientes presentaron convulsiones y a 44 se les administró anticonvulsivantes, mientras que en el grupo control esto ocurrió en 48 y 45 pacientes respectivamente. Finalmente, de los 32 pacientes con encefalopatía grave en el primer grupo, 33% recibió soporte inotrópico, en cambio, de los 38 pacientes con encefalopatía grave en el grupo control sólo 25% recibió apoyo inotrópico; llama la atención la gran cantidad de pacientes que no recibió este tipo de apoyo inotrópico en estas circunstancias.
Tras el análisis de los estudios anteriores surge una serie de dudas sobre la hipotermia:
Los opiáceos elevan los niveles de adenosina, un nucleósido endógeno con actividad neuroprotectora e inducen hiperpolarización neuronal; esto disminuye el calcio intracelular, que se considera como la principal causa de los daños fisiopatológicos. En un trabajo retrospectivo que se publicó en 2005 en Pediatric Research, se describe lo que ocurrió en 17 pacientes que recibieron analgesia con opiáceos (morfina o fentanilo) y en 35 pacientes que no la recibieron (6). Todos los pacientes eran recién nacidos de término con asfixia; ambos grupos fueron similares en alteraciones del tono muscular y del EEG. Se utilizó una escala de puntaje de daño según la resonancia nuclear magnética (a mayor número de alteraciones y según la ubicación de éstas, mayor puntaje) y según la magnitud del compromiso neuromotor, manifestado como cuadriplejia y alteraciones del tono, entre otras. Los pacientes que recibieron tratamiento con opiáceo tuvieron resultados favorables en comparación con el grupo control (Tabla II).
El allopurinol es un inhibidor de la xantina oxidasa, enzima que regula el metabolismo de la hipoxantina hacia la formación de radicales libres, aumenta la acumulación de adenosina y previene modificaciones en la afinidad iónica del receptor NMDA, lo que atenúa el daño tóxico. La Tabla III expone el resultado de un estudio experimental en el que se observó el efecto del allopurinol y la deferoxamina sobre el daño cerebral por reperfusión en lechones recién nacidos tras un episodio de hipoxia e isquemia. Para ello se evaluó el cuociente fosfocreatina/fósforo inorgánico (PCr/Pi ratio) en los grupos que recibieron placebo, allopurinol y dexeforamina antes del episodio, a la hora de transcurrido y a las 24 horas tras finalizar el mismo. Se encontró una diferencia significativa en los resultados a favor de allopurinol y dexeforamina (7).
Tabla III. Cuocientes PCr/Pi en grupos placebo, allopurinol y dexeforamina.
En otro estudio realizado en 1998, se evaluó el efecto del uso de allopurinol sobre la formación de radicales libres después de la asfixia, la hemodinamia y la actividad eléctrica cerebral, en un grupo de pacientes y un grupo control formado por 11 pacientes cada uno (8). Hubo un resultado final adverso, definido como muerte o anomalías neurológicas en el momento del alta, en 18% de los pacientes tratados con allopurinol y en 54% de los del grupo control; no obstante la incidencia de pH bajo en cordón umbilical y Apgar bajo a los 5 minutos fue similar en ambos grupos. En este trabajo también se midió el nivel de sustancias pro-oxidantes ligadas a hierro, que es una forma de evaluar radicales libres; y se encontró una diferencia significativa desde el segundo día en el grupo tratado con allopurinol, en comparación con el grupo control (Fig. 2).
Los barbitúricos reducen la excitabilidad neuronal porque disminuyen los potenciales de acción dependientes de calcio y aumentan las corrientes intracelulares de cloro mediadas por receptor GABA; y porque disminuyen el metabolismo cerebral y el consumo de oxígeno. Sin embargo, en una revisión de la base de datos Cochrane no se encontró una diferencia significativa en cuanto a muerte o presencia de discapacidad grave en los sobrevivientes del grupo de pacientes tratados con barbitúricos, en comparación con los no tratados.
Cabe señalar que los trabajos analizados en esta revisión: Goldberg en 1986, Ruth en 1991 y Hall en 1998, se realizaron con metodologías muy diferentes; por ejemplo Goldberg no utilizó fenobarbital (FBB), sino tiopental para provocar un estado de coma inducido en un grupo de 17 pacientes, y estableció a 15 pacientes como grupo control; sin embargo, a los controles no se les administró placebo y por otra parte, 14 de los pacientes tratados con tiopental y 12 de los del grupo control recibieron además FBB; además, los pacientes tratados con tiopental desarrollaron varios episodios de hipotensión, lo que agravó las consecuencias de la asfixia (9). De lo expuesto se deduce que este trabajo no se debió incluir en la revisión. Por su parte, Ruth evaluó el efecto de altas dosis de FBB para prevenir el daño cerebral post asfixia en 21 pacientes y 17 controles, en un seguimiento de seis años en el cual incluyó a neonatos con asfixia grave, definida por puntaje Apgar entre 0 y 3 a los 5 minutos o que necesitaron asistencia ventilatoria por más de 30 minutos después de nacer; sin embargo, no encontró diferencias significativas.
El estudio de Hall, que se publicó en 1998, incorporó a recién nacidos de término o postérmino con historia de asfixia grave, documentada por pH arterial inicial igual o menor de 7,0 y exceso de base igual o superior a -15 mEq/L, con Apgar igual o inferior a 3 a los cinco minutos de edad o en los que existió fracaso para iniciar la respiración espontánea antes de 10 minutos (10). En este trabajo se incluyó a 20 pacientes que recibieron FBB antes de las cuatro horas y 20 pacientes del grupo control, pero en el transcurso del estudio hubo un porcentajes de pérdida muy significativo: 5 pacientes del grupo experimental y 4 del grupo control, lo que redujo el tamaño muestral a tal punto que las diferencias observadas no fueron estadísticamente significativas, a pesar de la clara diferencia encontrada en el número de sobrevivientes sin daño alguno, de sobrevivientes sin daño neurológico y de fallecidos, como se aprecia en la Tabla IV. De lo expuesto se deduce que la revisión Cochrane no comparó trabajos representativos sobre neuroprotección por barbitúricos.
Tabla IV. Resultados del uso de FBT en altas dosis en recién nacidos con asfixia perinatal grave.
Temperatura. Aún no está claro si los pacientes deben ser enfriados o no, pero sí existe consenso en que no se deben sobrecalentar. En un trabajo publicado en 2008 en Pediatrics, se evaluó el resultado de daño en pacientes sometidos a protocolos de hipotermia, los que se dividieron en cuartiles según las temperaturas máximas que alcanzaron. Los pacientes de los cuartiles más altos de temperatura (37 a 38° C) tuvieron mucha mayor tasa de daño o muerte (11).
Glicemia. En un estudio que se publicó en 2004, se comparó a 27 niños con acidosis, definida como pH 6,89, e hipoglicemia, con 158 pacientes con acidosis pero sin hipoglicemia. Se encontró que 55,5% de los pacientes del primer grupo presentaron daño neurológico grave, mientras que en el segundo grupo sólo 16% presentó daño neurológico; la diferencia resultó significativa. Además se demostró que el riesgo de tener un puntaje neurológico anormal es 18,5 veces mayor en presencia de hipoglicemia (12). Otros datos disponibles indican que los niveles de glicemia son menores mientras mayor es el grado de asfixia, debido al consumo de energía; y a la inversa, los niveles de ácido úrico aumentan a medida que aumenta la gravedad de la asfixia, de modo que existe una relación directa entre el nivel de glicemia y el puntaje Apgar y una relación indirecta entre la glicemia y el estadio de la encefalopatía (13).
Gasto cardíaco y hemodinamia. Los pacientes asfixiados tienen compromiso de la función miocárdica, de magnitud variable. Liu, en un estudio que se publicó en 2007, analizó los cambios en la función cardíaca en pacientes asfícticos a través de la medición de la fracción de acortamiento del ventrículo izquierdo (FAVI) y del gasto cardíaco. El autor encontró un valor de FAVI antes de 24 horas en el grupo en estudio de 23%, lo que mejoró con el transcurso de los días, mientras que en el grupo control el valor fue de 31%. El gasto cardíaco fue 1,2 L/min en el grupo control y 0,7 L/min en el grupo experimental, es decir, alrededor de 60% del gasto cardíaco del grupo control. Este resultado demuestra que es imprescindible entregar apoyo a la bomba con fármacos inotrópicos en los neonatos con EHI (14).
Otro grupo evaluó la función cardíaca a través de la medición de frecuencia cardíaca, tiempo de eyección del ventrículo izquierdo, velocidad media del flujo aórtico, volumen de eyección y gasto cardíaco en pacientes con hipotermia: a los 33º C, durante el recalentamiento a 35º C y a los 37º C, en 169, 216 y 254 pacientes respectivamente. Los autores encontraron un descenso significativo del gasto cardíaco asociado a la disminución de la temperatura, pero el trabajo no permitió dilucidar si la reducción del gasto cardíaco fue secundaria a la hipotermia o a la reducción del consumo de oxígeno causada por ésta (15).
A continuación se analizará los elementos básicos del manejo de la EHI, que son los siguientes:
En una investigación que se realizó en el hospital Padre Hurtado, se mantuvo el porcentaje de cesáreas entre 1999 y 2004 en un promedio de 23,2% con el objetivo de evaluar la prevención de la EHI, previo acuerdo entre neonatólogos y obstetras para desarrollar guías clínicas y efectuar auditorías periódicas de la actividad asistencial, lo que se concretó en la creación de un indicador de calidad en neonatología: la tasa de incidencia de EHI (16). El diagnóstico de EHI se estableció en aquellos recién nacidos que presentaron Apgar bajo (3 al minuto uno ó 6 al minuto cinco) y/o pH de cordón en arteria umbilical <7,10, junto a signos clínicos característicos en el examen neurológico definidos según la clasificación de Sarnat-Sarnat. Los resultados demostraron una disminución de la EHI total, así como de la EHI grados II y III, al mismo tiempo que se contuvo la tasa de cesáreas y la mayor parte de los pacientes con EHI correspondió al grado I, condición que tiene buen pronóstico (Tabla V).
La mantención de una adecuada ventilación implica prevenir apneas y vigilar los niveles de oxígeno y la presión parcial de CO2 (pCO2). Se sabe que la anoxia prolongada provoca aumento del ácido láctico y disminuye las sustancias energéticas, de modo que es imprescindible monitorizar en forma continua la saturación de oxígeno, manejar oportuna y eficientemente las apneas y convulsiones y mantener la vía aérea despejada. No obstante se debe evitar la hiperoxia, puesto que ésta aumenta los radicales libres y reduce en 20 a 30% el flujo sanguíneo cerebral (FSC).
El efecto de la apnea y la bradicardia sobre el FSC es bien conocido: en presencia de bradicardia de 60 a 80 latidos por minuto el flujo se reduce en alrededor de 40% (17, 18). Por otra parte los cambios bruscos en los niveles de pCO2 condicionan marcados cambios en el FSC: cuando el paciente hiperventila este flujo disminuye en 36% y cuando deja de hiperventilar se produce un efecto de rebote que se traduce en aumentos de hasta 200% en el FSC (19).
La mantención de una perfusión cerebral adecuada constituye el aspecto crítico del manejo del paciente asfíctico; para conseguir este objetivo se debe aplicar el concepto de curso de circulación cerebral pasiva, que se refiere a que los cambios en la presión arterial influyen directamente en la circulación cerebral; se debe considerar la alteración de la autorregulación del FSC; se debe determinar la presión arterial normal para cada paciente; se debe hacer énfasis en el manejo de la hipo o hipertensión, de la anemia y de la hiperviscosidad; finalmente, es muy importante recordar que un paciente asfíctico no tolera la ligadura de cordón de la misma forma que un paciente normal.
La presión arterial se debe mantener estable, ya que la pérdida de la autorregulación cerebral tras la asfixia deja al cerebro especialmente vulnerable frente a la hipotensión arterial que acompaña a la EHI (20). La hipotensión propia de la EHI se debe inicialmente, las primeras dos a cuatro horas, a la hipovolemia y posteriormente es causada por un factor cardiogénico, excepto en los pacientes que nacen con asfixia grave y por lo tanto ya tienen falla miocárdica. El compromiso hipovolémico se explica por: la presencia de vasoconstricción fetal prenatal como fenómeno de compensación; la hipotensión fetal secundaria a la apnea; la ligadura precoz del cordón debido a la asfixia, lo que favorece la hipovolemia; y la restricción del aporte de fluidos como parte de las medidas que se toman para prevenir el desarrollo de edema cerebral. Posteriormente la disfunción miocárdica genera shock cardiogénico, que se debe evaluar a través de FAVI y manejar con fármacos vasoactivos en caso necesario.
En un estudio experimental en ratas a las que se indujo hipoglicemia por medio de administración de insulina, se observó que la hipoglicemia se asocia a baja tolerancia frente a la anoxia, con muerte precoz (21).
Las convulsiones provocan marcados cambios en la presión arterial, la cual se incrementa en cada crisis aumentando el FSC, lo que puede originar una hemorragia y finalizar con daño cerebral. Éste es el principal mecanismo de daño secundario a las convulsiones, pero hay muchos otros mecanismos fisiopatológicos involucrados, entre ellos la hipoventilación o apnea que provoca, por una parte, disminución de la pO2 lo que genera colapso cardiovascular con la consiguiente reducción del FSC; y por otra parte aumenta la pCO2, lo que aumenta el riesgo de hemorragia al igual que el aumento de la presión arterial. Otros mecanismos involucran: aumento de la liberación de aminoácidos excitatorios; y disminución de la molécula de ATP, que deriva en incremento de la glicólisis y disminución del pH y de la glucosa cerebral (Fig. 3).
Figura 3. Mecanismos de producción de daño cerebral secundario a convulsiones.
En este apartado se encuentra la hipotermia, la cual no se debe considerar como el eje del tratamiento de la EHI.
En la Fig. 4 se resume el diseño de un estudio que sigue las actuales líneas de investigación, incluyendo los criterios de incorporación, la intervención a realizar y la forma en que se llevará a cabo el seguimiento (22).
Figura 4. Líneas de trabajo para el estudio de estrategias neuroprotectoras en EHI.

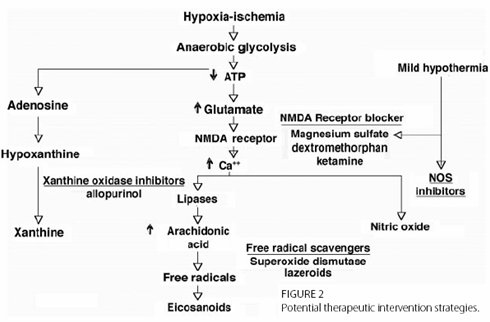 Figura 1. Proceso fisiopatológico de la EHI.
Figura 1. Proceso fisiopatológico de la EHI.

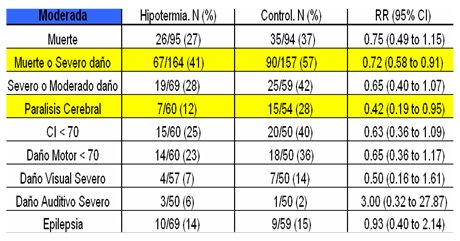 Tabla I. Hipotermia en el tratamiento de la EHI neonatal. Resultados según gravedad de la encefalopatía.
Tabla I. Hipotermia en el tratamiento de la EHI neonatal. Resultados según gravedad de la encefalopatía.

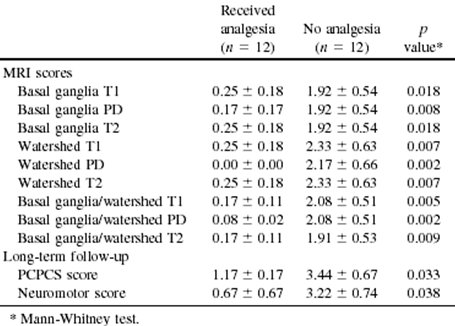 Tabla II. Resultados de acuerdo a escalas de puntaje según hallazgos a resonancia nuclear, Pediatric Cerebral Performance Category Scale (PCPCS) y examen neuromotor.
Tabla II. Resultados de acuerdo a escalas de puntaje según hallazgos a resonancia nuclear, Pediatric Cerebral Performance Category Scale (PCPCS) y examen neuromotor.

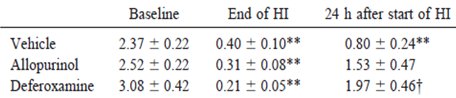 Tabla III. Cuocientes PCr/Pi en grupos placebo, allopurinol y dexeforamina.
Tabla III. Cuocientes PCr/Pi en grupos placebo, allopurinol y dexeforamina.

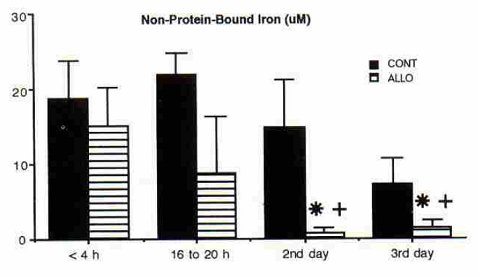 Figura 2. Sustancia pro-oxidante no proteica ligadora de hierro en grupo control y grupo en tratamiento con allopurinol.
Figura 2. Sustancia pro-oxidante no proteica ligadora de hierro en grupo control y grupo en tratamiento con allopurinol.

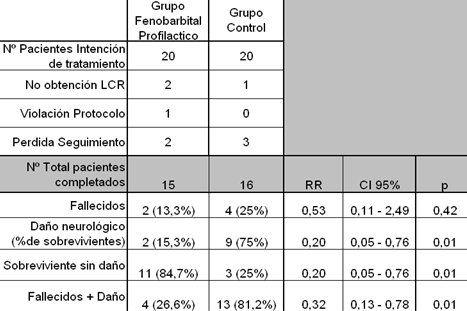 Tabla IV. Resultados del uso de FBT en altas dosis en recién nacidos con asfixia perinatal grave.
Tabla IV. Resultados del uso de FBT en altas dosis en recién nacidos con asfixia perinatal grave.

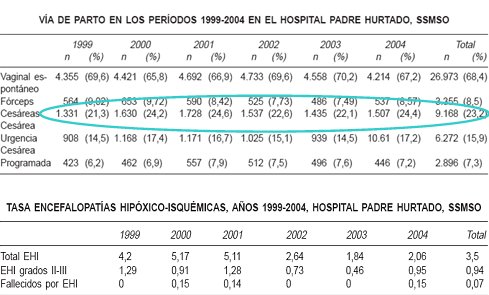 Tabla V. Gobierno del trabajo de parto en el hospital Padre Hurtado. Tasa de cesárea y tasa de EHI entre los años 1999 y 2004.
Tabla V. Gobierno del trabajo de parto en el hospital Padre Hurtado. Tasa de cesárea y tasa de EHI entre los años 1999 y 2004.

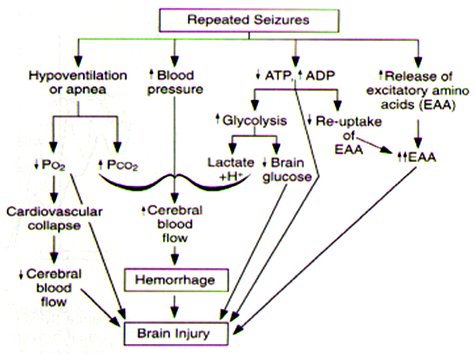 Figura 3. Mecanismos de producción de daño cerebral secundario a convulsiones.
Figura 3. Mecanismos de producción de daño cerebral secundario a convulsiones.

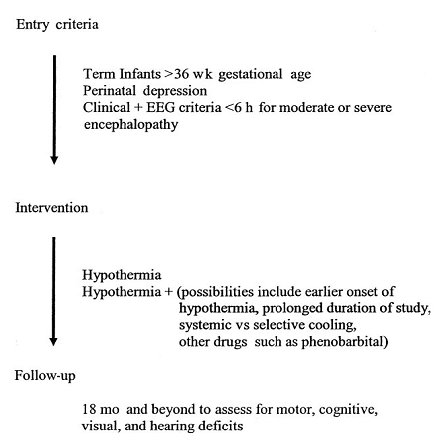 Figura 4. Líneas de trabajo para el estudio de estrategias neuroprotectoras en EHI.
Figura 4. Líneas de trabajo para el estudio de estrategias neuroprotectoras en EHI.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Este texto completo es una transcripción editada de la conferencia que se dictó en el XLVIII Congreso Chileno de Pediatría realizado en Viña del Mar entre el 26 y el 29 de Noviembre de 2008. El congreso fue organizado por la Sociedad Chilena de Pediatría bajo la presidencia de la Dra. Lidya Tellerías C.
 Autor:
José Manuel Novoa[1]
Autor:
José Manuel Novoa[1]

Citación: Novoa JM. Therapeutical approach of the newborn with hypoxic ischemic encephalopathy. Medwave 2009 Ago;9(8):e4067 doi: 10.5867/medwave.2009.08.4067
Fecha de publicación: 1/8/2009

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Nombre/name: Jesús Roberto Bonifaz
Fecha/date: 2011-12-12 21:04:40
Comentario/comment:
Muchas Gracias, quiza en una nueva oportunidad podamos charlar de las mejores terapias en medicina.
gracias
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Perlman JM. Summary proceedings from the neurology group on hypoxic-ischemic encephalopathy. Pediatrics. 2006 Mar;117(3 Pt 2):S28-33. | PubMed |
Perlman JM. Summary proceedings from the neurology group on hypoxic-ischemic encephalopathy. Pediatrics. 2006 Mar;117(3 Pt 2):S28-33. | PubMed | Gluckman PD, Wyatt JS, Azzopardi D, Ballard R, Edwards AD, Ferriero DM, et al. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomised trial. Lancet. 2005 Feb 19-25;365(9460):663-70. | PubMed |
Gluckman PD, Wyatt JS, Azzopardi D, Ballard R, Edwards AD, Ferriero DM, et al. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomised trial. Lancet. 2005 Feb 19-25;365(9460):663-70. | PubMed | Shah PS, Ohlsson A, Perlman M. Hypothermia to treat neonatal hypoxic ischemic encephalopathy: systematic review. Arch Pediatr Adolesc Med. 2007 Oct;161(10):951-8. | CrossRef | PubMed |
Shah PS, Ohlsson A, Perlman M. Hypothermia to treat neonatal hypoxic ischemic encephalopathy: systematic review. Arch Pediatr Adolesc Med. 2007 Oct;161(10):951-8. | CrossRef | PubMed | Shankaran S, Laptook AR, Ehrenkranz RA, Tyson JE, McDonald SA, Donovan EF, et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med. 2005 Oct 13;353(15):1574-84. | CrossRef | PubMed |
Shankaran S, Laptook AR, Ehrenkranz RA, Tyson JE, McDonald SA, Donovan EF, et al. Whole-body hypothermia for neonates with hypoxic-ischemic encephalopathy. N Engl J Med. 2005 Oct 13;353(15):1574-84. | CrossRef | PubMed | Shankaran S, Pappas A, Laptook AR, McDonald SA, Ehrenkranz RA, Tyson JE, et al. Outcomes of safety and effectiveness in a multicenter randomized, controlled trial of whole-body hypothermia for neonatal hypoxic-ischemic encephalopathy. Pediatrics. 2008 Oct;122(4):e791-8. | PubMed | PMC |
Shankaran S, Pappas A, Laptook AR, McDonald SA, Ehrenkranz RA, Tyson JE, et al. Outcomes of safety and effectiveness in a multicenter randomized, controlled trial of whole-body hypothermia for neonatal hypoxic-ischemic encephalopathy. Pediatrics. 2008 Oct;122(4):e791-8. | PubMed | PMC | Angeles DM, Wycliffe N, Michelson D, Holshouser BA, Deming DD, Pearce WJ, et al. Use of opioids in asphyxiated term neonates: effects on neuroimaging and clinical outcome. Pediatr Res. 2005 Jun;57(6):873-8. Epub 2005 Mar 17. | PubMed |
Angeles DM, Wycliffe N, Michelson D, Holshouser BA, Deming DD, Pearce WJ, et al. Use of opioids in asphyxiated term neonates: effects on neuroimaging and clinical outcome. Pediatr Res. 2005 Jun;57(6):873-8. Epub 2005 Mar 17. | PubMed | Peeters-Scholte C, Braun K, Koster J, Kops N, Blomgren K, Buonocore G, et al. Effects of allopurinol and deferoxamine on reperfusion injury of the brain in newborn piglets after neonatal hypoxia-ischemia. Pediatr Res. 2003 Oct;54(4):516-22. Epub 2003 Jun 18. | PubMed |
Peeters-Scholte C, Braun K, Koster J, Kops N, Blomgren K, Buonocore G, et al. Effects of allopurinol and deferoxamine on reperfusion injury of the brain in newborn piglets after neonatal hypoxia-ischemia. Pediatr Res. 2003 Oct;54(4):516-22. Epub 2003 Jun 18. | PubMed | Van Bel F, Shadid M, Moison RM, Dorrepaal CA, Fontijn J, Monteiro L, et al. Effect of allopurinol on postasphyxial free radical formation, cerebral hemodynamics, and electrical brain activity. Pediatrics. 1998 Feb;101(2):185-93. | CrossRef | PubMed |
Van Bel F, Shadid M, Moison RM, Dorrepaal CA, Fontijn J, Monteiro L, et al. Effect of allopurinol on postasphyxial free radical formation, cerebral hemodynamics, and electrical brain activity. Pediatrics. 1998 Feb;101(2):185-93. | CrossRef | PubMed | Evans DJ, Levene MI, Tsakmakis M. Anticonvulsants for preventing mortality and morbidity in full term newborns with perinatal asphyxia. Cochrane Database Syst Rev. 2007 Jul 18;(3):CD001240. | PubMed |
Evans DJ, Levene MI, Tsakmakis M. Anticonvulsants for preventing mortality and morbidity in full term newborns with perinatal asphyxia. Cochrane Database Syst Rev. 2007 Jul 18;(3):CD001240. | PubMed | Hall RT, Hall FK, Daily DK. High-dose phenobarbital therapy in term newborn infants with severe perinatal asphyxia: a randomized, prospective study with three-year follow-up. J Pediatr. 1998 Feb;132(2):345-8. | CrossRef | PubMed |
Hall RT, Hall FK, Daily DK. High-dose phenobarbital therapy in term newborn infants with severe perinatal asphyxia: a randomized, prospective study with three-year follow-up. J Pediatr. 1998 Feb;132(2):345-8. | CrossRef | PubMed | Laptook A, Tyson J, Shankaran S, McDonald S, Ehrenkranz R, Fanaroff A, et al. Elevated temperature after hypoxic-ischemic encephalopathy: risk factor for adverse outcomes. Pediatrics. 2008 Sep;122(3):491-9. | CrossRef | PubMed | PMC |
Laptook A, Tyson J, Shankaran S, McDonald S, Ehrenkranz R, Fanaroff A, et al. Elevated temperature after hypoxic-ischemic encephalopathy: risk factor for adverse outcomes. Pediatrics. 2008 Sep;122(3):491-9. | CrossRef | PubMed | PMC | Salhab WA, Wyckoff MH, Laptook AR, Perlman JM. Initial hypoglycemia and neonatal brain injury in term infants with severe fetal acidemia. Pediatrics. 2004 Aug;114(2):361-6. | CrossRef | PubMed |
Salhab WA, Wyckoff MH, Laptook AR, Perlman JM. Initial hypoglycemia and neonatal brain injury in term infants with severe fetal acidemia. Pediatrics. 2004 Aug;114(2):361-6. | CrossRef | PubMed | Basu P, Som S, Choudhuri N, Das H. Contribution of the blood glucose level in perinatal asphyxia. Eur J Pediatr. 2009 Jul;168(7):833-8. Epub 2008 Oct 9. | CrossRef | PubMed |
Basu P, Som S, Choudhuri N, Das H. Contribution of the blood glucose level in perinatal asphyxia. Eur J Pediatr. 2009 Jul;168(7):833-8. Epub 2008 Oct 9. | CrossRef | PubMed | Liu J, Li J, Gu M. The correlation between myocardial function and cerebral hemodynamics in term infants with hypoxic-ischemic encephalopathy. J Trop Pediatr. 2007 Feb;53(1):44-8. Epub 2006 Oct 17. | CrossRef | PubMed |
Liu J, Li J, Gu M. The correlation between myocardial function and cerebral hemodynamics in term infants with hypoxic-ischemic encephalopathy. J Trop Pediatr. 2007 Feb;53(1):44-8. Epub 2006 Oct 17. | CrossRef | PubMed | Gebauer CM, Knuepfer M, Robel-Tillig E, Pulzer F, Vogtmann C. Hemodynamics among neonates with hypoxic-ischemic encephalopathy during whole-body hypothermia and passive rewarming. Pediatrics. 2006 Mar;117(3):843-50. | CrossRef | PubMed |
Gebauer CM, Knuepfer M, Robel-Tillig E, Pulzer F, Vogtmann C. Hemodynamics among neonates with hypoxic-ischemic encephalopathy during whole-body hypothermia and passive rewarming. Pediatrics. 2006 Mar;117(3):843-50. | CrossRef | PubMed | Latorre R, Carrillo J, Yamamoto M, Novoa J, Valdés A, Insunza A, et al. Gobierno del parto en el Hospital Padre Hurtado: un modelo para contener la tasa de cesáreas y prevenir la encefalopatía hipóxico-isquémica. Rev Chil Obstet Ginecol 2006:71(3):196-200. | Link |
Latorre R, Carrillo J, Yamamoto M, Novoa J, Valdés A, Insunza A, et al. Gobierno del parto en el Hospital Padre Hurtado: un modelo para contener la tasa de cesáreas y prevenir la encefalopatía hipóxico-isquémica. Rev Chil Obstet Ginecol 2006:71(3):196-200. | Link | Volpe J. Hypoxic ischemic encephalopathy: biochemical and physiological aspects. Neurology of the Newborn 2008; (5):250.
Volpe J. Hypoxic ischemic encephalopathy: biochemical and physiological aspects. Neurology of the Newborn 2008; (5):250.  Perlman JM, Volpe JJ. Episodes of apnea and bradycardia in the preterm newborn: impact on cerebral circulation. Pediatrics. 1985 Sep;76(3):333-8. | PubMed |
Perlman JM, Volpe JJ. Episodes of apnea and bradycardia in the preterm newborn: impact on cerebral circulation. Pediatrics. 1985 Sep;76(3):333-8. | PubMed | Gleason CA, Short BL, Jones MD Jr. Cerebral blood flow and metabolism during and after prolonged hypocapnia in newborn lambs. J Pediatr. 1989 Aug;115(2):309-14. | CrossRef | PubMed |
Gleason CA, Short BL, Jones MD Jr. Cerebral blood flow and metabolism during and after prolonged hypocapnia in newborn lambs. J Pediatr. 1989 Aug;115(2):309-14. | CrossRef | PubMed | Rosenberg AA. Regulation of cerebral blood flow after asphyxia in neonatal lambs. Stroke. 1988 Feb;19(2):239-44. | CrossRef | PubMed |
Rosenberg AA. Regulation of cerebral blood flow after asphyxia in neonatal lambs. Stroke. 1988 Feb;19(2):239-44. | CrossRef | PubMed | Vannucci RC, Vannucci SJ. Cerebral carbohydrate metabolism during hypoglycemia and anoxia in newborn rats. Ann Neurol. 1978 Jul;4(1):73-9. | CrossRef | PubMed |
Vannucci RC, Vannucci SJ. Cerebral carbohydrate metabolism during hypoglycemia and anoxia in newborn rats. Ann Neurol. 1978 Jul;4(1):73-9. | CrossRef | PubMed | Perlman JM. Summary proceedings from the neurology group on hypoxic-ischemic encephalopathy. Pediatrics. 2006 Mar;117(3 Pt 2):S28-33. | PubMed |
Perlman JM. Summary proceedings from the neurology group on hypoxic-ischemic encephalopathy. Pediatrics. 2006 Mar;117(3 Pt 2):S28-33. | PubMed |