Key Words: Covid-19, Pandemics, Coronavirus-2019-nCoV, Coronavirus infection, Newborn, Infants
Resumen
Introducción
La enfermedad por COVID-19 ha sido reportada en recién nacidos; sin embargo, aún no son claros sus efectos en el seguimiento de neonatos.
Objetivo
Describir las características clínicas, epidemiológicas y el seguimiento de recién nacidos infectados con SARS-CoV-2.
Métodos
Estudio observacional y descriptivo. Participaron recién nacidos que tuvieron PCR-TR positivo a SARS-CoV-2, hijos de madres seropositivas a SARS-CoV-2. La atención del parto y del recién nacido fueron en el Instituto Nacional Materno Perinatal de Perú, entre el 1 de junio y el 30 de septiembre de 2020. Se recogió información perinatal de registros médicos. Se realizó seguimiento remoto y evaluación presencial para descripción epidemiológica, clínica y resultados de pruebas serológicas y PCR-TR para SARS-CoV-2. En el análisis se usó estadística descriptiva.
Resultados
Durante el período de estudio nacieron 4733 recién nacidos. De estos niños, 1488 (31,4%) procedieron de gestantes seropositivas a SARS-CoV-2 y de ellos 34 (2,3%) tuvieron PCR-TR positivo a SARS-CoV-2. De los 34 recién nacidos 29,4% nació por cesárea, 26,5% tuvo bajo peso, 11,8% fue prematuro 26,5% tuvo indicación de hospitalización por patología y un neonato falleció. De los 34 neonatos, 28 tuvieron seguimiento remoto y de ellos 18 tuvieron además seguimiento presencial post alta. El 64,3% recibía lactancia materna exclusiva, 28,6% lactancia mixta y 7,1% usaba un sucedáneo. La evaluación presencial se realizó entre uno a cuatro meses de edad cronológica. El 100% tuvo prueba de PCR-TR de control para coronavirus negativa y 38,9% tuvo prueba serológica (IgM, IgG) negativa y 61,1% IgG positiva.
Conclusiones
La infección neonatal por SARS-CoV-2 es poco frecuente, la mayoría de infectados fueron asintomáticos. El parto vaginal, la lactancia materna y aislamiento conjunto no reportaron complicaciones en la evolución durante la atención hospitalaria. Los infantes en seguimiento remoto y presencial mostraron evolución clínica favorable durante el período de estudio.
|
Ideas clave
|
Introducción
La pandemia por el virus SARS-CoV-2 se ha convertido en la emergencia de salud pública más grave en el mundo [1]. La enfermedad por coronavirus 2019 (COVID-19) es una infección por un virus emergente perteneciente al grupo de virus ARN, específicamente un βcoronavirus que es genéticamente similar al virus del SARS [2],[3]. La Organización Mundial de la Salud (OMS), la declaró como pandemia a partir del 11 marzo de 2020 y está actualmente en 213 naciones [4],[5].
Al inicio de la pandemia no se encontró evidencia de transmisión vertical. Varias muestras (líquido amniótico, sangre del cordón umbilical, hisopados faríngeos en neonatos, hisopados placentarios, líquido genital y muestras de leche materna) de madres infectadas dieron negativo para el virus [6],[7],[8]. Sin embargo, a un año de pandemia se reporta evidencia de transmisión intraútero [9]. Wang y colaboradores confirman la infección intraútero por SARS-CoV-2 a través de detección de PCR-TR positiva o secuenciación de genes del virus del tracto respiratorio superior, inferior, sangre y tracto digestivo [10].
En pacientes pediátricos con COVID-19 se experimenta una enfermedad más leve; mientras que en menores de un año se reportan síntomas graves de enfermedad y vómitos que ameritan atención [11]. Se sabe poco sobre las secuelas de la infección por SARS-CoV-2 en los niños hospitalizados por COVID-19 y rara vez se reportan secuelas a corto plazo [12]. La identificación de SARS-CoV-2 en recién nacidos es poco frecuente a pesar de proceder de una madre con COVID-19 [13].
La literatura presenta evidencia no concluyente sobre cómo se comporta la infección por COVID-19 en la etapa perinatal y su evolución posterior [11]. Un factor importante a valorar en el seguimiento del recién nacido es la lactancia materna que reduce el riesgo de infección neonatal por otros patógenos [14]. Asimismo, transmite anticuerpos específicos contra coronavirus que protegerían al recién nacido [15].
El estudio tuvo como objetivo describir las características clínicas y epidemiológicas en el seguimiento de recién nacidos que presentaron infección por SARS-CoV-2 al nacimiento, que fueron atendidos en un hospital nivel III de Perú.
Método
Diseño de estudio y contexto
Es un estudio observacional, descriptivo y prospectivo. El estudio fue realizado en el Instituto Nacional Materno Perinatal del Ministerio de Salud de Perú. Se trata de un establecimiento del tercer nivel de atención con categoría III-2, el cual es centro de referencia nacional.
Debido al contexto de pandemia por COVID-19, todas las gestantes atendidas ingresaron por el servicio de emergencia donde se les realizó una prueba serológica para SARS-CoV-2. Adicionalmente, de acuerdo con el criterio médico, se les realizó la toma de hisopado faríngeo y nasal para el análisis mediante prueba de reacción en cadena de la polimerasa con transcripción inversa en tiempo real (PCR-TR), ya sea por antecedente epidemiológico o prueba serológica negativa con clínica sospechosa.
Cuando la gestante presentaba prueba serológica positiva (inmunoglobulinas M, IgM, o inmunoglobulinas M y G, IgM/ IgG) o PCR-TR positivo, era atendida en una sala diferenciada unipersonal de partos y/u operaciones de COVID-19. Luego de la atención inmediata, la madre pasó con su bebé a una sala de aislamiento COVID-19. Cada sala tenía capacidad para dos madres, cada cama tenía una separación de dos metros entre ellas, además de un separador móvil. En el caso que la madre fuera sintomática respiratoria, era colocada en una habitación unipersonal. Las madres en todo momento usaban mascarillas y protectores faciales.
Cuando el recién nacido requirió hospitalización, fue llevado en incubadora cerrada a la sala de cuidados intensivos o intermedios COVID-19, donde permaneció en incubadora cerrada. A todo recién nacido que procedía de una gestante seropositiva o con PCR-TR positiva a SARS-CoV-2, se le realizó la prueba de PCR-TR por hisopado nasofaríngeo dentro de las siguientes 12 a 24 horas de vida. Se siguieron los protocolos institucionales para disminuir riesgos de transmisión horizontal, mediante la implementación de áreas de aislamiento, cuidados intermedios y unidades de cuidados intensivos neonatales adaptados para su atención diferenciada.
Población y muestra
En el estudio participaron neonatos con resultado positivo de prueba de PCR-TR en secreción respiratoria tomada a través de hisopado nasofaríngeo, que procedieron de una gestante con serología positiva para SARS-CoV-2. La fecha de nacimiento ocurrió entre el 1 de junio y el 30 de septiembre de 2020. Los criterios de inclusión fueron:
- Neonato cuya madre presentó anticuerpos anti-SARS-CoV-2 al ingreso hospitalario.
- Ocurrencia del parto en la institución.
- Neonato que tuvo resultado de PCR-TR positivo a SARS-CoV-2.
Los criterios de exclusión fueron:
- Historial médico con subregistro para las variables maternas.
- Historial médico con subregistro para las variables neonatales.
En la fase de seguimiento se reportaron todos los datos disponibles en el seguimiento remoto y evaluación presencial. No se excluyeron a los infantes de seguimiento remoto que no acudieron a evaluación presencial.
Prueba de detección de sars-cov-2
Las muestras biológicas del recién nacido fueron obtenidas a partir del hisopado faríngeo y fueron procesados en el Instituto Nacional de Salud de Perú, para identificación del virus SARSCoV-2 mediante la prueba PCR-TR.
La prueba serológica fue el One Step Test Kit Covid-19, validada por la comisión de la Comunidad Europea. Este es un ensayo rápido por el método de inmunocromatografía, que permite detectar simultáneamente las inmunoglobulinas M e G. La aplicación de las pruebas PCR-TR y la prueba serológica fue realizada por personal profesional calificado y entrenado del Instituto Nacional Materno Perinatal. Los resultados fueron registrados por el personal de salud en una ficha estándar de pruebas serológicas y de pruebas de PCR-TR de la oficina de Epidemiologia y Salud Ambiental del Instituto Nacional Materno Perinatal.
Variables
En los datos perinatales se registraron datos maternos como edad, síntomas respiratorios maternos (tos, dolor de garganta, cefalea, fiebre, escalofrío y/o congestión nasal) presentes al ingreso hospitalario y/o al momento del parto. También se registraron datos como tipo de complicación en el embarazo, tipo de parto (vaginal o cesárea e incluyendo motivo de la cesárea). Los datos del recién nacido recogidos fueron tipo de ingreso
hospitalario (cuidados intermedios, cuidados intensivos, aislamiento conjunto), comorbilidades neonatales, días de hospitalización y condición al alta hospitalaria (fallecido o vivo).
En el seguimiento remoto se corroboraron datos maternos previos al nacimiento, información de contactos con COVID-19, infección de familiares luego de volver a casa, síntomas del bebé posterior al alta, tipo de alimentación (lactancia materna exclusiva, lactancia mixta, alimentación sucedánea) y vacunaciones recibidas.
En la evaluación presencial del infante se registraron datos antropométricos, anamnesis clínica, examen físico, resultados de pruebas de PCR-TR y prueba serológica para coronavirus.
Recolección de la Información
Los resultados de la prueba serológica rápida aplicada a las gestantes, prueba de PCR-TR y serológica en el recién nacido, fueron obtenidos a partir de las fichas estandarizadas de pruebas serológicas y pruebas moleculares de la oficina de Epidemiologia y Salud Ambiental del Instituto Nacional Materno Perinatal. La recolección de información respecto a las variables perinatales, fue obtenida a partir de las historias clínicas. El seguimiento posterior al alta hospitalaria tuvo una primera etapa telefónica en la que se contactó con la madre del recién nacido y se invitó de forma voluntaria a participar de la evaluación presencial. Además, en el seguimiento vía telefónica y en la evaluación presencial, se tomaron los resguardos necesarios para garantizar el anonimato de los participantes a través de la codificación de su identidad al recoger datos de las fuentes de información. Se obtuvo consentimiento informado de los padres para la participación en este estudio.
Análisis estadístico
Se realizaron tablas de contingencia con representaciones de frecuencias absolutas y frecuencias proporcionales por columna. Los datos fueron procesados en el software estadístico R versión 4.0 y en su plataforma de R estudio.
Consideraciones éticas
La investigación contó con la aprobación del Comité de Ética Institucional de Investigación del Instituto Nacional Materno Perinatal, como consta en el informe de aprobación N° 20-11693-1-CIEI/INMP. Se contó con el permiso institucional correspondiente. Se aplicó consentimiento informado a las madres de los recién nacidos, para poder incluir los datos perinatales y del seguimiento posterior al alta hospitalario para fines de investigación y salvaguardando la identidad de los participantes en todo momento.
Resultados
En el periodo de estudio fueron atendidos 4733 nacimientos, de los cuales 1488 (31,4%) fueron recién nacidos de madres infectadas con serología positiva a SARS CoV-2. A todos los recién nacidos de madres seropositivas a SARS-CoV-2 se les aplico la prueba PCR-TR. El 2,3% tuvo un resultado positivo, quienes ingresaron al estudio para el reporte de datos perinatales y de seguimiento posterior al alta hospitalaria (Figura 1).
Figura 1. Flujograma de selección de recién nacidos incluidos en el estudio.
En los 34 recién nacidos con PCR-TR positivo, 18 (52,9%) fueron hijos de madres entre 20 a 34 años, nueve (26,5%) de madres entre 35 a 43 años y siete (20,6%) de madres entre 16 a 19 años. Del total, 12 recién nacidos (35,3%) procedieron de madres primigestas.
Dentro de las comorbilidades maternas se encontró preeclampsia, corioamnionitis, obesidad, anemia, oligohidramnios, polihidramnios, útero bicorne y acarosis. De las gestantes, 10 (29,4%) reportaron haber tenido contacto COVID-19, tres (3%) presentaron dificultad respiratoria como sintomatología relacionada a COVID-19, 27 (79,4%) dieron serología IgM/IgG positiva a COVID-19, 24 (70,6%) culminaron la gestación por parto vaginal y 10 (29,4%) por vía cesárea. La indicación de cesárea fue por embarazo gemelar, preeclampsia, corioamnionitis, cesárea anterior, circular doble al cuello, útero bicorne, ruptura prolongada de membranas, distocia funicular, presentación podálica o transversa y malformación congénita cerebral. De las madres, 25 (73,5%) estuvo hospitalizada menos de tres días (Tabla 1).
De los 34 recién nacidos con PCR-TR positivo, 18 (52,9%) son de sexo femenino, 16 (47,1%) masculino, nueve (26,5%) registraron bajo peso, cuatro (11,8%) fueron prematuros o pretérminos y tres (8,8%) macrosómicos. En cuanto a la evaluación Apgar, seis (17,6%) tuvieron puntaje menor de siete al primer minuto de vida y uno (3%) a los cinco minutos. Nueve recién nacidos (73,5%) no presentaron morbilidad y permanecieron en aislamiento conjunto por menos de 72 horas. Nueve neonatos (26,5%) tuvieron indicación de hospitalización por presentar alguna patología. A 11 recién nacidos (32,3%) se les realizó tamizaje metabólico y a 12 (35,3%) tamizaje auditivo. Por último, 33 niños (97%) egresaron vivos y uno falleció durante la hospitalización (Tabla 2).
De los nueve neonatos que requirieron hospitalización por morbilidad, cuatro fueron prematuros. Uno de ellos permaneció hospitalizado 65 días. Nació a las 28 semanas de edad gestacional con 1025 gramos de peso al nacer, gemelar II, varón, cursó con enfermedad de membrana hialina, apnea, ictericia, sepsis y candidiasis sistémica. El segundo bebé de 35 semanas de edad gestacional, tenía ecografía prenatal de malformación de tubo digestivo, peso al nacer de 1680 gramos, varón, cursó con enfermedad de membrana hialina, dismórfico, plaquetopenia, falleció a las 17 horas de vida. El tercero fue pretérmino, de 33 semanas de edad gestacional, peso 2112 gramos, cursó con diagnóstico de taquipnea transitoria, sepsis neonatal, ictericia y trombocitosis. Requirió hospitalización de siete días. El último prematuro fue gemelar I, de 34 semanas de edad gestacional, con 1366 gramos al nacer, cursó con sepsis por Enterobacter spp, meningoencefalitis, neumonía, shock multifactorial, ictericia por incompatibilidad de grupo sanguíneo, acidosis metabólica, hiponatremia, apnea, trastorno de coagulación, anemia severa. Estuvo hospitalizado por 45 días.
Tabla 1. Características maternas de recién nacidos con COVID-19.
Tabla 2. Características perinatales de recién nacidos con COVID-19.
De los otros cinco neonatos que requirieron hospitalización, dos nacieron por cesárea debido a sufrimiento fetal en un caso y malformación congénita cerebral el segundo. De estos, tres fueron de sexo masculino, uno de ellos bajo peso al nacer. Dos pacientes presentaron malformación congénita del sistema nervioso central (encefalocele e hidrocefalia congénita) y fueron intervenidos quirúrgicamente. Además, presentaron sepsis neonatal, uno de ellos por estafilococo coagulasa negativo, ictericia y anemia. Un paciente cursó con sepsis neonatal, neumonía, hipertensión pulmonar, enfermedad pulmonar crónica y anemia. Estos tres bebés requirieron hospitalización entre 48 y 160 días. Los otros dos pacientes cursaron con hipoglicemia y policitemia, requiriendo de hospitalización entre dos y seis días.
En los nueve neonatos hospitalizados se realizó prueba control de PCR-TR para SARS-CoV-2. De ellos, ocho tuvieron PCR-TR negativo para SARS CoV2 entre los cinco y diez días de vida. Uno permaneció positivo a los 11 días de vida y se negativizó a los 18 días de vida.
Durante el periodo de seguimiento remoto, dos pacientes se encontraban hospitalizados y a tres pacientes no se les logró ubicar, pese a múltiples llamadas telefónicas. Finalmente, se estableció contacto telefónico con 28 pacientes. Uno de los niños tenía un sistema de drenaje ventrículo peritoneal operativo. En tres casos se reportó la presencia de algún familiar con el diagnóstico de COVID-19. El 64,3% recibía lactancia materna exclusiva, 28,6% lactancia mixta y 7,1% usaba un sucedáneo.
Durante el seguimiento remoto en la primera semana de vida, dos de los casos que no recibían lactancia materna exclusiva presentaron signología respiratoria alta, congestión nasal y fiebre que revirtió sin requerir tratamiento. Estos síntomas podrían estar relacionados a su infección por COVID-19. Otros dos niños que recibían alimentación mixta desarrollaron intercurrencia respiratoria alta por más de 15 días post alta, cuadro que también se autolimitó. Los 18 pacientes que recibieron lactancia materna exclusiva no presentaron morbilidad durante el período de seguimiento. Las madres reportaron a sus bebés asintomáticos al momento del contacto telefónico (Tabla 3).
Para la evaluación presencial se invitó a todos los recién nacidos que fueron seguidos de forma remota. Dadas las dificultades de movilización y riesgo de exposición al salir de casa (además de los distritos alejados del cercado de Lima en dos de los casos), solo acudieron a la evaluación presencial 18 lactantes que presentaban entre uno y cuatro meses de edad. Al momento de la evaluación presencial el 100% se encontraba asintomático, con examen físico normal, curva ponderal, talla, perímetro cefálico en los percentiles adecuados para la edad. El 83,3% de infantes contaba con inmunización completa para la edad. El 100% de los infantes tuvo prueba de PCR-TR de control para coronavirus negativo. El 38,9% tuvo prueba serológica (IgM, IgG) negativa y 61,1% IgG positivo. En un caso no se realizó prueba serológica. Predominó la lactancia materna exclusiva en el 61,1% de los lactantes (Tabla 4).
Discusión
En el estudio, la detección de infección por COVID-19 en recién nacidos fue infrecuente (2,3%). Los recién nacidos con infección de SARS-CoV-2 en su mayoría no presentaron morbilidad (73,5%). No se evidenciaron complicaciones perinatales respecto a la vía de parto, contacto piel a piel, lactancia materna, tampoco en el seguimiento de los infantes que continuaron con lactancia materna. El bajo reporte de infección de SARS-CoV-2 en neonatos es congruente con estudios previos [13],[16]; sin embargo, la presentación clínica es variable [16],[17],[18].
En las madres de los recién nacidos que participaron en el estudio, la infección por el SARS-CoV-2 no fue la principal indicación de cesárea. La cesárea estuvo presente en 29,4% (10) de los casos, nueve de ellas por motivos obstétricos, uno por diagnóstico de neumonía por SARS-CoV-2. El 8,8% (3) tuvo clínica respiratoria por COVID-19, 2 presentaron sinología respiratoria alta y solo un caso de neumonía. Este resultado es similar a lo reportado en un estudio multicéntrico, que reportó 26% de cesáreas que en su mayoría fueron clínica respiratoria alta [19].
En nuestra población encontramos que 26,5% de recién nacidos con infección de COVID-19 presentó morbilidad, con síntomas respiratorios, trastornos hematológicos, ictericia, sepsis y malformaciones congénitas. En revisiones sistemáticas se han reportado una mayor frecuencia de morbilidad en neonatos con COVID-19. Raschetti y colaboradores [17] reportaron que 55,1% de los neonatos infectados presentaron síntomas durante su hospitalización. Dhir y colaboradores [18], en otra revisión sistemática, concluyen que el 50% de los neonatos infectados presentaron alguna sintomatología, siendo los síntomas respiratorios los más frecuentes (70%). Las características clínicas más habituales encontradas en revisiones sistemáticas fueron síntomas respiratorios. En menor medida se encontraron el letargo, síntomas gastrointestinales, fiebre y síntomas neurológicos [17],[18]. Estas diferencias respecto a nuestro estudio pueden deberse a la carga viral y severidad en la condición materna [8]. Adicionalmente, en nuestro estudio damos a conocer la presencia de malformaciones congénitas (8,8%). Esto es mayor que lo reportado en un estudio observacional retrospectivo efectuado en la misma institución en 2018, donde se encontró una prevalencia de 1,9% de malformaciones congénitas [19].
En un estudio multicéntrico se reportó que los hijos de madres infectadas presentan un mayor riesgo de parto prematuro [20]. En la etapa perinatal encontramos 20,6% de bajo peso y 11,8% prematuros. Otros estudios indican que la mayoría de neonatos infectados son asintomáticos y los resultados perinatales dependen sobre todo de las morbilidades asociadas a su condición, como prematuridad, malformaciones, entre otras infecciones perinatales [13],[21],[22].
Los neonatos han tenido lactancia materna y el contacto piel a piel, considerando medidas de higiene de manos y uso de mascarilla. Estas prácticas se respaldaron en las pautas dadas por la sociedad Española de neonatología, el Fondo de las Naciones Unidas para la Infancia (UNICEF), la OMS, la Organización Panamericana de la Salud (OPS), la Sociedad Iberoamericana de Neonatología (SIBEN), y la mayoría de organizaciones internacionales [1],[10],[23],[24]. Estudios actuales mencionaron que la mayoría de los recién nacidos, hijos de madre COVD-19, compartieron alojamiento conjunto y prácticas de lactancia materna sin detectar transmisión de Covid-19 durante el seguimiento del primer mes de vida [19]. Por otro lado, escasos reportes de hijos de madres infectadas con SARS-CoV-2 que amamantan a sus recién nacidos, reportan infección horizontal [25]. En nuestro estudio se realizó seguimiento entre uno y cuatro meses, no reportando complicaciones tras la lactancia materna.
Los estudios de seguimiento de recién nacidos, hijos de madres Covid-19 son limitados, más aún en recién nacidos de infección confirmada por pruebas de PCR-TR. En el presente estudio se pudo realizar un seguimiento remoto al 82,4% de recién nacidos con la infección de COVID-19 identificado por PCR-TR, en el cual acudieron a evaluación presencial el 53% entre uno a cuatro meses de edad. Existe limitada evidencia en estudios de seguimiento, reportándose a corto plazo resultados favorables en recién nacidos asintomáticos que pudieron continuar en alojamiento conjunto con sus madres y recibiendo lactancia materna [26]. Similares resultados se confirman con el presente estudio, incluso en un tiempo de seguimiento posterior al alta hospitalaria.
La inmunización de rutina, las visitas de seguimiento de recién nacidos y bebés de alto riesgo para la identificación temprana del retraso en el desarrollo, se han visto afectadas por la pandemia de COVID-19 [27]. A pesar del limitado acceso y condiciones de esta pandemia, en nuestro medio se ha obtenido un 83,3% de inmunización completa para la edad y los niños que acudieron a evaluación presencial estaban en condiciones de crecimiento y desarrollo normal, sin evidencia de patología.
Durante la evaluación presencial en infantes entre uno y cuatro meses de edad, ninguno presentó un resultado positivo a la prueba de PCR-TR. Mientras que en la prueba serológica, el 61,1% presentó resultado IgG positivo y el 38,9% tuvo un resultado serológico negativo para el SARS-CoV-2. En general,
se evidenció un buen pronóstico en infantes que tuvieron la infección por SARS-CoV-2 al nacer. Estos hallazgos son similares a otros reportes, donde los neonatos con infección por SARS-CoV-2 estaban asintomáticos o presentaban síntomas leves y tenían un buen pronóstico en un seguimiento a corto plazo menor a un mes [28]. Sin embargo, la evidencia de secuelas en estos casos de infección de recién nacidos en un tiempo mayor es limitada en la literatura [12].
Con respecto a las limitaciones en el presente estudio consideramos el número bajo de participantes, debido a la infrecuencia de la detección de COVID-19 en recién nacidos. A pesar del plan de seguimiento, no se logró contactar con la totalidad de participantes durante el seguimiento. El presente estudio fue un seguimiento prospectivo, ingresando al estudio los recién nacidos de forma cronológica según la detección del SARS-CoV-2, por lo que se reportan resultados del conjunto de participantes con un rango de edad entre uno y cuatro meses.
Conclusiones
Los hallazgos encontrados en el presente estudio sugieren que la infección por COVID-19 en recién nacidos es poco frecuente. En nuestro estudio alcanzó al 2,3%; donde la mayoría de casos positivos fueron asintomáticos. Asimismo, la baja detección de SARS-CoV-2 sugiere la baja frecuencia de una posible transmisión vertical y/o transmisión horizontal post parto considerando medidas de protección.
La morbilidad asociada en recién nacidos es similar a la población neonatal general, predominando el compromiso respiratorio. El parto vaginal, la lactancia materna y aislamiento conjunto en el manejo del binomio madre-niño no evidenciaron complicaciones por COVID-19 en los hallazgos.
Asimismo, la lactancia materna y el contacto del recién nacido con la madre durante el presente seguimiento no reportaron complicaciones posteriores por COVID-19. El seguimiento remoto y evaluación presencial permitió conocer la evolución clínica de los lactantes. Por este motivo, se recomienda su realización para contribuir a un mayor apego al control del niño, así como a las inmunizaciones completas para la edad.
Notas
Autoría
CDA, ETM, RPZ, RHP, YEV: conceptualización, gestión de datos, investigación, supervisión, presentación de datos, preparación de manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones), aprobación de la versión final del artículo. EMI, DM, MES, JDD, PAO: conceptualización, investigación, presentación de datos, redacción (revisiones y ediciones), aprobación de la versión final del artículo.
Agradecimientos
Los autores expresan su agradecimiento a las madres y sus niños que participaron en el seguimiento. Asimismo, al personal de salud del Instituto Nacional Materno Perinatal de Perú.
Instituto Nacional Materno Perinatal: contribuyó con el campo clínico y disponibilidad de recurso humano para la realización del presente estudio. Universidad Nacional Federico Villareal: contribuyó con disponibilidad de recurso humano en horarios lectivos para dedicación a la realización del presente estudio. Universidad Privada del Norte: contribuyó con disponibilidad de recurso humano en horarios lectivos para dedicación a la realización del presente estudio. Universidad Ricardo Palma: contribuyó con disponibilidad de recurso humano en horarios lectivos para dedicación a la realización del presente estudio.
Conflictos de intereses
Los autores completaron el formulario de declaración de conflictos de intereses del ICMJE, y declararon que no recibieron fondos por la realización de este artículo; no tienen relaciones financieras con organizaciones que puedan tener interés en el artículo publicado en los últimos tres años y no tienen otras relaciones o actividades que puedan influenciar en la publicación del artículo.
Financiamiento
Los autores declaran que no recibieron financiamiento económico para la realización de este estudio.
Aspectos éticos
El estudio se realizó conforme a las pautas éticas internacionales para la investigación relacionada con la salud con seres humanos, Cuarta Edición. Ginebra: Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS); 2016. El protocolo del estudio fue aprobado por el Comité Institucional de Ética del Instituto Nacional Materno Perinatal (INMP) de Perú. El protocolo obtuvo el permiso para la obtención de la información en condiciones de la actual pandemia por COVID-19, y la ausencia de riesgos asociados para los pacientes. La confidencialidad de los datos fue resguardada a través de un proceso de anonimización de la base de datos mediante codificación de la identidad.
Origen y arbitraje
No solicitado. Con revisión por pares externa, por tres árbitros a doble ciego.
Idioma del envío
Español.
Disponibilidad de los datos
Los datos utilizados para el presente estudio se encuentran disponibles previa solicitud.

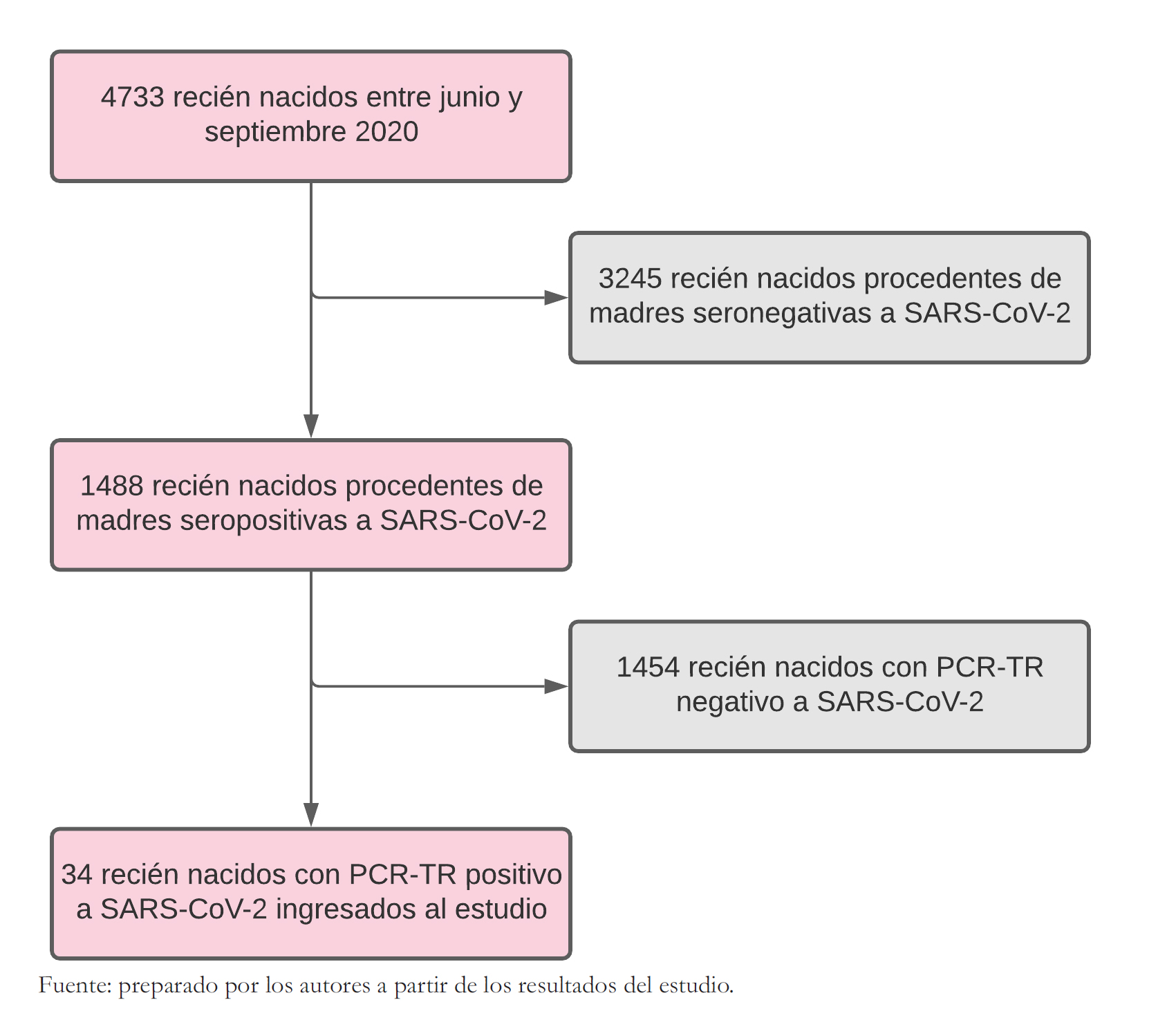 Figura 1. Flujograma de selección de recién nacidos incluidos en el estudio.
Figura 1. Flujograma de selección de recién nacidos incluidos en el estudio.

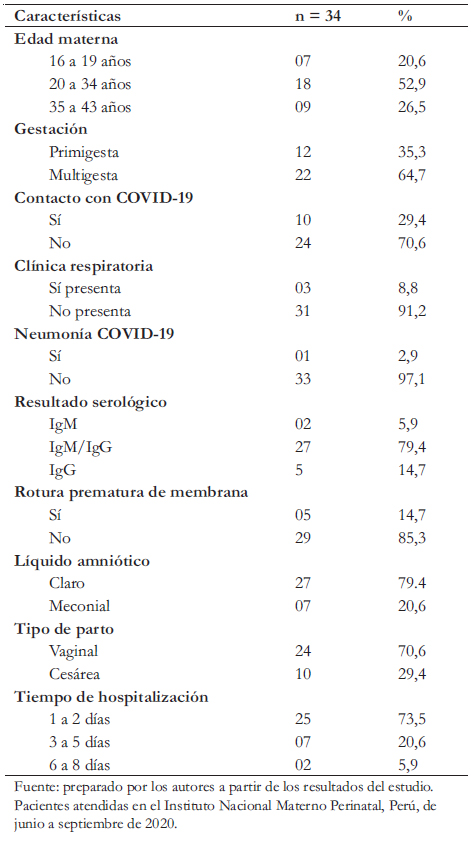 Tabla 1. Características maternas de recién nacidos con COVID-19.
Tabla 1. Características maternas de recién nacidos con COVID-19.

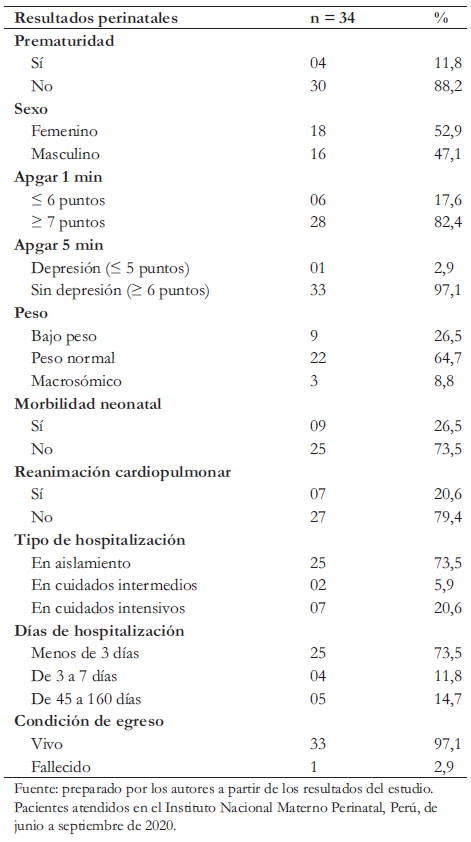 Tabla 2. Características perinatales de recién nacidos con COVID-19.
Tabla 2. Características perinatales de recién nacidos con COVID-19.

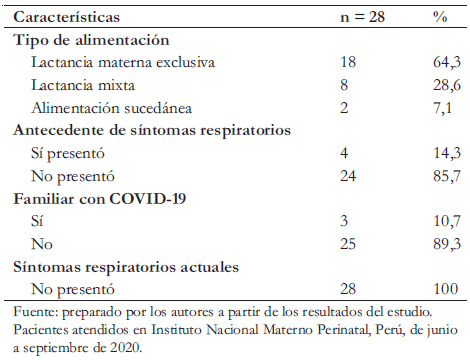 Tabla 3. Caracterización de infantes con infección por COVID-19 al nacimiento, en seguimiento remoto post alta.
Tabla 3. Caracterización de infantes con infección por COVID-19 al nacimiento, en seguimiento remoto post alta.

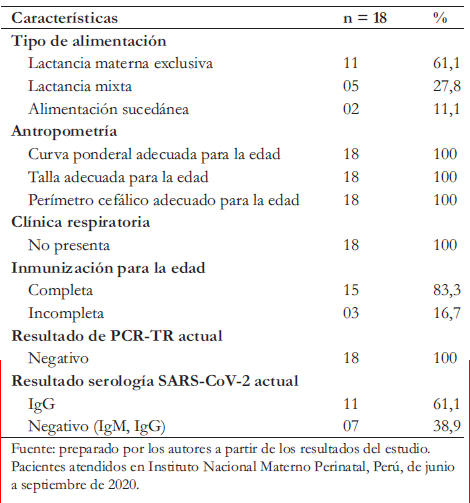 Tabla 4. Caracterización de infantes con infección por COVID-19 al nacimiento, en seguimiento presencial post alta.
Tabla 4. Caracterización de infantes con infección por COVID-19 al nacimiento, en seguimiento presencial post alta.

Introducción
La enfermedad por COVID-19 ha sido reportada en recién nacidos; sin embargo, aún no son claros sus efectos en el seguimiento de neonatos.
Objetivo
Describir las características clínicas, epidemiológicas y el seguimiento de recién nacidos infectados con SARS-CoV-2.
Métodos
Estudio observacional y descriptivo. Participaron recién nacidos que tuvieron PCR-TR positivo a SARS-CoV-2, hijos de madres seropositivas a SARS-CoV-2. La atención del parto y del recién nacido fueron en el Instituto Nacional Materno Perinatal de Perú, entre el 1 de junio y el 30 de septiembre de 2020. Se recogió información perinatal de registros médicos. Se realizó seguimiento remoto y evaluación presencial para descripción epidemiológica, clínica y resultados de pruebas serológicas y PCR-TR para SARS-CoV-2. En el análisis se usó estadística descriptiva.
Resultados
Durante el período de estudio nacieron 4733 recién nacidos. De estos niños, 1488 (31,4%) procedieron de gestantes seropositivas a SARS-CoV-2 y de ellos 34 (2,3%) tuvieron PCR-TR positivo a SARS-CoV-2. De los 34 recién nacidos 29,4% nació por cesárea, 26,5% tuvo bajo peso, 11,8% fue prematuro 26,5% tuvo indicación de hospitalización por patología y un neonato falleció. De los 34 neonatos, 28 tuvieron seguimiento remoto y de ellos 18 tuvieron además seguimiento presencial post alta. El 64,3% recibía lactancia materna exclusiva, 28,6% lactancia mixta y 7,1% usaba un sucedáneo. La evaluación presencial se realizó entre uno a cuatro meses de edad cronológica. El 100% tuvo prueba de PCR-TR de control para coronavirus negativa y 38,9% tuvo prueba serológica (IgM, IgG) negativa y 61,1% IgG positiva.
Conclusiones
La infección neonatal por SARS-CoV-2 es poco frecuente, la mayoría de infectados fueron asintomáticos. El parto vaginal, la lactancia materna y aislamiento conjunto no reportaron complicaciones en la evolución durante la atención hospitalaria. Los infantes en seguimiento remoto y presencial mostraron evolución clínica favorable durante el período de estudio.
 Authors:
Carmen Dávila-Aliaga[1,2], Elsa Torres-Marcos[1], Rafael Paucar-Zegarra[1], Rosmary Hinojosa-Pérez[1], Ylia Espinoza-Vivas[1], Elina Mendoza-Ibáñez[1], Diego Marín[1], Marcos Espínola-Sánchez[3,4], Jonathan De la Cruz-Dávila[1], Pedro Arango-Ochante[3,5]
Authors:
Carmen Dávila-Aliaga[1,2], Elsa Torres-Marcos[1], Rafael Paucar-Zegarra[1], Rosmary Hinojosa-Pérez[1], Ylia Espinoza-Vivas[1], Elina Mendoza-Ibáñez[1], Diego Marín[1], Marcos Espínola-Sánchez[3,4], Jonathan De la Cruz-Dávila[1], Pedro Arango-Ochante[3,5]
Affiliation:
[1] Departamento de Neonatología, Instituto Nacional Materno Perinatal, Lima, Perú
[2] Facultad de Medicina Humana, Universidad Nacional Federico Villarreal, Lima, Perú
[3] Unidad de Investigación, Instituto Nacional Materno Perinatal, Lima, Perú
[4] Facultad de ciencias de la salud, Universidad Privada del Norte, Lima, Perú
[5] Instituto de Investigaciones en Ciencia Biomédica, Universidad Ricardo Palma, Lima, Perú
E-mail: davilacarmen@hotmail.com

Citation: Dávila-Aliaga C, Torres-Marcos E, Paucar-Zegarra R, Hinojosa-Pérez R, Espinoza-Vivas Y, Mendoza-Ibáñez E, et al. Clinical and epidemiological characterization in the follow-up of newborns with COVID-19: a descriptive study. Medwave 2021;21(11):e002141 doi: 10.5867/medwave.2021.11.002141
Submission date: 10/6/2021
Acceptance date: 17/11/2021
Publication date: 15/12/2021
Origin: Not commissioned
Type of review: Externally peer-reviewed by three reviewers, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Organization WH. Coronavirus disease 2019 (COVID-19): situation report, 82. 2020 | Link |
- Kallem VR, Sharma D. COVID 19 in neonates. J Matern Fetal Neonatal Med 2020;1–9. | Link |
- Wilde AH de, Snijder EJ, Kikkert M, Hemert MJ van. Host factors in coronavirus replication. Curr Top Microbiol Immunol. 2018; 419:1–42. | CrossRef |
- Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020; 382(8):727–733. https://doi.org/10.1056/NEJMoa2001017
- Kyle MH, Glassman ME, Khan A, Fernández CR, Hanft E, Emeruwa UN, et al. A review of newborn outcomes during the COVID-19 pandemic. Semin Perinatol. 2020; 44(7):151286. | CrossRef |
- Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. The Lancet. 2020; 395 (10226):809–815. | CrossRef |
- Chen X, Li Y, Wang J, Cai H, Cao H, Sheng J. Pregnant women complicated with COVID-19: a clinical analysis of 3 cases. Univ Med Sci. 2020;49(2):240–244. | CrossRef |
- Walker KF, O'Donoghue K, Grace N, Dorling J, Comeau JL, Li W, et al. Maternal transmission of SARS‐COV‐2 to the neonate, and possible routes for such transmission: a systematic review and critical analysis. BJOG Int J Obstet Gynaecol 2020;127(11):1324–1336. | CrossRef |
- Dong L, Tian J, He S, Zhu C, Wang J, Liu C, et al. Possible Vertical Transmission of SARS-CoV-2 From an Infected Mother to Her Newborn. JAMA. 2020; 323(18): 1846-1848. | CrossRef |
- Wang L, Shi Y, Xiao T, Fu J, Feng X, Mu D, et al. Chinese expert consensus on the perinatal and neonatal management for the prevention and control of the 2019 novel coronavirus infection (First edition). Ann Transl Med. 2020; 8(3):47. | CrossRef |
- Cui X, Zhao Z, Zhang T, Guo W, Guo W, Zheng J, et al. A systematic review and meta-analysis of children with coronavirus disease 2019 (COVID-19). J Med Virol. 2021; 93(2): 1057-1069. | CrossRef |
- Denina M, Pruccoli G, Scolfaro C, Mignone F, Zoppo M, Giraudo I, et al. Sequelae of COVID-19 in Hospitalized Children: A 4-Months Follow-Up. Pediatr Infect Dis J. 2020; 39(12): e458-e459. | CrossRef |
- Dávila-Aliaga C, Hinojoza-Pérez R, Espinola-Sánchez M, et al. Resultados materno-perinatales en gestantes con COVID-19 en un hospital nivel III del Perú. Rev Peru Med Exp Salud Pública 2021;38(1):58–63. | CrossRef |
- Giuliani C, Li Volsi P, Brun E, Chiambretti A, Giandalia A, Tonutti L, et al. Breastfeeding during the COVID-19 pandemic: Suggestions on behalf of woman study group of AMD. Diabetes Res Clin Pract. 2020; 165: 108239. | CrossRef |
- Barrero-Castillero A, Beam KS, Bernardini LB, Ramos EGC, Davenport PE, Duncan AR, et al. COVID-19: neonatal-perinatal perspectives. J Perinatol. 2021; 41(5): 940-951. | CrossRef |
- Chawla D, Chirla D, Dalwai S, Deorari AK, Ganatra A, Gandhi A, et al. Perinatal-Neonatal Management of COVID-19 Infection - Guidelines of the Federation of Obstetric and Gynaecological Societies of India (FOGSI), National Neonatology Forum of India (NNF), and Indian Academy of Pediatrics (IAP). Indian Pediatr. 2020; 57(6): 536-548. | CrossRef |
- Raschetti R, Vivanti AJ, Vauloup-Fellous C, Loi B, Benachi A, De Luca D. Synthesis and systematic review of reported neonatal SARS-CoV-2 infections. Nat Commun 2020;11(1):5164. | CrossRef |
- Dhir SK, Kumar J, Meena J, Kumar P. Clinical Features and Outcome of SARS-CoV-2 Infection in Neonates: A Systematic Review. J Trop Pediatr 2020; fmaa059. | CrossRef |
- Ayala FD, Guevara E, Carranza C, Luna A, Espinola-Sanchez M, Racchumí A, et al. Factores asociados a malformaciones congénitas. Rev Peru Investig Matern Perinat. 2019;8(4): 30-40. | CrossRef |
- Marín Gabriel MA, Reyne Vergeli M, Caserío Carbonero S, Sole L, Carrizosa Molina T, Rivero Calle I, et al. Maternal, Perinatal and Neonatal Outcomes With COVID-19: A Multicenter Study of 242 Pregnancies and Their 248 Infant Newborns During Their First Month of Life. Pediatr Infect Dis J. 2020; 39(12):e393-e397. | CrossRef |
- Dávila-Aliaga C, Espínola-Sánchez M, Mendoza-Ibáñez E, et al. Perinatal outcomes and serological results in neonates of pregnant women seropositive to SARS-CoV-2: A cross-sectional descriptive study. Medwave 2020;20(11):e8084–e8084. | CrossRef |
- Gale C, Quigley MA, Placzek A, Knight M, Ladhani S, Draper ES, et al. Characteristics and outcomes of neonatal SARS-CoV-2 infection in the UK: a prospective national cohort study using active surveillance. Lancet Child Adolesc Health. 2021; 5(2):113-121. | CrossRef |
- Dumitriu D, Emeruwa UN, Hanft E, Liao GV, Ludwig E, Walzer L, et al. Outcomes of Neonates Born to Mothers With Severe Acute Respiratory Syndrome Coronavirus 2 Infection at a Large Medical Center in New York City. JAMA Pediatr. 2021;175(2):157-167. | CrossRef |
- Asociación Española de Pediatría. Recomendaciones para el manejo del recién nacido en relación con la infección por SARS-CoV-2. 2020 | Link |
- Sola A, Rodríguez S, Cardetti M, Dávila C. COVID-19 perinatal en América Latina. Rev Panam Salud Pública 2020;44:1. | CrossRef |
- Salvatore CM, Han JY, Acker KP, Tiwari P, Jin J, Brandler M, et al. Neonatal management and outcomes during the COVID-19 pandemic: an observation cohort study. Lancet Child Adolesc Health. 2020; 4(10):721-727. | CrossRef |
- Saini L, Madaan P, Bhagwat C, Einspieler C. Home-Videos for Neurodevelopmental Follow-Up of High-Risk Infants during COVID-19 Pandemic: A Simple and Inexpensive Tool. J Trop Pediatr. 2021 Jan 29;67(1): fmaa088. | CrossRef |
- Guo L, Ren L, Yang S, Xiao M, Chang D, Yang F, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clin Infect Dis. 2020; 71(15):778-785. | CrossRef |
 Wilde AH de, Snijder EJ, Kikkert M, Hemert MJ van. Host factors in coronavirus replication. Curr Top Microbiol Immunol. 2018; 419:1–42. | CrossRef |
Wilde AH de, Snijder EJ, Kikkert M, Hemert MJ van. Host factors in coronavirus replication. Curr Top Microbiol Immunol. 2018; 419:1–42. | CrossRef | Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020; 382(8):727–733. https://doi.org/10.1056/NEJMoa2001017
Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020; 382(8):727–733. https://doi.org/10.1056/NEJMoa2001017  Kyle MH, Glassman ME, Khan A, Fernández CR, Hanft E, Emeruwa UN, et al. A review of newborn outcomes during the COVID-19 pandemic. Semin Perinatol. 2020; 44(7):151286. | CrossRef |
Kyle MH, Glassman ME, Khan A, Fernández CR, Hanft E, Emeruwa UN, et al. A review of newborn outcomes during the COVID-19 pandemic. Semin Perinatol. 2020; 44(7):151286. | CrossRef | Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. The Lancet. 2020; 395 (10226):809–815. | CrossRef |
Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. The Lancet. 2020; 395 (10226):809–815. | CrossRef | Chen X, Li Y, Wang J, Cai H, Cao H, Sheng J. Pregnant women complicated with COVID-19: a clinical analysis of 3 cases. Univ Med Sci. 2020;49(2):240–244. | CrossRef |
Chen X, Li Y, Wang J, Cai H, Cao H, Sheng J. Pregnant women complicated with COVID-19: a clinical analysis of 3 cases. Univ Med Sci. 2020;49(2):240–244. | CrossRef | Walker KF, O'Donoghue K, Grace N, Dorling J, Comeau JL, Li W, et al. Maternal transmission of SARS‐COV‐2 to the neonate, and possible routes for such transmission: a systematic review and critical analysis. BJOG Int J Obstet Gynaecol 2020;127(11):1324–1336. | CrossRef |
Walker KF, O'Donoghue K, Grace N, Dorling J, Comeau JL, Li W, et al. Maternal transmission of SARS‐COV‐2 to the neonate, and possible routes for such transmission: a systematic review and critical analysis. BJOG Int J Obstet Gynaecol 2020;127(11):1324–1336. | CrossRef | Dong L, Tian J, He S, Zhu C, Wang J, Liu C, et al. Possible Vertical Transmission of SARS-CoV-2 From an Infected Mother to Her Newborn. JAMA. 2020; 323(18): 1846-1848. | CrossRef |
Dong L, Tian J, He S, Zhu C, Wang J, Liu C, et al. Possible Vertical Transmission of SARS-CoV-2 From an Infected Mother to Her Newborn. JAMA. 2020; 323(18): 1846-1848. | CrossRef | Wang L, Shi Y, Xiao T, Fu J, Feng X, Mu D, et al. Chinese expert consensus on the perinatal and neonatal management for the prevention and control of the 2019 novel coronavirus infection (First edition). Ann Transl Med. 2020; 8(3):47. | CrossRef |
Wang L, Shi Y, Xiao T, Fu J, Feng X, Mu D, et al. Chinese expert consensus on the perinatal and neonatal management for the prevention and control of the 2019 novel coronavirus infection (First edition). Ann Transl Med. 2020; 8(3):47. | CrossRef | Cui X, Zhao Z, Zhang T, Guo W, Guo W, Zheng J, et al. A systematic review and meta-analysis of children with coronavirus disease 2019 (COVID-19). J Med Virol. 2021; 93(2): 1057-1069. | CrossRef |
Cui X, Zhao Z, Zhang T, Guo W, Guo W, Zheng J, et al. A systematic review and meta-analysis of children with coronavirus disease 2019 (COVID-19). J Med Virol. 2021; 93(2): 1057-1069. | CrossRef | Denina M, Pruccoli G, Scolfaro C, Mignone F, Zoppo M, Giraudo I, et al. Sequelae of COVID-19 in Hospitalized Children: A 4-Months Follow-Up. Pediatr Infect Dis J. 2020; 39(12): e458-e459. | CrossRef |
Denina M, Pruccoli G, Scolfaro C, Mignone F, Zoppo M, Giraudo I, et al. Sequelae of COVID-19 in Hospitalized Children: A 4-Months Follow-Up. Pediatr Infect Dis J. 2020; 39(12): e458-e459. | CrossRef | Dávila-Aliaga C, Hinojoza-Pérez R, Espinola-Sánchez M, et al. Resultados materno-perinatales en gestantes con COVID-19 en un hospital nivel III del Perú. Rev Peru Med Exp Salud Pública 2021;38(1):58–63. | CrossRef |
Dávila-Aliaga C, Hinojoza-Pérez R, Espinola-Sánchez M, et al. Resultados materno-perinatales en gestantes con COVID-19 en un hospital nivel III del Perú. Rev Peru Med Exp Salud Pública 2021;38(1):58–63. | CrossRef | Giuliani C, Li Volsi P, Brun E, Chiambretti A, Giandalia A, Tonutti L, et al. Breastfeeding during the COVID-19 pandemic: Suggestions on behalf of woman study group of AMD. Diabetes Res Clin Pract. 2020; 165: 108239. | CrossRef |
Giuliani C, Li Volsi P, Brun E, Chiambretti A, Giandalia A, Tonutti L, et al. Breastfeeding during the COVID-19 pandemic: Suggestions on behalf of woman study group of AMD. Diabetes Res Clin Pract. 2020; 165: 108239. | CrossRef | Barrero-Castillero A, Beam KS, Bernardini LB, Ramos EGC, Davenport PE, Duncan AR, et al. COVID-19: neonatal-perinatal perspectives. J Perinatol. 2021; 41(5): 940-951. | CrossRef |
Barrero-Castillero A, Beam KS, Bernardini LB, Ramos EGC, Davenport PE, Duncan AR, et al. COVID-19: neonatal-perinatal perspectives. J Perinatol. 2021; 41(5): 940-951. | CrossRef | Chawla D, Chirla D, Dalwai S, Deorari AK, Ganatra A, Gandhi A, et al. Perinatal-Neonatal Management of COVID-19 Infection - Guidelines of the Federation of Obstetric and Gynaecological Societies of India (FOGSI), National Neonatology Forum of India (NNF), and Indian Academy of Pediatrics (IAP). Indian Pediatr. 2020; 57(6): 536-548. | CrossRef |
Chawla D, Chirla D, Dalwai S, Deorari AK, Ganatra A, Gandhi A, et al. Perinatal-Neonatal Management of COVID-19 Infection - Guidelines of the Federation of Obstetric and Gynaecological Societies of India (FOGSI), National Neonatology Forum of India (NNF), and Indian Academy of Pediatrics (IAP). Indian Pediatr. 2020; 57(6): 536-548. | CrossRef | Raschetti R, Vivanti AJ, Vauloup-Fellous C, Loi B, Benachi A, De Luca D. Synthesis and systematic review of reported neonatal SARS-CoV-2 infections. Nat Commun 2020;11(1):5164. | CrossRef |
Raschetti R, Vivanti AJ, Vauloup-Fellous C, Loi B, Benachi A, De Luca D. Synthesis and systematic review of reported neonatal SARS-CoV-2 infections. Nat Commun 2020;11(1):5164. | CrossRef | Dhir SK, Kumar J, Meena J, Kumar P. Clinical Features and Outcome of SARS-CoV-2 Infection in Neonates: A Systematic Review. J Trop Pediatr 2020; fmaa059. | CrossRef |
Dhir SK, Kumar J, Meena J, Kumar P. Clinical Features and Outcome of SARS-CoV-2 Infection in Neonates: A Systematic Review. J Trop Pediatr 2020; fmaa059. | CrossRef | Ayala FD, Guevara E, Carranza C, Luna A, Espinola-Sanchez M, Racchumí A, et al. Factores asociados a malformaciones congénitas. Rev Peru Investig Matern Perinat. 2019;8(4): 30-40. | CrossRef |
Ayala FD, Guevara E, Carranza C, Luna A, Espinola-Sanchez M, Racchumí A, et al. Factores asociados a malformaciones congénitas. Rev Peru Investig Matern Perinat. 2019;8(4): 30-40. | CrossRef | Marín Gabriel MA, Reyne Vergeli M, Caserío Carbonero S, Sole L, Carrizosa Molina T, Rivero Calle I, et al. Maternal, Perinatal and Neonatal Outcomes With COVID-19: A Multicenter Study of 242 Pregnancies and Their 248 Infant Newborns During Their First Month of Life. Pediatr Infect Dis J. 2020; 39(12):e393-e397. | CrossRef |
Marín Gabriel MA, Reyne Vergeli M, Caserío Carbonero S, Sole L, Carrizosa Molina T, Rivero Calle I, et al. Maternal, Perinatal and Neonatal Outcomes With COVID-19: A Multicenter Study of 242 Pregnancies and Their 248 Infant Newborns During Their First Month of Life. Pediatr Infect Dis J. 2020; 39(12):e393-e397. | CrossRef | Dávila-Aliaga C, Espínola-Sánchez M, Mendoza-Ibáñez E, et al. Perinatal outcomes and serological results in neonates of pregnant women seropositive to SARS-CoV-2: A cross-sectional descriptive study. Medwave 2020;20(11):e8084–e8084. | CrossRef |
Dávila-Aliaga C, Espínola-Sánchez M, Mendoza-Ibáñez E, et al. Perinatal outcomes and serological results in neonates of pregnant women seropositive to SARS-CoV-2: A cross-sectional descriptive study. Medwave 2020;20(11):e8084–e8084. | CrossRef | Gale C, Quigley MA, Placzek A, Knight M, Ladhani S, Draper ES, et al. Characteristics and outcomes of neonatal SARS-CoV-2 infection in the UK: a prospective national cohort study using active surveillance. Lancet Child Adolesc Health. 2021; 5(2):113-121. | CrossRef |
Gale C, Quigley MA, Placzek A, Knight M, Ladhani S, Draper ES, et al. Characteristics and outcomes of neonatal SARS-CoV-2 infection in the UK: a prospective national cohort study using active surveillance. Lancet Child Adolesc Health. 2021; 5(2):113-121. | CrossRef | Dumitriu D, Emeruwa UN, Hanft E, Liao GV, Ludwig E, Walzer L, et al. Outcomes of Neonates Born to Mothers With Severe Acute Respiratory Syndrome Coronavirus 2 Infection at a Large Medical Center in New York City. JAMA Pediatr. 2021;175(2):157-167. | CrossRef |
Dumitriu D, Emeruwa UN, Hanft E, Liao GV, Ludwig E, Walzer L, et al. Outcomes of Neonates Born to Mothers With Severe Acute Respiratory Syndrome Coronavirus 2 Infection at a Large Medical Center in New York City. JAMA Pediatr. 2021;175(2):157-167. | CrossRef | Asociación Española de Pediatría. Recomendaciones para el manejo del recién nacido en relación con la infección por SARS-CoV-2. 2020 | Link |
Asociación Española de Pediatría. Recomendaciones para el manejo del recién nacido en relación con la infección por SARS-CoV-2. 2020 | Link | Sola A, Rodríguez S, Cardetti M, Dávila C. COVID-19 perinatal en América Latina. Rev Panam Salud Pública 2020;44:1. | CrossRef |
Sola A, Rodríguez S, Cardetti M, Dávila C. COVID-19 perinatal en América Latina. Rev Panam Salud Pública 2020;44:1. | CrossRef | Salvatore CM, Han JY, Acker KP, Tiwari P, Jin J, Brandler M, et al. Neonatal management and outcomes during the COVID-19 pandemic: an observation cohort study. Lancet Child Adolesc Health. 2020; 4(10):721-727. | CrossRef |
Salvatore CM, Han JY, Acker KP, Tiwari P, Jin J, Brandler M, et al. Neonatal management and outcomes during the COVID-19 pandemic: an observation cohort study. Lancet Child Adolesc Health. 2020; 4(10):721-727. | CrossRef | Saini L, Madaan P, Bhagwat C, Einspieler C. Home-Videos for Neurodevelopmental Follow-Up of High-Risk Infants during COVID-19 Pandemic: A Simple and Inexpensive Tool. J Trop Pediatr. 2021 Jan 29;67(1): fmaa088. | CrossRef |
Saini L, Madaan P, Bhagwat C, Einspieler C. Home-Videos for Neurodevelopmental Follow-Up of High-Risk Infants during COVID-19 Pandemic: A Simple and Inexpensive Tool. J Trop Pediatr. 2021 Jan 29;67(1): fmaa088. | CrossRef | Guo L, Ren L, Yang S, Xiao M, Chang D, Yang F, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clin Infect Dis. 2020; 71(15):778-785. | CrossRef |
Guo L, Ren L, Yang S, Xiao M, Chang D, Yang F, et al. Profiling Early Humoral Response to Diagnose Novel Coronavirus Disease (COVID-19). Clin Infect Dis. 2020; 71(15):778-785. | CrossRef |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis









