Key Words: stress fracture, magnetic resonance imaging, athletic injury, overuse injury
Resumen
Introducción
Las fracturas por estrés son lesiones producidas por el sobreuso de ciertas extremidades, generando fatigas repetitivas en el hueso con insuficientes periodos de descanso, trastornos hormonales, entre otras. Se produce una elevada actividad osteoclástica y una menor actividad de los osteoblastos a nivel cortical.
Objetivo
Determinar los factores asociados a fractura por estrés en un centro médico de la Marina de Guerra de Perú.
Metodología
Se realizó una investigación de tipo observacional analítica de casos y controles. La variable dependiente fue la fractura por estrés, confirmada por resonancia magnética de los pacientes. Las variables independientes fueron edad, sexo y nivel de calcemia tomadas a partir de la historia clínica; el nivel socioeconómico y tiempo de actividad física diaria fueron datos recogidos mediante encuesta. Se obtuvieron los Odds ratio crudos y ajustados con un intervalo de confianza de 95%.
Resultados
Se trabajó con un total de 238 pacientes (119 casos y 119 controles), de los cuales 79,8% fueron varones y 20,2% fueron mujeres; la media de edad fue de 20,25 años. En el análisis bivariado se encontró asociación de fracturas por estrés con el sexo masculino (Odds ratio: 3,00; intervalo de confianza 95%: 1,51 a 5,95), hipocalcemia (Odds ratio: 2,83; intervalo de confianza 95%: 2,32 a 3,44), más de dos horas de actividad física diaria (Odds ratio: 24,74; intervalo de confianza 95%: 12,51 a 48,95) y un nivel socioeconómico C (Odds ratio: 6,66; intervalo de confianza 95%: 2,82 a 15,74). Mantuvieron su asociación en el análisis multivariado el tiempo de actividad física (Odds ratio: 44,46; intervalo de confianza 95%: 17,93 a 110,22) y el nivel socioeconómico C (Odds ratio: 22,57; intervalo de confianza 95%: 7,03 a 72,74).
Conclusión
Las fracturas por estrés estuvieron asociadas al tiempo de actividad física y a un nivel socioeconómico menor. Son necesarios más estudios para evaluar la relación con otros factores en la población militar de Perú.
|
Ideas clave
|
Introducción
Las fracturas por estrés son lesiones que se producen generalmente debido al sobreuso de ciertas extremidades o entrenamiento excesivo de alta intensidad, con cargas importantes aplicadas al hueso sin adecuados periodos de descanso. Estos excesos pueden ocasionar un incremento de la actividad de los osteoclastos, generando microtraumas y microfracturas que podrían agravarse en una ruptura cortical real, derivando finalmente en una fractura por estrés[1]. Este tipo de fracturas es responsable entre el 0,7 y el 20% de todas las lesiones en la práctica clínica de medicina deportiva[2]; y representan aproximadamente el 10% de todas las lesiones por uso excesivo en atletas, bailarines y reclutas militares[3],[4].
Normalmente, el hueso se adapta a las cargas mecánicas mediante un proceso de remodelación en el cual los osteoclastos reabsorben el hueso laminar. Así, se crean cavidades de resorción que posteriormente son reemplazadas por los osteoblastos, por huesos más densos[1]. Sin embargo, debido a que existe un retraso entre el aumento de la actividad osteoclástica y la actividad osteoblástica, el hueso se debilita durante este tiempo, lo que aumenta el riesgo de microfracturas[5]. Asimismo, existe evidencia que sugiere que estas fracturas por estrés pueden aparecer como consecuencia de una sobrecarga cíclica pura sin la respuesta de remodelación ósea[6].
Los factores de riesgo para fractura por estrés pueden clasificarse como extrínsecos (externos) o intrínsecos (internos). Las lesiones ocurren como resultado de la suma de varios factores en un momento dado en el tiempo. Dentro de los posibles factores extrínsecos para las fracturas por estrés encontramos el tipo de ejercicio, siendo el más frecuente la carrera a pie o trote[7]. En tanto, algunos de los factores intrínsecos pueden ser mecánicos, como malformaciones en miembros inferiores o fatiga muscular[8]; alteraciones en las hormonas sexuales u otras hormonas que afectan el equilibrio entre la reabsorción y formación ósea[9],[10]; o nutricionales, como dietas con restricción calórica, alcohol, consumo deficitario de calcio o vitamina D[9]. Con respecto a este último, existe un metaanálisis que compara el nivel sérico de esta vitamina liposoluble y la incidencia de fracturas por estrés en nueve estudios observacionales, obteniendo resultados que sugieren cierta asociación entre estas variables[15]. Ello se debe a que el calcio y la vitamina D pueden tener una influencia positiva en la salud ósea, pues la vitamina D contribuye a la absorción de calcio y fósforo del intestino y la reabsorción del hueso[23]. Además de los efectos independientes de un factor de riesgo dado y su mecanismo de contribución a la lesión ósea, son posibles las interacciones entre los factores de riesgo.
Por lo general, las fracturas por estrés se presentan en personas jóvenes activas o sometidas a entrenamiento como atletas, bailarines o reclutas militares[5]. Sin embargo, la mayoría de los estudios realizados sobre esta materia se enfocan en población atleta y una ínfima parte en población militar. De los estudios realizados en población militar, casi su totalidad son americanos o europeos. Por ejemplo, en las fuerzas armadas de los Estados Unidos la incidencia acumulada de fractura por estrés en cuatro años fue de 5,7% para cadetes varones y 19,1% para cadetes femeninas[4], lo que contribuye a una pérdida sustancial de tiempo de entrenamiento. Asimismo, las fracturas por estrés en los reclutas militares suelen ocurrir en tibia, fémur, metatarsianos y pelvis, y se presentan con el inicio insidioso de dolor localizado que empeora con la actividad[11].
Sin embargo, son muy pocos los estudios sobre las fracturas por estrés en población militar de Latinoamérica. Por esta razón es que el presente estudio tiene como objetivo determinar los factores asociados a fractura por estrés en un centro médico de la Marina de Guerra de Perú.
Métodos
Diseño de estudio y contexto
Se realizó una investigación de tipo observacional analítica de casos y controles apareados por edad. Definimos como caso al personal militar en formación hospitalizado en el servicio de traumatología diagnosticado con fractura por estrés mediante evaluación médica y confirmada por resonancia magnética. Se definió como control al personal militar en formación hospitalizado en el servicio de traumatología sin diagnóstico de fractura por estrés. Todos los pacientes, tanto los casos como controles, se obtuvieron del servicio de traumatología y ortopedia del Centro Médico Naval, tomándose los controles simultáneamente en el mismo periodo de estudio.
La variable dependiente fue la fractura por estrés, la cual contó con confirmación diagnóstica mediante resonancia magnética, que es uno de los métodos más sensibles y específicos para el diagnóstico de este tipo de lesión. El signo considerado para diagnosticar una fractura por estrés en una resonancia magnética fue la señal disminuida visualizada en las secuencias T1 y T2, generalmente en forma de trazo que surge de la corteza del hueso y se extiende perpendicular a la superficie, acompañado de reacción perióstica[12].
En lo que respecta a las variables independientes, la edad, el sexo y el nivel de calcemia fueron obtenidos a través de la historia clínica de los pacientes. El nivel socioeconómico y el tiempo de actividad física diaria se recogieron mediante encuesta a los pacientes, previo consentimiento verbal, durante su estancia hospitalaria o vía telefónica si es que ya se encontraban de alta.
El nivel de calcemia fue clasificado en hipocalcemia si era menor de ocho miligramos por decilitro; normocalcemia si era entre ocho y 10 miligramos por decilitro e hipercalcemia si era mayor de 10 miligramos por decilitro. El nivel socioeconómico fue categorizado de acuerdo a los ingresos promedios mensuales de la familia del paciente según la Asociación Peruana de Empresas de Investigación de Mercado[13] siendo como sigue:
Tabla 1. Estudio socioeconómico.
Población y muestra
La población estuvo conformada por los pacientes atendidos en el servicio de traumatología del Centro Médico Naval Cirujano Mayor Santiago Távara durante el año 2016. Se excluyeron a los pacientes que no tenían el historial clínico con las variables completas o los que no hayan contestado las llamadas hechas para la recolección de los datos. El tamaño muestral fue calculado con una fórmula para estudios de casos y controles, tomando una frecuencia esperada del 20%, un Odds ratio previsto de 3,2; una potencia estadística del 80% y un intervalo de confianza del 95%. Lo cual arrojó como resultado un tamaño muestral de 119 casos y 119 controles.
Previo a la recolección de los datos se solicitaron los permisos correspondientes al Comité de Ética en Investigación del Centro Médico Naval Cirujano Mayor Santiago Távara. Una vez otorgados, se procedió a recopilar las historias clínicas de los pacientes seleccionados mediante la aleatorización de la muestra a partir del total de la población del año 2016. Los datos fueron ingresados en una matriz de Microsoft Excel 2016.
Análisis estadístico
Para el análisis estadístico se describieron las variables cualitativas mediante el uso de frecuencias y porcentajes. Asimismo, para las variables cuantitativas se usaron medidas de tendencia central y dispersión, previa evaluación de su normalidad. Para el análisis bivariado se usó la prueba de Chi-cuadrado para determinar la asociación entre dos variables cualitativas y la prueba de t de Student para determinar la asociación entre una variable cualitativa y una cuantitativa de distribución normal; o la prueba de U de Mann-Withney si esta no fue de distribución normal. Se consideró un p < 0,05 como estadísticamente significativo.
Para el análisis multivariado se usó la regresión logística entre las variables que hayan salido asociadas en el análisis bivariado. Aquellas variables de más de dos categorías y las cuantitativas fueron dicotomizadas. Se excluyeron del modelo multivariado las variables cualitativas con frecuencias muy pequeñas que dificulten su análisis. Se hallaron los Odds ratio ajustados con sus respectivos intervalos de confianza al 95%.
Aspectos éticos
El presente trabajo de investigación contó con la aprobación institucional del Centro Médico Naval Cirujano Mayor Santiago Távara y el Instituto de Investigación en Ciencias Biomédicas de la Universidad Ricardo Palma. Los datos fueron confidenciales y manejados solo por los investigadores a través de una base de datos sin acceso a terceros, no se publicaron datos personales ni ningún otro dato que pueda permitir la identificación de los pacientes en el estudio.
Resultados
Se trabajó con un total de 238 personas (119 casos y 119 controles), de las cuales el 79,8% fueron varones y 20,2% mujeres; la media de la edad fue de 20,25 ± 1,5 años. Con respecto al nivel de calcemia, lo más frecuente fue la normocalcemia con un total de 58,4% y, por último, la mayoría, pertenecían al nivel socioeconómico B con un 77,3% (Tabla 2). Se incluyeron en el presente estudio a 105 varones con diagnóstico de fractura por estrés y a 85 varones que no presentaron esta patología, siendo un total de 190 pacientes del sexo masculino. De igual forma se incluyeron a 14 mujeres con diagnóstico de fractura por estrés y 34 mujeres sin esta patología, siendo un total de 48 pacientes del sexo femenino. Del grupo estudiado 54 pacientes presentaron hipocalcemia, 139 normocalcemia y 45 hipercalcemia. Del mismo modo, se determinó que 12 pacientes pertenecían al nivel socioeconómico A, 184 al nivel socioeconómico B y 42 al nivel socioeconómico C (Tabla 3).
En el análisis bivariado, se encontró asociación estadísticamente significativa entre la fractura por estrés y el sexo masculino, la hipocalcemia y un nivel socioeconómico C (Tabla 3). Asimismo, se encontró una relación entre las horas de actividad física por día y las fracturas por estrés (Figura 1).
En la regresión logística binaria, en el análisis multivariado se asoció el realizar más de dos horas actividad física diaria y a pertenecer a un nivel socioeconómico C (Tabla 4).
Tabla 2. Características generales de pacientes incluidos en el estudio.
Tabla 3. Factores asociados a fractura por estrés en pacientes incluidos en el estudio.
Figura 1. Asociación entre edad y horas de actividad física con fractura por estrés.
Discusión
Las fracturas por estrés son lesiones producidas debido al agotamiento físico. Este es un estímulo para la remodelación ósea, afectando la estructura y función a través de mecanismos complejos de mecano-transducción. Este estrés continuo produce microfracturas que, posteriormente, podrían agravarse en una ruptura cortical real o fractura por estrés[1]. Es probable que estos efectos se ejerzan por la modulación de la actividad del eje hipotálamo-hipófisis-suprarrenal, lo que resulta en una liberación alterada de hormonas de crecimiento, glucocorticoides y citoquinas, como se demostró en estudios en humanos y en animales.
En Latinoamérica, y en especial en Perú, existen pocos estudios acerca de las fracturas por estrés; y son menos aún en la población militar[14]. A pesar de ser una patología relativamente frecuente en ciertos grupos de población, no se tienen los datos locales previos acerca de los factores de riesgo para esta condición.
En nuestro estudio no encontramos asociación entre las fracturas por estrés y la variable sexo. Esto se debe probablemente al hecho de que el sexo masculino tiene una frecuencia mayor que la del sexo femenino, dado que el estudio fue en una población militar y la proporción es mayormente masculina. Por este motivo, en este trabajo el sexo no es un factor de riesgo independiente para fractura por estrés.
Estos resultados difieren de lo reportado por un estudio hecho a partir de la Defense Medical Epidemiological Database en la Armada de Estados Unidos de 2009 a 2012, donde se encontró que el sexo femenino tenía un mayor riesgo de fracturas por estrés frente a los varones (riesgo relativo de 3,11)[4]. Así también, otro estudio realizado en población militar, esta vez en reclutas de las fuerzas antiaéreas de Israel, encontró que el riesgo de padecer fracturas por estrés era mayor en mujeres con un riesgo relativo de 2,13[16]. Esto se confirma en otro estudio de tipo revisión sistemática que, además de encontrar dicha diferencia según sexo, reporta que esta existe no solo en población militar, sino también en atletas[17]. La diferencia de la incidencia de las fracturas por estrés encontrada en la bibliografía con respecto al sexo pueden explicarse por estudios que muestran que las mujeres poseen estructuras óseas más pequeñas y menor fuerza muscular[18]. En concordancia con ello, también presentan una menor densidad mineral ósea en comparación con los varones[17],[18], así como las irregularidades hormonales propias del ciclo menstrual[19]. Ayudarían a dilucidar esta cuestión estudios que incluyan mayor población femenina en las fuerzas armadas.
La variable que resultó asociada en el análisis bivariado fue el nivel de calcemia, siendo mayor la proporción de fracturas por estrés en el grupo con hipocalcemia, en comparación con los de normocalcemia e hipercalcemia. Sin embargo, esta variable no pudo incluirse en el modelo multivariado ya que no tenía las frecuencias esperadas necesarias. Existen pocos estudios que busquen la correlación entre el nivel de calcio sérico con la incidencia de fracturas por estrés en población militar, por lo que las fracturas asociadas a hipocalcemia por lo general se reportan como fracturas atípicas y patológicas, relacionadas a otras condiciones mórbidas[20],[21]. Si bien el calcio sérico actúa de forma específica en otras funciones biológicas, en el presente estudio se consideró la variable calcemia por su relación directa con la paratohormona. Esto se explicaría porque los niveles bajos de calcio sérico estarían relacionados con la disminución de densidad ósea, sobre todo de tipo cortical[26].
En los adultos, aproximadamente 5% del hueso cortical y 30% del trabecular es reemplazado en un año[27]. Por lo tanto, para reemplazar el hueso trabecular casi en su totalidad se necesitarán tres años de una buena alimentación, mientras que para sustituir el hueso cortical serían necesarios 20 años aproximadamente. De aquí la importancia de una adecuada nutrición para mantener los niveles adecuados, los cuales podrían intervenir sobre la aparición de fracturas por estrés.
Es en estas poblaciones que se recomienda el monitoreo constante del calcio sérico y una suplementación de calcio y vitamina D en la dieta para prevenir este tipo de fracturas[21]. Estas recomendaciones también son válidas para población que pudiera estar en riesgo de fractura por estrés debido a su actividad física, como los reclutas militares. Existen estudios que corroboran que una dieta adecuada en consumo de calcio y vitamina D disminuye de forma significativa el riesgo de fracturas por estrés[22].
Asimismo, se encontró una asociación entre el nivel socioeconómico y la fractura por estrés, la cual se mantuvo en el análisis multivariado como asociación independiente. De esto se desprende, en el presente estudio, que las personas con un menor nivel socioeconómico tienen mayores probabilidades de tener una fractura por estrés. La relación podría explicarse a través de la calidad de la dieta, entendiendo que a un nivel socioeconómico más alto pueda tener mayores posibilidades de tener una mejor nutrición.
Se ha determinado que la calidad de la dieta puede influir en la incidencia de fracturas por estrés, como en el estudio realizado por Frusztajer y colaboradores en bailarinas de ballet, que encontró que la mayoría (80%) de las 10 bailarinas con fracturas por estrés recientes tenían pesos menores al 75% del ideal (p < 0,05), así como también una mayor incidencia de trastornos de la alimentación (p < 0,05). También se encontró que estas bailarinas tuvieron una menor ingesta de grasas y una mayor ingesta de alimentos bajos en calorías (p < 0,05)[24].
Por otro lado, se sabe que una menor fuerza muscular en miembros inferiores está asociada a una mayor incidencia de fracturas por estrés, debido principalmente a un agotamiento mecánico que los músculos son incapaces de contener si no tienen la fuerza adecuada. Esto podría agravarse si el paciente presenta una pobre dieta en proteínas[25], las cuales impedirían una correcta conformación muscular. Ello expone al tejido óseo a un mayor agotamiento mecánico y, por ende, a una mayor tasa de fracturas por estrés. Esto demuestra que no sólo es importante el consumo de suplementos de calcio y vitamina D, sino una dieta balanceada y con cantidades correctas de todos los macro y micronutrientes para mantener una adecuada salud ósea[18].
Por último, se encontró en el análisis multivariado la asociación entre horas de actividad física por día y fracturas por estrés. Esto se explica porque las personas que exponen por más tiempo su tejido óseo al estrés mecánico estimulan la resorción ósea, creando cavidades dentro del tejido que, al no tener el suficiente periodo de descanso, los osteoblastos no llegan a rellenar (proceso conocido como remodelación ósea). Ello genera microfracturas a partir de estos puntos de menor densidad que, al continuar la presión excesiva sobre el hueso, terminan de agravarse y llegan a constituirse como fracturas por estrés[5]. Asimismo, como se mencionó anteriormente, la fatiga muscular propia de la actividad física fuera de los límites de la persona que la realiza, genera una menor protección del músculo ante la carga mecánica del deporte o actividad que se realice[8].
Algunas de las limitaciones del presente estudio están relacionadas con el diseño retrospectivo observacional de una sola institución, con un sesgo de selección de las unidades de estudio, dado la preferencia masculina en las fuerzas armadas de Perú.
Recomendamos continuar esta línea de investigación incluyendo mayor población femenina, cuantificación en sangre de calcio y vitamina D, junto con desarrollar estudios de mayor poder estadístico, multicéntricos y prospectivos, para confirmar los resultados del presente estudio.
Conclusión
Las fracturas por estrés se asociaron a la cantidad de actividad física diaria, al nivel de calcemia (hipocalcemia) y a un nivel socioeconómico menor.
Se requiere efectuar más estudios para evaluar la relación con otros factores en la población militar peruana como la inclusión de población femenina, la relación con el calcio y vitamina D, junto con la ejecución de investigaciones multicéntricas y prospectivas, con mayor poder estadístico.
Notas
Roles de autoría
JBS: concepto y diseño del trabajo, adquisición, análisis de los datos, redacción y revisión crítica del manuscrito, aprobación final de la versión y responsabilidad de todos los aspectos del trabajo. JDV: concepto y diseño del trabajo, adquisición, análisis de los datos, redacción y revisión crítica del manuscrito y aprobación final de la versión. LVH: redacción y revisión crítica del manuscrito.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses con la materia de este artículo.
Financiamiento
Los autores no recibieron financiamiento para la realización de este estudio.

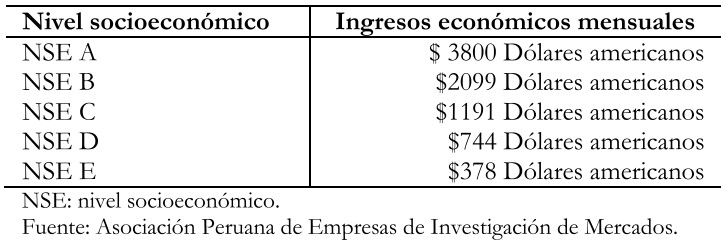 Tabla 1. Estudio socioeconómico.
Tabla 1. Estudio socioeconómico.

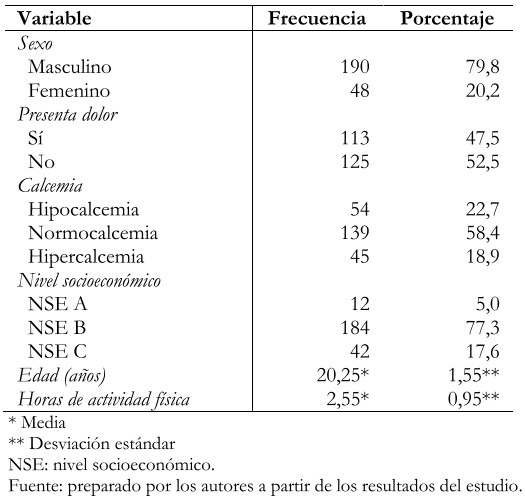 Tabla 2. Características generales de pacientes incluidos en el estudio.
Tabla 2. Características generales de pacientes incluidos en el estudio.

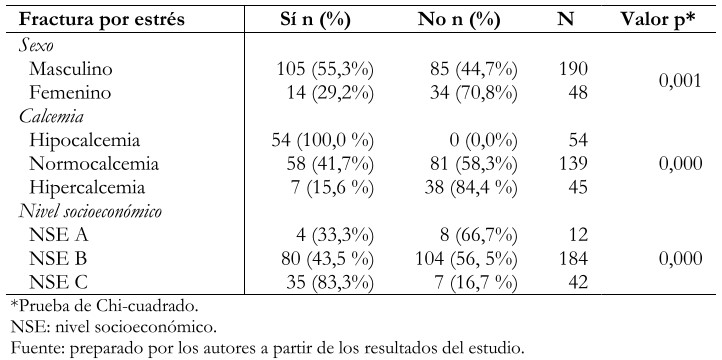 Tabla 3. Factores asociados a fractura por estrés en pacientes incluidos en el estudio.
Tabla 3. Factores asociados a fractura por estrés en pacientes incluidos en el estudio.

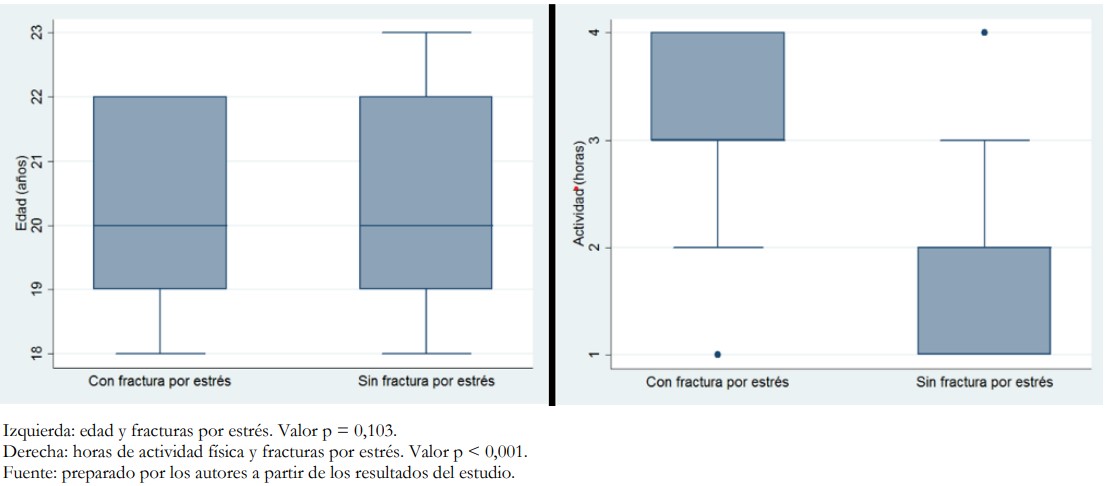 Figura 1. Asociación entre edad y horas de actividad física con fractura por estrés.
Figura 1. Asociación entre edad y horas de actividad física con fractura por estrés.

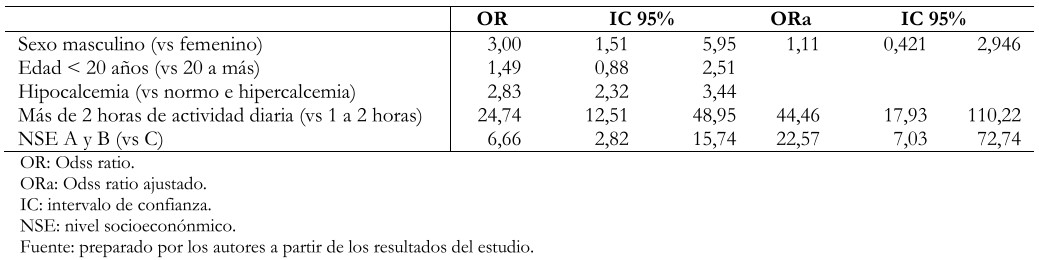 Tabla 4. Regresión logística de análisis bivariado y multivariado de factores asociados a fractura por estrés.
Tabla 4. Regresión logística de análisis bivariado y multivariado de factores asociados a fractura por estrés.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Introducción
Las fracturas por estrés son lesiones producidas por el sobreuso de ciertas extremidades, generando fatigas repetitivas en el hueso con insuficientes periodos de descanso, trastornos hormonales, entre otras. Se produce una elevada actividad osteoclástica y una menor actividad de los osteoblastos a nivel cortical.
Objetivo
Determinar los factores asociados a fractura por estrés en un centro médico de la Marina de Guerra de Perú.
Metodología
Se realizó una investigación de tipo observacional analítica de casos y controles. La variable dependiente fue la fractura por estrés, confirmada por resonancia magnética de los pacientes. Las variables independientes fueron edad, sexo y nivel de calcemia tomadas a partir de la historia clínica; el nivel socioeconómico y tiempo de actividad física diaria fueron datos recogidos mediante encuesta. Se obtuvieron los Odds ratio crudos y ajustados con un intervalo de confianza de 95%.
Resultados
Se trabajó con un total de 238 pacientes (119 casos y 119 controles), de los cuales 79,8% fueron varones y 20,2% fueron mujeres; la media de edad fue de 20,25 años. En el análisis bivariado se encontró asociación de fracturas por estrés con el sexo masculino (Odds ratio: 3,00; intervalo de confianza 95%: 1,51 a 5,95), hipocalcemia (Odds ratio: 2,83; intervalo de confianza 95%: 2,32 a 3,44), más de dos horas de actividad física diaria (Odds ratio: 24,74; intervalo de confianza 95%: 12,51 a 48,95) y un nivel socioeconómico C (Odds ratio: 6,66; intervalo de confianza 95%: 2,82 a 15,74). Mantuvieron su asociación en el análisis multivariado el tiempo de actividad física (Odds ratio: 44,46; intervalo de confianza 95%: 17,93 a 110,22) y el nivel socioeconómico C (Odds ratio: 22,57; intervalo de confianza 95%: 7,03 a 72,74).
Conclusión
Las fracturas por estrés estuvieron asociadas al tiempo de actividad física y a un nivel socioeconómico menor. Son necesarios más estudios para evaluar la relación con otros factores en la población militar de Perú.
 Authors:
John C Becerra Sandoval [1], Lissette Ventura Huamán [1], Jhony A De La Cruz-Vargas [2]
Authors:
John C Becerra Sandoval [1], Lissette Ventura Huamán [1], Jhony A De La Cruz-Vargas [2]
Affiliation:
[1] Centro Médico Naval Cirujano Mayor Santiago Távara, Lima, Perú
[2] Instituto de Investigación en Ciencias Biomédicas, Universidad Ricardo Palma, Lima, Perú
E-mail: jcbs_5@hotmail.com
Author address:
[1] Mz. C Lt 5 Urb. 7 de Agosto 2do programa Callao, Lima Perú

Citation: Becerra Sandoval JC, Ventura Huamán L, De La Cruz-Vargas JA. Factors associated with stress fracture: A case-control study in a Peruvian navy medical center. Medwave 2020;20(5):e7936 doi: 10.5867/medwave.2020.05.7936
Submission date: 24/11/2019
Acceptance date: 6/6/2020
Publication date: 25/6/2020
Origin: Not commissioned
Type of review: Externally peer-reviewed by three reviewers, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Melton W, Jackson JB. Stress fractures of the foot and ankle. En: Foot and Ankle Sports Orthopaedics. Springer International Publishing; 2017. p. 161–9. | CrossRef |
- Fredericson M, Jennings F, Beaulieu C, Matheson GO. Stress fractures in athletes. Top Magn Reson Imaging. 2006 Oct;17(5):309-25. | CrossRef | PubMed |
- Korpelainen R, Orava S, Karpakka J, Siira P, Hulkko A. Risk factors for recurrent stress fractures in athletes. Am J Sports Med. 2001 May-Jun;29(3):304-10. | CrossRef | PubMed |
- Waterman BR, Gun B, Bader JO, Orr JD, Belmont PJ Jr. Epidemiology of Lower Extremity Stress Fractures in the United States Military. Mil Med. 2016 Oct;181(10):1308-1313. | CrossRef | PubMed |
- Matcuk GR Jr, Mahanty SR, Skalski MR, Patel DB, White EA, Gottsegen CJ. Stress fractures: pathophysiology, clinical presentation, imaging features, and treatment options. Emerg Radiol. 2016 Aug;23(4):365-75. | CrossRef | PubMed |
- Astur DC, Zanatta F, Arliani GG, Moraes ER, Pochini Ade C, Ejnisman B. Stress fractures: definition, diagnosis and treatment. Rev Bras Ortop. 2015 Dec 30;51(1):3-10. | CrossRef | PubMed |
- Yong JR, Silder A, Montgomery KL, Fredericson M, Delp SL. Acute changes in foot strike pattern and cadence affect running parameters associated with tibial stress fractures. J Biomech. 2018 Jul 25;76:1-7. | CrossRef | PubMed |
- Hadid A, Epstein Y, Shabshin N, Gefen A. Biomechanical Model for Stress Fracture-related Factors in Athletes and Soldiers. Med Sci Sports Exerc. 2018 Sep;50(9):1827-1836. | CrossRef | PubMed |
- Goolsby MA, Boniquit N. Bone Health in Athletes. Sports Health. 2017 Mar/Apr;9(2):108-117. | CrossRef | PubMed |
- Campbell EJ, Campbell GM, Hanley DA. The effect of parathyroid hormone and teriparatide on fracture healing. Expert Opin Biol Ther. 2015 Jan;15(1):119-29. | CrossRef | PubMed |
- Bulathsinhala L, Hughes JM, McKinnon CJ, Kardouni JR, Guerriere KI, Popp KL, et al. Risk of Stress Fracture Varies by Race/Ethnic Origin in a Cohort Study of 1.3 Million US Army Soldiers. J Bone Miner Res. 2017 Jul;32(7):1546-1553. | CrossRef | PubMed |
- Kahanov L, Eberman LE, Games KE, Wasik M. Diagnosis, treatment, and rehabilitation of stress fractures in the lower extremity in runners. Open Access J Sports Med. 2015 Mar 27;6:87-95. | CrossRef | PubMed |
- Asociación Peruana de Empresas de Investigación de Mercados. Informes NSE. APEIM;2019. [On line]. | Link |
- Becerra J, Mendieta J, De La Cruz Vargas JA. Fractura por estrés: fractura incompleta de fémur derecho. Rev Fac Med Humana. 2017;17(2):104-6. | CrossRef |
- Dao D, Sodhi S, Tabasinejad R, Peterson D, Ayeni OR, Bhandari M, et al. Serum 25-Hydroxyvitamin D Levels and Stress Fractures in Military Personnel: A Systematic Review and Meta-analysis. Am J Sports Med. 2015 Aug;43(8):2064-72. | CrossRef | PubMed |
- Gam A, Goldstein L, Karmon Y, Mintser I, Grotto I, Guri A, et al. Comparison of stress fractures of male and female recruits during basic training in the Israeli anti-aircraft forces. Mil Med. 2005 Aug;170(8):710-2. | CrossRef | PubMed |
- Wentz L, Liu PY, Haymes E, Ilich JZ. Females have a greater incidence of stress fractures than males in both military and athletic populations: a systemic review. Mil Med. 2011 Apr;176(4):420-30. | CrossRef | PubMed |
- Beck TJ, Ruff CB, Shaffer RA, Betsinger K, Trone DW, Brodine SK. Stress fracture in military recruits: gender differences in muscle and bone susceptibility factors. Bone. 2000 Sep;27(3):437-44. | CrossRef | PubMed |
- Kelsey JL, Bachrach LK, Procter-Gray E, Nieves J, Greendale GA, Sowers M, et al. Risk factors for stress fracture among young female cross-country runners. Med Sci Sports Exerc. 2007 Sep;39(9):1457-63. | CrossRef | PubMed |
- Thakur A, Sood R, Gupta A, Thakker V, Thakur R. Femoral Neck Fatigue Fracture as the First Manifestation of Celiac Disease: A Case Report. IJSS Case Rep Rev. 2016;2(10):13-5. [On line]. | Link |
- Pittman K, Antill YC, Goldrick A, Goh J, de Boer RH. Denosumab: Prevention and management of hypocalcemia, osteonecrosis of the jaw and atypical fractures. Asia Pac J Clin Oncol. 2017 Aug;13(4):266-276. | CrossRef | PubMed |
- Lappe J, Cullen D, Haynatzki G, Recker R, Ahlf R, Thompson K. Calcium and vitamin d supplementation decreases incidence of stress fractures in female navy recruits. J Bone Miner Res. 2008 May;23(5):741-9. | CrossRef | PubMed |
- McInnis KC, Ramey LN. High-Risk Stress Fractures: Diagnosis and Management. PM R. 2016 Mar;8(3 Suppl):S113-24. | CrossRef | PubMed |
- Frusztajer NT, Dhuper S, Warren MP, Brooks-Gunn J, Fox RP. Nutrition and the incidence of stress fractures in ballet dancers. Am J Clin Nutr. 1990 May;51(5):779-83. | CrossRef | PubMed |
- Prado CM, Cushen SJ, Orsso CE, Ryan AM. Sarcopenia and cachexia in the era of obesity: clinical and nutritional impact. Proc Nutr Soc. 2016 May;75(2):188-98. | CrossRef | PubMed |
- López Gavilanez E, Huamán Garaycoa F, Garcés Santos JC, Marengo Baquerizo C, Reyes Aguirre G. Osteoporosis, PTH elevada y calcio iónico inadecuadamente “normal.” Rev Esp Enfermedades Metab Oseas. 2005 May;14(3):52–4. | CrossRef |
- Restrepo-Giraldo LM, Arévalo-Novoa J, Toro-Ramos M. Metabolismo mineral y óseo: visión general y sus métodos de medición. Bone and mineral metabolism: Overview and methods of measurement. Medicina y Laboratorio. 2015;21(11-12):511-38. [On line]. | Link |
 Melton W, Jackson JB. Stress fractures of the foot and ankle. En: Foot and Ankle Sports Orthopaedics. Springer International Publishing; 2017. p. 161–9. | CrossRef |
Melton W, Jackson JB. Stress fractures of the foot and ankle. En: Foot and Ankle Sports Orthopaedics. Springer International Publishing; 2017. p. 161–9. | CrossRef | Fredericson M, Jennings F, Beaulieu C, Matheson GO. Stress fractures in athletes. Top Magn Reson Imaging. 2006 Oct;17(5):309-25. | CrossRef | PubMed |
Fredericson M, Jennings F, Beaulieu C, Matheson GO. Stress fractures in athletes. Top Magn Reson Imaging. 2006 Oct;17(5):309-25. | CrossRef | PubMed | Korpelainen R, Orava S, Karpakka J, Siira P, Hulkko A. Risk factors for recurrent stress fractures in athletes. Am J Sports Med. 2001 May-Jun;29(3):304-10. | CrossRef | PubMed |
Korpelainen R, Orava S, Karpakka J, Siira P, Hulkko A. Risk factors for recurrent stress fractures in athletes. Am J Sports Med. 2001 May-Jun;29(3):304-10. | CrossRef | PubMed | Waterman BR, Gun B, Bader JO, Orr JD, Belmont PJ Jr. Epidemiology of Lower Extremity Stress Fractures in the United States Military. Mil Med. 2016 Oct;181(10):1308-1313. | CrossRef | PubMed |
Waterman BR, Gun B, Bader JO, Orr JD, Belmont PJ Jr. Epidemiology of Lower Extremity Stress Fractures in the United States Military. Mil Med. 2016 Oct;181(10):1308-1313. | CrossRef | PubMed | Matcuk GR Jr, Mahanty SR, Skalski MR, Patel DB, White EA, Gottsegen CJ. Stress fractures: pathophysiology, clinical presentation, imaging features, and treatment options. Emerg Radiol. 2016 Aug;23(4):365-75. | CrossRef | PubMed |
Matcuk GR Jr, Mahanty SR, Skalski MR, Patel DB, White EA, Gottsegen CJ. Stress fractures: pathophysiology, clinical presentation, imaging features, and treatment options. Emerg Radiol. 2016 Aug;23(4):365-75. | CrossRef | PubMed | Astur DC, Zanatta F, Arliani GG, Moraes ER, Pochini Ade C, Ejnisman B. Stress fractures: definition, diagnosis and treatment. Rev Bras Ortop. 2015 Dec 30;51(1):3-10. | CrossRef | PubMed |
Astur DC, Zanatta F, Arliani GG, Moraes ER, Pochini Ade C, Ejnisman B. Stress fractures: definition, diagnosis and treatment. Rev Bras Ortop. 2015 Dec 30;51(1):3-10. | CrossRef | PubMed | Yong JR, Silder A, Montgomery KL, Fredericson M, Delp SL. Acute changes in foot strike pattern and cadence affect running parameters associated with tibial stress fractures. J Biomech. 2018 Jul 25;76:1-7. | CrossRef | PubMed |
Yong JR, Silder A, Montgomery KL, Fredericson M, Delp SL. Acute changes in foot strike pattern and cadence affect running parameters associated with tibial stress fractures. J Biomech. 2018 Jul 25;76:1-7. | CrossRef | PubMed | Hadid A, Epstein Y, Shabshin N, Gefen A. Biomechanical Model for Stress Fracture-related Factors in Athletes and Soldiers. Med Sci Sports Exerc. 2018 Sep;50(9):1827-1836. | CrossRef | PubMed |
Hadid A, Epstein Y, Shabshin N, Gefen A. Biomechanical Model for Stress Fracture-related Factors in Athletes and Soldiers. Med Sci Sports Exerc. 2018 Sep;50(9):1827-1836. | CrossRef | PubMed | Goolsby MA, Boniquit N. Bone Health in Athletes. Sports Health. 2017 Mar/Apr;9(2):108-117. | CrossRef | PubMed |
Goolsby MA, Boniquit N. Bone Health in Athletes. Sports Health. 2017 Mar/Apr;9(2):108-117. | CrossRef | PubMed | Campbell EJ, Campbell GM, Hanley DA. The effect of parathyroid hormone and teriparatide on fracture healing. Expert Opin Biol Ther. 2015 Jan;15(1):119-29. | CrossRef | PubMed |
Campbell EJ, Campbell GM, Hanley DA. The effect of parathyroid hormone and teriparatide on fracture healing. Expert Opin Biol Ther. 2015 Jan;15(1):119-29. | CrossRef | PubMed | Bulathsinhala L, Hughes JM, McKinnon CJ, Kardouni JR, Guerriere KI, Popp KL, et al. Risk of Stress Fracture Varies by Race/Ethnic Origin in a Cohort Study of 1.3 Million US Army Soldiers. J Bone Miner Res. 2017 Jul;32(7):1546-1553. | CrossRef | PubMed |
Bulathsinhala L, Hughes JM, McKinnon CJ, Kardouni JR, Guerriere KI, Popp KL, et al. Risk of Stress Fracture Varies by Race/Ethnic Origin in a Cohort Study of 1.3 Million US Army Soldiers. J Bone Miner Res. 2017 Jul;32(7):1546-1553. | CrossRef | PubMed | Kahanov L, Eberman LE, Games KE, Wasik M. Diagnosis, treatment, and rehabilitation of stress fractures in the lower extremity in runners. Open Access J Sports Med. 2015 Mar 27;6:87-95. | CrossRef | PubMed |
Kahanov L, Eberman LE, Games KE, Wasik M. Diagnosis, treatment, and rehabilitation of stress fractures in the lower extremity in runners. Open Access J Sports Med. 2015 Mar 27;6:87-95. | CrossRef | PubMed | Asociación Peruana de Empresas de Investigación de Mercados. Informes NSE. APEIM;2019. [On line]. | Link |
Asociación Peruana de Empresas de Investigación de Mercados. Informes NSE. APEIM;2019. [On line]. | Link | Becerra J, Mendieta J, De La Cruz Vargas JA. Fractura por estrés: fractura incompleta de fémur derecho. Rev Fac Med Humana. 2017;17(2):104-6. | CrossRef |
Becerra J, Mendieta J, De La Cruz Vargas JA. Fractura por estrés: fractura incompleta de fémur derecho. Rev Fac Med Humana. 2017;17(2):104-6. | CrossRef | Dao D, Sodhi S, Tabasinejad R, Peterson D, Ayeni OR, Bhandari M, et al. Serum 25-Hydroxyvitamin D Levels and Stress Fractures in Military Personnel: A Systematic Review and Meta-analysis. Am J Sports Med. 2015 Aug;43(8):2064-72. | CrossRef | PubMed |
Dao D, Sodhi S, Tabasinejad R, Peterson D, Ayeni OR, Bhandari M, et al. Serum 25-Hydroxyvitamin D Levels and Stress Fractures in Military Personnel: A Systematic Review and Meta-analysis. Am J Sports Med. 2015 Aug;43(8):2064-72. | CrossRef | PubMed | Gam A, Goldstein L, Karmon Y, Mintser I, Grotto I, Guri A, et al. Comparison of stress fractures of male and female recruits during basic training in the Israeli anti-aircraft forces. Mil Med. 2005 Aug;170(8):710-2. | CrossRef | PubMed |
Gam A, Goldstein L, Karmon Y, Mintser I, Grotto I, Guri A, et al. Comparison of stress fractures of male and female recruits during basic training in the Israeli anti-aircraft forces. Mil Med. 2005 Aug;170(8):710-2. | CrossRef | PubMed | Wentz L, Liu PY, Haymes E, Ilich JZ. Females have a greater incidence of stress fractures than males in both military and athletic populations: a systemic review. Mil Med. 2011 Apr;176(4):420-30. | CrossRef | PubMed |
Wentz L, Liu PY, Haymes E, Ilich JZ. Females have a greater incidence of stress fractures than males in both military and athletic populations: a systemic review. Mil Med. 2011 Apr;176(4):420-30. | CrossRef | PubMed | Beck TJ, Ruff CB, Shaffer RA, Betsinger K, Trone DW, Brodine SK. Stress fracture in military recruits: gender differences in muscle and bone susceptibility factors. Bone. 2000 Sep;27(3):437-44. | CrossRef | PubMed |
Beck TJ, Ruff CB, Shaffer RA, Betsinger K, Trone DW, Brodine SK. Stress fracture in military recruits: gender differences in muscle and bone susceptibility factors. Bone. 2000 Sep;27(3):437-44. | CrossRef | PubMed | Kelsey JL, Bachrach LK, Procter-Gray E, Nieves J, Greendale GA, Sowers M, et al. Risk factors for stress fracture among young female cross-country runners. Med Sci Sports Exerc. 2007 Sep;39(9):1457-63. | CrossRef | PubMed |
Kelsey JL, Bachrach LK, Procter-Gray E, Nieves J, Greendale GA, Sowers M, et al. Risk factors for stress fracture among young female cross-country runners. Med Sci Sports Exerc. 2007 Sep;39(9):1457-63. | CrossRef | PubMed | Thakur A, Sood R, Gupta A, Thakker V, Thakur R. Femoral Neck Fatigue Fracture as the First Manifestation of Celiac Disease: A Case Report. IJSS Case Rep Rev. 2016;2(10):13-5. [On line]. | Link |
Thakur A, Sood R, Gupta A, Thakker V, Thakur R. Femoral Neck Fatigue Fracture as the First Manifestation of Celiac Disease: A Case Report. IJSS Case Rep Rev. 2016;2(10):13-5. [On line]. | Link | Pittman K, Antill YC, Goldrick A, Goh J, de Boer RH. Denosumab: Prevention and management of hypocalcemia, osteonecrosis of the jaw and atypical fractures. Asia Pac J Clin Oncol. 2017 Aug;13(4):266-276. | CrossRef | PubMed |
Pittman K, Antill YC, Goldrick A, Goh J, de Boer RH. Denosumab: Prevention and management of hypocalcemia, osteonecrosis of the jaw and atypical fractures. Asia Pac J Clin Oncol. 2017 Aug;13(4):266-276. | CrossRef | PubMed | Lappe J, Cullen D, Haynatzki G, Recker R, Ahlf R, Thompson K. Calcium and vitamin d supplementation decreases incidence of stress fractures in female navy recruits. J Bone Miner Res. 2008 May;23(5):741-9. | CrossRef | PubMed |
Lappe J, Cullen D, Haynatzki G, Recker R, Ahlf R, Thompson K. Calcium and vitamin d supplementation decreases incidence of stress fractures in female navy recruits. J Bone Miner Res. 2008 May;23(5):741-9. | CrossRef | PubMed | McInnis KC, Ramey LN. High-Risk Stress Fractures: Diagnosis and Management. PM R. 2016 Mar;8(3 Suppl):S113-24. | CrossRef | PubMed |
McInnis KC, Ramey LN. High-Risk Stress Fractures: Diagnosis and Management. PM R. 2016 Mar;8(3 Suppl):S113-24. | CrossRef | PubMed | Frusztajer NT, Dhuper S, Warren MP, Brooks-Gunn J, Fox RP. Nutrition and the incidence of stress fractures in ballet dancers. Am J Clin Nutr. 1990 May;51(5):779-83. | CrossRef | PubMed |
Frusztajer NT, Dhuper S, Warren MP, Brooks-Gunn J, Fox RP. Nutrition and the incidence of stress fractures in ballet dancers. Am J Clin Nutr. 1990 May;51(5):779-83. | CrossRef | PubMed | Prado CM, Cushen SJ, Orsso CE, Ryan AM. Sarcopenia and cachexia in the era of obesity: clinical and nutritional impact. Proc Nutr Soc. 2016 May;75(2):188-98. | CrossRef | PubMed |
Prado CM, Cushen SJ, Orsso CE, Ryan AM. Sarcopenia and cachexia in the era of obesity: clinical and nutritional impact. Proc Nutr Soc. 2016 May;75(2):188-98. | CrossRef | PubMed | López Gavilanez E, Huamán Garaycoa F, Garcés Santos JC, Marengo Baquerizo C, Reyes Aguirre G. Osteoporosis, PTH elevada y calcio iónico inadecuadamente “normal.” Rev Esp Enfermedades Metab Oseas. 2005 May;14(3):52–4. | CrossRef |
López Gavilanez E, Huamán Garaycoa F, Garcés Santos JC, Marengo Baquerizo C, Reyes Aguirre G. Osteoporosis, PTH elevada y calcio iónico inadecuadamente “normal.” Rev Esp Enfermedades Metab Oseas. 2005 May;14(3):52–4. | CrossRef | Restrepo-Giraldo LM, Arévalo-Novoa J, Toro-Ramos M. Metabolismo mineral y óseo: visión general y sus métodos de medición. Bone and mineral metabolism: Overview and methods of measurement. Medicina y Laboratorio. 2015;21(11-12):511-38. [On line]. | Link |
Restrepo-Giraldo LM, Arévalo-Novoa J, Toro-Ramos M. Metabolismo mineral y óseo: visión general y sus métodos de medición. Bone and mineral metabolism: Overview and methods of measurement. Medicina y Laboratorio. 2015;21(11-12):511-38. [On line]. | Link |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis








