Key Words: phacoemulsification, cataract, endothelial cells
Resumen
Introducción
La facoéresis es el procedimiento en que se extrae quirúrgicamente el cristalino para tratar las cataratas. La pérdida endotelial corneal es una complicación reconocida. Si bien se han descrito diversos factores asociados a este daño, la experiencia del cirujano ha sido poco explorada.
Objetivos
Evaluar la asociación entre la experiencia del cirujano y otras variables asociadas a la pérdida celular endotelial en el contexto de la facoéresis.
Métodos
Se analizaron prospectivamente los registros clínicos de 198 pacientes operados por cataratas, evaluando el efecto de la experiencia del cirujano y otras variables asociadas: energía disipada acumulada, tipo de viscoelástico empleado, uso de azul tripán, cantidad de fluídica, tiempo de ultrasonido, energía de facoemulsificación combinada y recuento celular endotelial pre y postoperatorio.
Resultados
No se observaron diferencias en el conteo postoperatorio de células endoteliales. Los oftalmólogos con más de cinco años de experiencia presentaron menor uso de azul tripán pero mayor cantidad de energía disipada acumulada en cada procedimiento, mientras que los oftalmólogos con menor experiencia utilizaron mayor cantidad de fluídica.
Conclusiones
Aunque hubo diferencias en el manejo de algunos factores influyentes sobre la pérdida endotelial cornal según la experiencia de los oftalmólogos, no se hallaron diferencias en relación a dicha pérdida como resultado final.
|
Ideas clave • La experiencia del oftalmólogo en relación a la pérdida celular endotelial asociada a la facoéresis ha sido escasamente estudiada. |
Introducción
Se estima que 285 millones de personas presentan algún grado de discapacidad visual en el mundo, de los cuales 33% es causada por cataratas[1]. En efecto, las cataratas se sitúan como el segundo trastorno visual de más alto costo[2]. Datos de la Encuesta Nacional de Salud de Chile 2009-2010 muestran una prevalencia de 4,5%, alcanzando hasta 23,9 % en adultos mayores[3].
El tratamiento de cataratas consiste en la extracción quirúrgica del cristalino (facoéresis), procedimiento efectivo y seguro, donde la preservación de la integridad de la cápsula y del endotelio corneal son imperativas[4],[5],[6],[7], ya que la facoéresis per se puede asociarse a una pérdida adicional de células endoteliales corneales más allá de la pérdida fisiológica que, según algunos estudios, va desde 0,6 hasta 2,5% por año[8],[9],[10]. Cuando el recuento del endotelio corneal desciende de 500-700 células por milímetro cuadrado se produce edema, desencadenando pérdida de la agudeza visual vinculada a queratopatía bulosa[8],[11],[12].
La técnica de facoéresis más extensamente utilizada es la facoemulsificación, que consiste en la emulsificación del cristalino mediante frecuencia ultrasónica[5],[13] pudiendo utilizarse no solo en el tratamiento de cataratas, sino también con fines refractivos. Esta energía ultrasónica puede expresarse de diversas maneras, siendo una de ellas la denominada energía disipada acumulada (cumulative dissipated energy), que consiste en un estimador combinado que relaciona la potencia de energía longitudinal/torsional de ultrasonido con el tiempo[14]. Diversos autores han descrito una asociación entre el valor de la energía disipada acumulada y la pérdida celular endotelial corneal vinculada a la facoemulsificación[15],[16],[17].
Además de la energía disipada acumulada, existen otras variables propias del procedimiento quirúrgico que podrían influir en la pérdida de células endoteliales, tales como la técnica quirúrgica empleada, el tipo de catarata, el uso de elementos de tinción como azul tripán, la edad del paciente, el tipo de viscoelástico utilizado para proteger el endotelio, la posición de la punta del facoemulsificador[18] y la densidad celular corneal previa[19],[20]. Sin embargo, la experiencia previa del cirujano es una variable que ha sido muy escasamente explorada en la literatura. Por lo tanto, este estudio analizó la asociación entre la experiencia del cirujano y los diferentes factores asociados a la cirugía de cataratas que se relacionan con la pérdida celular endotelial.
Métodos
Se analizaron prospectivamente los registros clínicos de 198 cirugías de cataratas en el Servicio de Oftalmología del Hospital Carlos van Buren, en Valparaíso, Chile; entre marzo y septiembre de 2015. El protocolo fue aprobado por el Comité Ético-Científico del Servicio de Salud Valparaíso-San Antonio (Acta Nº27 del año 2017).
Los criterios de elegibilidad contemplaron a pacientes con:
- Cataratas y mayores de 18 años.
- Facoéresis realizada con lente intraocular monopieza en saco capsular.
- Conteo de células endoteliales por microscopía especular pre y postquirúrgica a los 90 días.
- Recuento endotelial prequirúrgico mayor a 1500 células por milímetro cuadrado.
Se excluyeron a pacientes con:
- Cualquier otro tipo de patología ocular.
- Lesiones intraoperatorias del endotelio corneal.
- Rotura de cápsula posterior del cristalino.
- Pupila pequeña con requerimiento de alguna intervención para aumentar su diámetro.
- Presencia de catarata pediátrica o secundaria.
- Cirugías realizadas por residentes de oftalmología.
- Registro incompleto.
Todos los pacientes fueron operados con el mismo equipo de facoemulsificación empleando el mismo phaco tip. La anestesia utilizada en todas las cirugías fue tópica a base de proparacaína asociada, mientras que en casos específicos se recurrió a anestesia intracamerular. La técnica quirúrgica empleada fue definida por el cirujano de acuerdo a las características individuales de cada caso. En todas las cirugías se utilizó como irrigante la solución salina balanceada. En caso de mal reflejo rojo pupilar, se utilizó azul tripán intracamerular para teñir la cápsula anterior del cristalino mediante burbuja de aire en todos los pacientes. En ninguno de los casos incluidos se utilizó antibiótico intracameral como profilaxis de endoftalmitis postquirúrgica. Ninguno de los pacientes fue premedicado en los días previos a la intervención y, tras ella, todos recibieron un esquema de tobramicina/dexametasona por al menos 14 días.
Se evaluaron las siguientes variables en función de la experiencia del cirujano dicotomizada según si su experiencia como oftalmólogo era mayor o menor a cinco años: tipo de catarata tipo de catarata (según clasificación Lens Opacities Classification System III, LOCS III), energía disipada acumulada, tipo de viscoelástico empleado, utilización de azul tripán, volumen de fluídica, tiempo total de ultrasonido y energía de facoemulsificación combinada. La variable de resultado fue la pérdida celular a los 90 días (diferencia entre el recuento celular endotelial pre y postquirúrgico). El equipo utilizado para la medición del recuento endotelial fue el mismo para el conteo pre y postquirúrgico. Adicionalmente, se calculó la proporción de ojos que perdieron más de 500 células por milímetro cuadrado.
Para el análisis descriptivo se utilizaron frecuencias absolutas y relativas, proporciones y promedios con desviación estándar. Para el análisis inferencial se usó T de Student para variables numéricas y prueba exacta de Fisher para categóricas. Se consideró un valor p menor a 0,05 para establecer diferencias como estadísticamente significativas. Los datos fueron procesados por Stata 15 (StataCorp, Texas, Estados Unidos).
Resultados
Se incluyó un total de 198 registros de ojos operados correspondientes a 158 pacientes, con una edad promedio de 74,1 ± 8,5 años. Las características de los pacientes incluidos se muestran en la Tabla 1.
Tabla 1. Características de los pacientes incluidos en el estudio.
Como se muestra en la Tabla 2, 112 cirugías fueron realizadas por oftalmólogos con más de cinco años de experiencia, mientras que 86 fueron efectuadas por cirujanos con menos de cinco años de experiencia. Al comparar las características de ambos grupos de pacientes, no se observaron diferencias etarias, en cuanto al sexo, ni del tipo de catarata a intervenir. Tampoco se pesquisaron diferencias significativas en torno a la pérdida endotelial global (p = 0,1945), según si fueron operados por oftalmólogos con más (446,17 ± 342 células por milímetro cuadrado) o menos de cinco años de experiencia (511,1 ± 354,8 células por milímetro cuadrado). Un solo paciente presentó un recuento bajo 700 células por milímetro cuadrado a los 90 días.
Tabla 2. Variables evaluadas según experiencia del oftalmólogo.
Los viscoelásticos más utilizados por ambos grupos de oftalmólogos fueron en primer lugar el viscoelástico premezclado de hialuronato sódico al 3% más condroitín sulfato al 4%. En segundo lugar, usaron la combinación de viscoelástico de hialuronato sódico 1% más la premezcla de hialuronato 3% y condroitín sulfato 4%. No se hallaron diferencias significativas al comparar ambos tipos de viscoelástico.
La energía disipada acumulada estimada para los oftalmólogos de más de cinco años de experiencia fue de 25,5 ± 17,3 %-s, mientras que el grupo de menor experiencia alcanzó un promedio de 21,3 ± 11,6 %-s, con una diferencia significativa entre ambos grupos (p = 0,0268).
El uso de fluídica por parte de los oftalmólogos con más de cinco años de práctica profesional fue de 75,36 mililitros ± 26,08, mientras que los oftalmólogos que contaban con menos de cinco años obtuvieron un promedio de 92 mililitros ± 47,64 (p = 0,002).
El uso de azul tripán fue significativamente mayor en el grupo de oftalmólogos con menor experiencia (p < 0,001). Respecto de la pérdida celular endotelial asociada a su uso, el grupo de pacientes que recibió azul tripán tuvo una pérdida celular promedio de 513 ± 352 células por milímetro cuadrado, mientras que aquellos en que no se usó, la pérdida fue de 388 ± 325 células por milímetro cuadrado (p = 0,019).
Respecto del resto de las variables estudiadas, no se hallaron diferencias intergrupales. No hubo complicaciones asociadas al uso de azul tripán ni a otros procedimientos.
Discusión
En el presente estudio no se hallaron asociaciones entre la experiencia del oftalmólogo y la pérdida celular endotelial post-facoéresis, así como tampoco en el número de pacientes que perdieron más de 500 células por milímetro cuadrado a los 90 días. Si bien no se han encontrado estudios que comparen resultados postoperatorios según la experiencia del cirujano tratante, podría plantearse a priori que aquellos cirujanos con menor experiencia generarían una mayor pérdida celular debido a su menor experiencia, lo que no ha sido corroborado por esta investigación. Este resultado podría interpretarse como la consecuencia de que los oftalmólogos con menor experiencia hubiesen operado cataratas de menor complejidad; no obstante, la clasificación LOCS respecto del tipo de catarata fue comparable en los procedimientos asignados a ambos grupos.
Respecto a las variables propias del procedimiento quirúrgico, hay ciertas diferencias procedimentales entre ambos grupos. Los oftalmólogos de más de cinco años de experiencia optaron por utilizar más viscoelástico de hialuronato sódico 3% más condroitín sulfato 4% que sus colegas con menos de cinco años de experiencia (p = 0,009). Una posible interpretación de aquello es que este tipo de viscoelástico presenta un menor costo y una mayor disponibilidad en los hospitales públicos, por lo que sería elegido por cirujanos con mayor experiencia. Además, presenta propiedades que podrían restar eficiencia al procedimiento operatorio, pues las características cohesivas y dispersivas son favorables para el tipo mixto. No obstante lo anterior, es necesario considerar que la elección podría condicionarse a su vez por la disponibilidad en el minuto de la cirugía.
Un hallazgo relevante en nuestro estudio, fue que los oftalmólogos con más de cinco años de experiencia aplican una mayor energía disipada acumulada al compararse con los menos experimentados, lo que en teoría podría exponer a los pacientes a un mayor riesgo de edema corneal[15],[16]. A su vez, el grupo con mayor experiencia utiliza azul tripán en una menor proporción de pacientes (p < 0,001), probablemente debido a una menor necesidad de identificar la cápsula anterior mediante su tinción. Este mayor uso de energía disipada acumulada y menor uso de azul tripán por parte de los cirujanos experimentados, podría generar un fenómeno compensatorio que explicaría que la pérdida celular final sea comparable para ambos grupos, teniendo en cuenta que ambas variables han sido asociadas a la pérdida celular endotelial postquirúrgica. En nuestro estudio no se registraron complicaciones asociadas al uso de azul tripán, pese a que diversas publicaciones han asociado su uso a toxicidad en modelos animales[21] y en cultivos celulares[22] e incluso manchas vítreas[23]. En efecto, en el grupo de pacientes en que se aplicó azul tripán hubo una pérdida significativamente mayor de células endoteliales que en aquellos en que no fue usado (p = 0,019).
Otra variable importante en los resultados postoperatorios es la fluídica. Altos valores de fluídica en las intervenciones producen turbulencia en la cámara anterior, lo que puede desencadenar daño sobre las células endoteliales, determinar inflamación postoperatoria y aumentar el espesor de la mácula central[24],[25],[26]. En este análisis, se determinó que los oftalmólogos con menos de cinco años de experiencia emplearon más fluídica, lo que en el sentido inverso a lo que antes se refirió, pudo haber sido compensado por el menor uso de energía acumulada disipada, explicando el resultado final observado en el recuento de células endoteliales. Una situación similar se observó en un ensayo clínico aleatorizado llevado a cabo por Sudeep Das y colaboradores, donde se determinó que el grupo que contó con una menor energía acumulada disipada presentó mayores valores de fluídica en sus intervenciones[27].
Cabe señalar dentro de las limitaciones de este estudio, que el empleo preferencial de algún viscoelástico pudo haber sido determinado por su disponibilidad en el minuto del procedimiento, por lo que su uso no se asociaría necesariamente a la preferencia del oftalmólogo de acuerdo a su experiencia. A futuro, sería deseable considerar diseños metodológicos que nos permitan analizar otras variables como la técnica quirúrgica empleada y el uso de otros fármacos intracamerulares, así como otros desenlaces clínicamente relevantes, tales como edema corneal, agudeza visual final y calidad de vida posterior a la cirugía.
Conclusión
Con este estudio, que cuenta con un buen tamaño muestral, se hace un aporte al escaso conocimiento existente que asocie la experiencia del oftalmólogo con los resultados clínicos de un procedimiento frecuente, pero escasamente evaluado desde este punto de vista.
En la presente investigación, los años de experiencia de los oftalmólogos tratantes se asociaron significativamente a la cantidad de energía disipada acumulada aplicada, azul tripán y fluídica durante la facoemulsificación. Sin embargo, la diferencia en la experiencia laboral no se vinculó a la pérdida de células endoteliales corneales tras los procedimientos realizados.
Notas
Roles y contribuciones de autoría
FC: conceptualización, metodología, validación de datos, investigación, materiales, redacción (preparación del borrador original), escritura (revisión y edición), revisión y presentación, supervisión, administración de proyectos.
CB: conceptualización, metodología, validación de datos, análisis formal, investigación, materiales, redacción (preparación del borrador original), escritura (revisión y edición), revisión y presentación, supervisión, administración de proyecto.
CL: conceptualización, metodología, validación de datos, análisis formal, investigación, materiales, redacción (preparación del borrador original), escritura (revisión y edición), revisión y presentación, supervisión, administración de proyecto.
AL: conceptualización, metodología, materiales, redacción (preparación del borrador original), escritura (revisión y edición), revisión y presentación.
MA: conceptualización, metodología, validación de datos, análisis formal, investigación, redacción (preparación del borrador original), escritura (revisión y edición), revisión y presentación, supervisión, administración de proyectos.
JS: conceptualización, metodología, redacción (preparación del borrador original), escritura (revisión y edición), revisión y presentación.
EM: conceptualización, metodología, validación de datos, análisis formal, investigación, redacción (preparación del borrador original), escritura (revisión y edición), revisión y presentación, supervisión, administración de proyectos.
Declaración de financiamiento
Los autores declaran que no hubo fuentes de financiación externas.
Declaración de conflictos de interés
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Aspectos éticos
La Revista tiene constancia de que este estudio fue aprobado por el comité ético del Servicio de Salud Valparaíso-San Antonio en la Resolución exenta N° 8409 del 10 de julio de 2017.
Nota del editor
El autor principal o responsable afirma que este manuscrito es una transcripción honesta, precisa y transparente del estudio que se informa; que no se ha omitido ningún aspecto importante del estudio; y que las discrepancias entre los resultados del estudio y los previstos (si fueran relevantes) se han registrado y explicado.

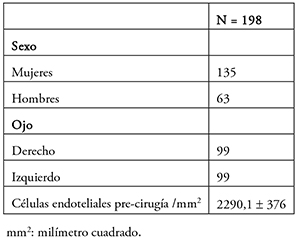 Tabla 1. Características de los pacientes incluidos en el estudio.
Tabla 1. Características de los pacientes incluidos en el estudio.

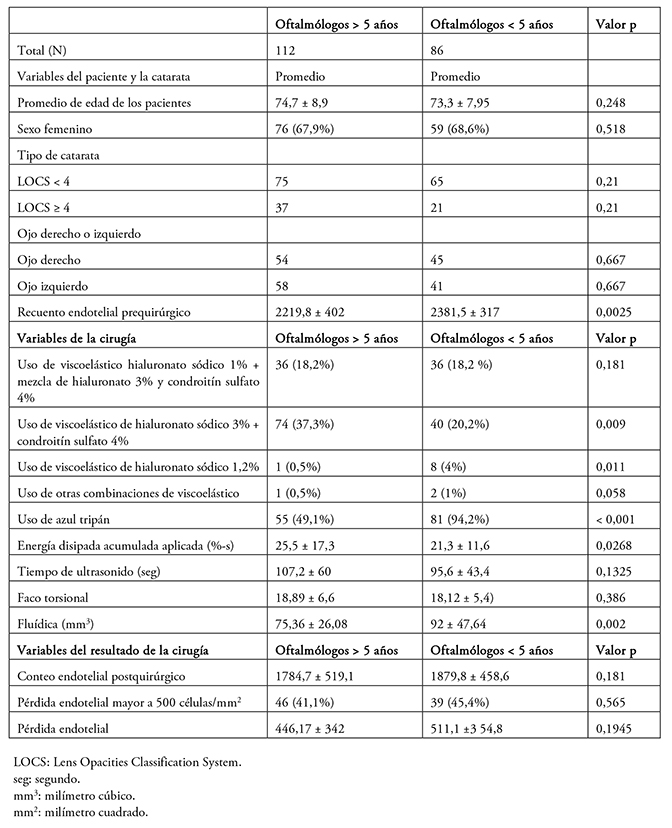 Tabla 2. Variables evaluadas según experiencia del oftalmólogo.
Tabla 2. Variables evaluadas según experiencia del oftalmólogo.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Introducción
La facoéresis es el procedimiento en que se extrae quirúrgicamente el cristalino para tratar las cataratas. La pérdida endotelial corneal es una complicación reconocida. Si bien se han descrito diversos factores asociados a este daño, la experiencia del cirujano ha sido poco explorada.
Objetivos
Evaluar la asociación entre la experiencia del cirujano y otras variables asociadas a la pérdida celular endotelial en el contexto de la facoéresis.
Métodos
Se analizaron prospectivamente los registros clínicos de 198 pacientes operados por cataratas, evaluando el efecto de la experiencia del cirujano y otras variables asociadas: energía disipada acumulada, tipo de viscoelástico empleado, uso de azul tripán, cantidad de fluídica, tiempo de ultrasonido, energía de facoemulsificación combinada y recuento celular endotelial pre y postoperatorio.
Resultados
No se observaron diferencias en el conteo postoperatorio de células endoteliales. Los oftalmólogos con más de cinco años de experiencia presentaron menor uso de azul tripán pero mayor cantidad de energía disipada acumulada en cada procedimiento, mientras que los oftalmólogos con menor experiencia utilizaron mayor cantidad de fluídica.
Conclusiones
Aunque hubo diferencias en el manejo de algunos factores influyentes sobre la pérdida endotelial cornal según la experiencia de los oftalmólogos, no se hallaron diferencias en relación a dicha pérdida como resultado final.
 Authors:
Fernando Chamorro[1], Cristóbal Briones[1], Cristóbal Loézar[2], Álex León[3], Marcelo Arancibia[2], Jana Stojanova[2], Eva Madrid[2]
Authors:
Fernando Chamorro[1], Cristóbal Briones[1], Cristóbal Loézar[2], Álex León[3], Marcelo Arancibia[2], Jana Stojanova[2], Eva Madrid[2]
Affiliation:
[1] Escuela de Medicina, Facultad de Medicina, Universidad de Valparaíso, Chile
[2] Centro Interdisciplinario de Estudios en Salud (CIESAL), Universidad de Valparaíso, Chile
[3] Servicio de Oftalmología, Hospital Carlos van Buren, Valparaíso, Chile
E-mail: marcelo.arancibiame@uv.cl
Author address:
[1] Facultad de Medicina
Universidad de Valparaíso
Angamos 655
Viña del Mar
Chile

Citation: Chamorro F, Briones C, Loézar C, León A, Arancibia M, Stojanova J, et al. Corneal endothelial cell loss associated to phacoemulsification and ophthalmologist experience: prospective analysis of individual secondary data. Medwave 2018;18(6) doi: 10.5867/medwave.2018.06.7314
Submission date: 6/7/2018
Acceptance date: 21/9/2018
Publication date: 29/10/2018
Origin: not requested
Type of review: reviewed by three external peer reviewers, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Pascolini D, Mariotti SP. Global estimates of visual impairment: 2010. Br J Ophthalmol. 2012 May;96(5):614-8. | CrossRef | PubMed |
- Wittenborn JS, Zhang X, Feagan CW, Crouse WL, Shrestha S, Kemper AR, Hoerger TJ, et al. The economic burden of vision loss and eye disorders among the United States population younger than 40 years. Ophthalmology. 2013 Sep;120(9):1728-35. | CrossRef | PubMed |
- Gobierno de Chile, Ministerio de Salud. Encuesta Nacional de Salud 2009-2010. Santiago, Chile:MINSAL; 2010.
- Sorrentino FS, Bonifazzi C, Parmeggiani F, Perri P. A Pilot Study to Propose a "Harm Scale", a New Method to Predict Risk of Harm to the Corneal Endothelium Caused by Longitudinal Phacoemulsification, and the Subsequent Effect of Endothelial Damage on Post Operative Visual Acuity. PLoS One. 2016 Jan 13;11(1):e0146580. | CrossRef | PubMed |
- Kelman CD. Phaco-Emulsification and Aspiration: A New Technique of Cataract emoval: A Preliminary Report. Am J Ophthalmol. 2018 Jul;191:xxx-xl. | CrossRef | PubMed |
- Bourne RR, Minassian DC, Dart JK, Rosen P, Kaushal S, Wingate N. Effect of cataract surgery on the corneal endothelium: modern phacoemulsification compared with extracapsular cataract surgery. Ophthalmology. 2004 Apr;111(4):679-85. | PubMed |
- Rosado-Adames N, Afshari NA. The changing fate of the corneal endothelium in cataract surgery. Curr Opin Ophthalmol. 2012 Jan;23(1):3-6. | CrossRef | PubMed |
- DelMonte DW, Kim T. Anatomy and physiology of the cornea. J Cataract Refract Surg. 2011 Mar;37(3):588-98. | CrossRef | PubMed |
- McCarey BE, Edelhauser HF, Lynn MJ. Review of corneal endothelial specular microscopy for FDA clinical trials of refractive procedures, surgical devices, and new intraocular drugs and solutions. Cornea. 2008 Jan;27(1):1-16. | CrossRef | PubMed |
- Bourne WM. Biology of the corneal endothelium in health and disease. Eye (Lond). 2003 Nov;17(8):912-8. | PubMed |
- Powe NR, Schein OD, Gieser SC, Tielsch JM, Luthra R, Javitt J, et al. Synthesis of the literature on visual acuity and complications following cataract extraction with intraocular lens implantation. Cataract Patient Outcome Research Team. Arch Ophthalmol. 1994 Feb;112(2):239-52. Erratum in: Arch Ophthalmol 1994 Jul;112(7):889. | PubMed |
- Cheng H, Law AB, McPherson K, Price NC. Longitudinal study of intraocular lens implants after intracapsular cataract extraction. Complete follow-up of the first 7 years. Trans Ophthalmol Soc U K. 1981;101(1):79-83. | PubMed |
- Bowling B. Kanski's Clinical Ophtalmology 8th Edition. Philadelphia, US. Saunders; 2015. | Link |
- Lee RY, Chen RI, Kasuga T, Cui QN, Porco TC, Lin SC. The Effect of Cumulative Dissipated Energy on Changes in Intraocular Pressure After Uncomplicated Cataract Surgery by Phacoemulsification. J Glaucoma. 2016 Jul;25(7):565-70. | CrossRef | PubMed |
- Pirazzoli G, D'Eliseo D, Ziosi M, Acciarri R. Effects of phacoemulsification time on the corneal endothelium using phacofracture and phaco chop techniques. J Cataract Refract Surg. 1996 Sep;22(7):967-9. | PubMed |
- Gonen T, Sever O, Horozoglu F, Yasar M, Keskinbora KH. Endothelial cell loss: Biaxial small-incision torsional phacoemulsification versus biaxial small-incision longitudinal phacoemulsification. J Cataract Refract Surg. 2012 Nov;38(11):1918-24. | CrossRef | PubMed |
- Sorrentino FS, Matteini S, Imburgia A, Bonifazzi C, Sebastiani A, Parmeggiani F. Torsional phacoemulsification: A pilot study to revise the "harm scale" evaluating the endothelial damage and the visual acuity after cataract surgery. PLoS One. 2017 Oct 26;12(10):e0186975. | CrossRef | PubMed |
- Faramarzi A, Javadi MA, Karimian F, Jafarinasab MR, Baradaran-Rafii A, Jafari F, Yaseri M. Corneal endothelial cell loss during phacoemulsification: bevel-up versus bevel-down phaco tip. J Cataract Refract Surg. 2011 Nov;37(11):1971-6. | CrossRef | PubMed |
- Cho YK, Chang HS, Kim MS. Risk factors for endothelial cell loss after phacoemulsification: comparison in different anterior chamber depth groups. Korean J Ophthalmol. 2010 Feb;24(1):10-5. | CrossRef | PubMed |
- Hayashi K, Hayashi H, Nakao F, Hayashi F. Risk factors for corneal endothelial injury during phacoemulsification. J Cataract Refract Surg. 1996 Oct;22(8):1079-84. | PubMed |
- Veckeneer M, van Overdam K, Monzer J, Kobuch K, van Marle W, Spekreijse H, et al. Ocular toxicity study of trypan blue injected into the vitreous cavity of rabbit eyes. Graefes Arch Clin Exp Ophthalmol. 2001 Sep;239(9):698-704. | PubMed |
- van Dooren BT, Beekhuis WH, Pels E. Biocompatibility of trypan blue with human corneal cells. Arch Ophthalmol. 2004 May;122(5):736-42. | PubMed |
- Pelit A. Unintentional staining of the posterior lens capsule with trypan blue dye during phacoemulsification: case report. Int Ophthalmol. 2012 Apr;32(2):187-9. | CrossRef | PubMed |
- Verges C, Cazal J, Lavin C. Surgical strategies in patients with cataract and glaucoma. Curr Opin Ophthalmol. 2005 Feb;16(1):44-52. | PubMed |
- Rossetti L, Chaudhuri J, Dickersin K. Medical prophylaxis and treatment of cystoid macular edema after cataract surgery. The results of a meta-analysis. Ophthalmology. 1998 Mar;105(3):397-405. | PubMed |
- Baradaran-Rafii A, Rahmati-Kamel M, Eslani M, Kiavash V, Karimian F. Effect of hydrodynamic parameters on corneal endothelial cell loss after phacoemulsification. J Cataract Refract Surg. 2009 Apr;35(4):732-7. | CrossRef | PubMed |
- Das S, Nanaiah SG, Kummelil MK, Nagappa S, Shetty R, Shetty BK. Effect of fluidics on corneal endothelial cell density, central corneal thickness, and central macular thickness after phacoemulsification with torsional ultrasound. Indian journal of ophthalmology. 2015;63(8):641-4. | CrossRef |
 Pascolini D, Mariotti SP. Global estimates of visual impairment: 2010. Br J Ophthalmol. 2012 May;96(5):614-8. | CrossRef | PubMed |
Pascolini D, Mariotti SP. Global estimates of visual impairment: 2010. Br J Ophthalmol. 2012 May;96(5):614-8. | CrossRef | PubMed | Wittenborn JS, Zhang X, Feagan CW, Crouse WL, Shrestha S, Kemper AR, Hoerger TJ, et al. The economic burden of vision loss and eye disorders among the United States population younger than 40 years. Ophthalmology. 2013 Sep;120(9):1728-35. | CrossRef | PubMed |
Wittenborn JS, Zhang X, Feagan CW, Crouse WL, Shrestha S, Kemper AR, Hoerger TJ, et al. The economic burden of vision loss and eye disorders among the United States population younger than 40 years. Ophthalmology. 2013 Sep;120(9):1728-35. | CrossRef | PubMed | Gobierno de Chile, Ministerio de Salud. Encuesta Nacional de Salud 2009-2010. Santiago, Chile:MINSAL; 2010.
Gobierno de Chile, Ministerio de Salud. Encuesta Nacional de Salud 2009-2010. Santiago, Chile:MINSAL; 2010.  Sorrentino FS, Bonifazzi C, Parmeggiani F, Perri P. A Pilot Study to Propose a "Harm Scale", a New Method to Predict Risk of Harm to the Corneal Endothelium Caused by Longitudinal Phacoemulsification, and the Subsequent Effect of Endothelial Damage on Post Operative Visual Acuity. PLoS One. 2016 Jan 13;11(1):e0146580. | CrossRef | PubMed |
Sorrentino FS, Bonifazzi C, Parmeggiani F, Perri P. A Pilot Study to Propose a "Harm Scale", a New Method to Predict Risk of Harm to the Corneal Endothelium Caused by Longitudinal Phacoemulsification, and the Subsequent Effect of Endothelial Damage on Post Operative Visual Acuity. PLoS One. 2016 Jan 13;11(1):e0146580. | CrossRef | PubMed | Kelman CD. Phaco-Emulsification and Aspiration: A New Technique of Cataract emoval: A Preliminary Report. Am J Ophthalmol. 2018 Jul;191:xxx-xl. | CrossRef | PubMed |
Kelman CD. Phaco-Emulsification and Aspiration: A New Technique of Cataract emoval: A Preliminary Report. Am J Ophthalmol. 2018 Jul;191:xxx-xl. | CrossRef | PubMed | Bourne RR, Minassian DC, Dart JK, Rosen P, Kaushal S, Wingate N. Effect of cataract surgery on the corneal endothelium: modern phacoemulsification compared with extracapsular cataract surgery. Ophthalmology. 2004 Apr;111(4):679-85. | PubMed |
Bourne RR, Minassian DC, Dart JK, Rosen P, Kaushal S, Wingate N. Effect of cataract surgery on the corneal endothelium: modern phacoemulsification compared with extracapsular cataract surgery. Ophthalmology. 2004 Apr;111(4):679-85. | PubMed | Rosado-Adames N, Afshari NA. The changing fate of the corneal endothelium in cataract surgery. Curr Opin Ophthalmol. 2012 Jan;23(1):3-6. | CrossRef | PubMed |
Rosado-Adames N, Afshari NA. The changing fate of the corneal endothelium in cataract surgery. Curr Opin Ophthalmol. 2012 Jan;23(1):3-6. | CrossRef | PubMed | DelMonte DW, Kim T. Anatomy and physiology of the cornea. J Cataract Refract Surg. 2011 Mar;37(3):588-98. | CrossRef | PubMed |
DelMonte DW, Kim T. Anatomy and physiology of the cornea. J Cataract Refract Surg. 2011 Mar;37(3):588-98. | CrossRef | PubMed | McCarey BE, Edelhauser HF, Lynn MJ. Review of corneal endothelial specular microscopy for FDA clinical trials of refractive procedures, surgical devices, and new intraocular drugs and solutions. Cornea. 2008 Jan;27(1):1-16. | CrossRef | PubMed |
McCarey BE, Edelhauser HF, Lynn MJ. Review of corneal endothelial specular microscopy for FDA clinical trials of refractive procedures, surgical devices, and new intraocular drugs and solutions. Cornea. 2008 Jan;27(1):1-16. | CrossRef | PubMed | Bourne WM. Biology of the corneal endothelium in health and disease. Eye (Lond). 2003 Nov;17(8):912-8. | PubMed |
Bourne WM. Biology of the corneal endothelium in health and disease. Eye (Lond). 2003 Nov;17(8):912-8. | PubMed | Powe NR, Schein OD, Gieser SC, Tielsch JM, Luthra R, Javitt J, et al. Synthesis of the literature on visual acuity and complications following cataract extraction with intraocular lens implantation. Cataract Patient Outcome Research Team. Arch Ophthalmol. 1994 Feb;112(2):239-52. Erratum in: Arch Ophthalmol 1994 Jul;112(7):889. | PubMed |
Powe NR, Schein OD, Gieser SC, Tielsch JM, Luthra R, Javitt J, et al. Synthesis of the literature on visual acuity and complications following cataract extraction with intraocular lens implantation. Cataract Patient Outcome Research Team. Arch Ophthalmol. 1994 Feb;112(2):239-52. Erratum in: Arch Ophthalmol 1994 Jul;112(7):889. | PubMed | Cheng H, Law AB, McPherson K, Price NC. Longitudinal study of intraocular lens implants after intracapsular cataract extraction. Complete follow-up of the first 7 years. Trans Ophthalmol Soc U K. 1981;101(1):79-83. | PubMed |
Cheng H, Law AB, McPherson K, Price NC. Longitudinal study of intraocular lens implants after intracapsular cataract extraction. Complete follow-up of the first 7 years. Trans Ophthalmol Soc U K. 1981;101(1):79-83. | PubMed | Lee RY, Chen RI, Kasuga T, Cui QN, Porco TC, Lin SC. The Effect of Cumulative Dissipated Energy on Changes in Intraocular Pressure After Uncomplicated Cataract Surgery by Phacoemulsification. J Glaucoma. 2016 Jul;25(7):565-70. | CrossRef | PubMed |
Lee RY, Chen RI, Kasuga T, Cui QN, Porco TC, Lin SC. The Effect of Cumulative Dissipated Energy on Changes in Intraocular Pressure After Uncomplicated Cataract Surgery by Phacoemulsification. J Glaucoma. 2016 Jul;25(7):565-70. | CrossRef | PubMed | Pirazzoli G, D'Eliseo D, Ziosi M, Acciarri R. Effects of phacoemulsification time on the corneal endothelium using phacofracture and phaco chop techniques. J Cataract Refract Surg. 1996 Sep;22(7):967-9. | PubMed |
Pirazzoli G, D'Eliseo D, Ziosi M, Acciarri R. Effects of phacoemulsification time on the corneal endothelium using phacofracture and phaco chop techniques. J Cataract Refract Surg. 1996 Sep;22(7):967-9. | PubMed | Gonen T, Sever O, Horozoglu F, Yasar M, Keskinbora KH. Endothelial cell loss: Biaxial small-incision torsional phacoemulsification versus biaxial small-incision longitudinal phacoemulsification. J Cataract Refract Surg. 2012 Nov;38(11):1918-24. | CrossRef | PubMed |
Gonen T, Sever O, Horozoglu F, Yasar M, Keskinbora KH. Endothelial cell loss: Biaxial small-incision torsional phacoemulsification versus biaxial small-incision longitudinal phacoemulsification. J Cataract Refract Surg. 2012 Nov;38(11):1918-24. | CrossRef | PubMed | Sorrentino FS, Matteini S, Imburgia A, Bonifazzi C, Sebastiani A, Parmeggiani F. Torsional phacoemulsification: A pilot study to revise the "harm scale" evaluating the endothelial damage and the visual acuity after cataract surgery. PLoS One. 2017 Oct 26;12(10):e0186975. | CrossRef | PubMed |
Sorrentino FS, Matteini S, Imburgia A, Bonifazzi C, Sebastiani A, Parmeggiani F. Torsional phacoemulsification: A pilot study to revise the "harm scale" evaluating the endothelial damage and the visual acuity after cataract surgery. PLoS One. 2017 Oct 26;12(10):e0186975. | CrossRef | PubMed | Faramarzi A, Javadi MA, Karimian F, Jafarinasab MR, Baradaran-Rafii A, Jafari F, Yaseri M. Corneal endothelial cell loss during phacoemulsification: bevel-up versus bevel-down phaco tip. J Cataract Refract Surg. 2011 Nov;37(11):1971-6. | CrossRef | PubMed |
Faramarzi A, Javadi MA, Karimian F, Jafarinasab MR, Baradaran-Rafii A, Jafari F, Yaseri M. Corneal endothelial cell loss during phacoemulsification: bevel-up versus bevel-down phaco tip. J Cataract Refract Surg. 2011 Nov;37(11):1971-6. | CrossRef | PubMed | Cho YK, Chang HS, Kim MS. Risk factors for endothelial cell loss after phacoemulsification: comparison in different anterior chamber depth groups. Korean J Ophthalmol. 2010 Feb;24(1):10-5. | CrossRef | PubMed |
Cho YK, Chang HS, Kim MS. Risk factors for endothelial cell loss after phacoemulsification: comparison in different anterior chamber depth groups. Korean J Ophthalmol. 2010 Feb;24(1):10-5. | CrossRef | PubMed | Hayashi K, Hayashi H, Nakao F, Hayashi F. Risk factors for corneal endothelial injury during phacoemulsification. J Cataract Refract Surg. 1996 Oct;22(8):1079-84. | PubMed |
Hayashi K, Hayashi H, Nakao F, Hayashi F. Risk factors for corneal endothelial injury during phacoemulsification. J Cataract Refract Surg. 1996 Oct;22(8):1079-84. | PubMed | Veckeneer M, van Overdam K, Monzer J, Kobuch K, van Marle W, Spekreijse H, et al. Ocular toxicity study of trypan blue injected into the vitreous cavity of rabbit eyes. Graefes Arch Clin Exp Ophthalmol. 2001 Sep;239(9):698-704. | PubMed |
Veckeneer M, van Overdam K, Monzer J, Kobuch K, van Marle W, Spekreijse H, et al. Ocular toxicity study of trypan blue injected into the vitreous cavity of rabbit eyes. Graefes Arch Clin Exp Ophthalmol. 2001 Sep;239(9):698-704. | PubMed | van Dooren BT, Beekhuis WH, Pels E. Biocompatibility of trypan blue with human corneal cells. Arch Ophthalmol. 2004 May;122(5):736-42. | PubMed |
van Dooren BT, Beekhuis WH, Pels E. Biocompatibility of trypan blue with human corneal cells. Arch Ophthalmol. 2004 May;122(5):736-42. | PubMed | Pelit A. Unintentional staining of the posterior lens capsule with trypan blue dye during phacoemulsification: case report. Int Ophthalmol. 2012 Apr;32(2):187-9. | CrossRef | PubMed |
Pelit A. Unintentional staining of the posterior lens capsule with trypan blue dye during phacoemulsification: case report. Int Ophthalmol. 2012 Apr;32(2):187-9. | CrossRef | PubMed | Verges C, Cazal J, Lavin C. Surgical strategies in patients with cataract and glaucoma. Curr Opin Ophthalmol. 2005 Feb;16(1):44-52. | PubMed |
Verges C, Cazal J, Lavin C. Surgical strategies in patients with cataract and glaucoma. Curr Opin Ophthalmol. 2005 Feb;16(1):44-52. | PubMed | Rossetti L, Chaudhuri J, Dickersin K. Medical prophylaxis and treatment of cystoid macular edema after cataract surgery. The results of a meta-analysis. Ophthalmology. 1998 Mar;105(3):397-405. | PubMed |
Rossetti L, Chaudhuri J, Dickersin K. Medical prophylaxis and treatment of cystoid macular edema after cataract surgery. The results of a meta-analysis. Ophthalmology. 1998 Mar;105(3):397-405. | PubMed | Baradaran-Rafii A, Rahmati-Kamel M, Eslani M, Kiavash V, Karimian F. Effect of hydrodynamic parameters on corneal endothelial cell loss after phacoemulsification. J Cataract Refract Surg. 2009 Apr;35(4):732-7. | CrossRef | PubMed |
Baradaran-Rafii A, Rahmati-Kamel M, Eslani M, Kiavash V, Karimian F. Effect of hydrodynamic parameters on corneal endothelial cell loss after phacoemulsification. J Cataract Refract Surg. 2009 Apr;35(4):732-7. | CrossRef | PubMed | Das S, Nanaiah SG, Kummelil MK, Nagappa S, Shetty R, Shetty BK. Effect of fluidics on corneal endothelial cell density, central corneal thickness, and central macular thickness after phacoemulsification with torsional ultrasound. Indian journal of ophthalmology. 2015;63(8):641-4. | CrossRef |
Das S, Nanaiah SG, Kummelil MK, Nagappa S, Shetty R, Shetty BK. Effect of fluidics on corneal endothelial cell density, central corneal thickness, and central macular thickness after phacoemulsification with torsional ultrasound. Indian journal of ophthalmology. 2015;63(8):641-4. | CrossRef |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis








