Key Words: elderly, dementia, cognitive decline, Peruvian
Resumen
INTRODUCCIÓN
Se estima que los trastornos neurocognitivos mayores afectarán a 115,4 millones de personas en 2050, lo que representa una carga financiera importante para la sociedad. Asimismo, la dependencia funcional para actividades básicas o instrumentales de la vida diaria suele ser consecuencia de la mayor prevalencia de patologías discapacitantes, y de la progresiva disminución de la reserva fisiológica propia del envejecimiento.
OBJETIVOS
Se persiguen dos objetivos: determinar la relación entre los test funcionales y la predicción de deterioro de funciones cognitivas en pacientes geriátricos; y establecer qué factores están asociados a disminución de las funciones cognitivas en pacientes geriátricos.
MÉTODOS
Estudio de tipo cohorte retrospectiva. Incluimos participantes que acudieron a los servicios ambulatorios de geriatría del Centro Médico Naval de Perú desde 2010 hasta 2014. Se formaron dos grupos, el primero con los que presentaron pérdida fisiológica de funciones cognitivas, definida como la disminución menor a 4,1 puntos en el puntaje del Mini Mental State Examination durante el seguimiento y otro con una pérdida patológica de funciones cognitivas, definida como la disminución de 4,2 puntos en promedio o más en el puntaje de esta misma encuesta durante el seguimiento. Los pacientes fueron seguidos por cuatro años, período en el que se les efectuaron evaluaciones funcionales y se recogieron datos de comorbilidades y factores sociodemográficos.
RESULTADOS
Se incluyeron 368 pacientes, cuya media de edad fue de 75,8 años y 50,91% fueron hombres. El género femenino (53,72%), la presencia de un bajo grado de instrucción (62,81%) y la presencia de comorbilidades fueron más prevalentes en el grupo con disminución de Mini Mental State Examination patológico. Las variables de evaluación funcional, incluyendo al Timed Up & Go Test, presentaron promedios inadecuados durante el seguimiento de cuatro años en el grupo con evolución patológica del puntaje del Mini Mental State Examination, en comparación con el grupo sano.
CONCLUSIONES
Los valores del puntaje del Timed Up & Go Test logran predecir el riesgo de una disminución patológica del Mini Mental State Examination, independientemente de factores sociodemográficos, comorbilidades y valoración funcional.
Introducción
Los trastornos neurocognitivos mayores se definen como el deterioro de uno o más dominios cognitivos, que interfieren con la independencia en las actividades cotidianas [1]. Se estima que hay alrededor de 35,6 millones de personas que viven con deterioro cognitivo en todo el mundo y se presume que aumente a 65,7 millones en 2030 y 115,4 millones en 2050 [2]. Además, estos trastornos representan una carga financiera importante para la sociedad, similar a la ocasionada por enfermedades cardiovasculares y cáncer [3].
El Mini-Mental State Examination es todavía el test cognitivo más utilizado en todo el mundo, conocido para detectar la sospecha de deterioro cognitivo, determinar el grado de deterioro y ser útil para el seguimiento a lo largo del tiempo. Este evalúa diferentes dominios cognoscitivos como orientación, registro o memoria de fijación, concentración y cálculo, recuerdo diferido, lenguaje y construcción [4]. Existen distintas versiones del test, validadas en múltiples países e idiomas, cada una adaptada a la realidad de cada país y con puntos de corte propios [5].
Por otro lado, la dependencia funcional para actividades básicas o instrumentales de la vida diaria suele ser consecuencia de la mayor prevalencia de patologías discapacitantes, y de la progresiva disminución de la reserva fisiológica propia del envejecimiento [6]. La dependencia funcional en adultos mayores puede medirse mediante índices (Barthel, Lawton) [7],[8]. Sin embargo, en los últimos años se han ido desarrollando instrumentos basados en ejecución que evalúan rendimiento físico y logran predecir fragilidad, mortalidad, dismovilidad y discapacidad [9],[10], siendo parte importante de la evaluación funcional de adultos mayores. Entre las más utilizadas tenemos el Timed Up & Go Test [11], el Short Physical Performance Battery [12] y la velocidad de marcha.
Existe evidencia de que las pruebas que incluyen velocidad de marcha en adultos mayores logran determinar riesgo elevado de trastornos neurocognitivos en ellos. En relación a esto, existen puntos de corte de velocidad de marcha conocidos que pueden orientar al clínico que evalúa este tipo de pacientes. Sin embargo, el Timed Up & Go Test, que además de evaluar la marcha evalúa la capacidad de levantarse de una silla, no cuenta con evidencia científica suficiente que lo vincule a incidencia elevada de trastornos neurocognitivos [13],[14]. Adicionalmente, la mayoría de estudios que destacan la asociación entre velocidad de marcha lenta y riesgo alto de trastornos neurocognitivos, definen la presencia de deterioro cognitivo con puntos de corte estáticos de distintos cuestionarios, habiendo encontrado muy escasa evidencia de variaciones del puntaje del Mini Mental State Examination como definición de casos nuevos de trastornos neurocognitivos [15],[16].
Por ello, evaluar valores alterados en el Timed Up & Go Test y su asociación con disminución en el tiempo del puntaje de Mini Mental State Examination, contribuirá en la evaluación física, funcional y mental de esta población, facilitando la estratificación de riesgo de trastornos neurocognitivos y la toma de decisiones por parte del personal de salud.
Métodos
Diseño de estudio
Estudio de tipo cohorte retrospectiva.
Población: participantes que acudieron a los servicios ambulatorios de geriatría del Centro Médico Naval de Perú desde 2010 hasta 2014, y que aceptaron participar del estudio [17].
Criterios de inclusión: pacientes cognitivamente sanos, que presentaron un puntaje de Mini Mental State Examination de 25 o más y un test Pfeiffer con tres errores o menos.
Criterios de exclusión: pacientes que presentaron el diagnóstico de enfermedad vascular cerebral, enfermedad de Parkinson u otra enfermedad neurodegenerativa (esclerosis lateral amiotrófica, Parkinson plus, Huntington), alcoholismo, déficit de vitamina B12, déficit de ácido fólico, hipotiroidismo, uso de antidemenciales y/o antipsicóticos o que el paciente no haya accedido a participar en el estudio.
Muestra
Nuestra población de estudio fue de 1277 pacientes adultos mayores de niveles asistenciales ambulatorios del servicio de geriatría del Centro Médico Naval de Perú, participantes de un estudio de cohortes [17]. Sólo 368 participantes cumplieron los criterios de inclusión y exclusión. De ellos, 21 no tenían datos completos de seguimiento y 17 fallecieron en el transcurso del estudio, por lo que sus datos fueron excluidos. Por ello, el tamaño muestral final ascendió a 330 participantes.
A los pacientes, reclutados desde enero de 2010, se les hizo un seguimiento anual de puntajes de escalas funcionales, cognitivas y de variables sociodemográficas de interés. Calculamos un poder estadístico de 91% para encontrar un promedio de variación del puntaje de Mini Mental State Examination de cinco puntos en ambos grupos [18].
Variables
Disminución del puntaje del Mini Mental State Examination
Utilizamos la versión peruana del Mini Mental State Examination [19] (puntaje de 0 a 30) para definir la evolución de problemas cognitivos. En cuanto a la disminución de este puntaje, se hizo un seguimiento anual de las variaciones del mismo y se crearon dos categorías:
a) Disminución fisiológica de funciones cognitivas, definida como la reducción inferior a 4,1 puntos en el puntaje del Mini Mental State Examination durante el seguimiento.
b) Disminución patológica de funciones cognitivas, entendida como la rebaja de 4,2 puntos en promedio o más en el puntaje del Mini Mental State Examination durante el seguimiento [15],[16].
Test funcionales: se aplicaron en el gimnasio de la clínica de día del servicio de geriatría del Centro Médico Naval de Perú.
-Timed Up & Go Test: se solicitó al participante que tome asiento en una silla de 45,8 centímetros de alto, con braceras. Posteriormente se le dieron las siguientes indicaciones: “Tome asiento en la silla, con la espalda en el respaldo y sus brazos en las braceras. Cuando diga la palabra ‛listo’, levántese y camine hacia la línea dibujada en el suelo a su velocidad habitual, luego gire y regrese hasta sentarse de nuevo en la silla”. El cronómetro fue iniciado al decir la palabra “listo” y detenido cuando el paciente se sentó. La distancia entre la silla y la línea del suelo fue de tres metros. La variable se utilizó como numérica, sin puntos de corte [20].
-Short Physical Performance Battery: puntaje de 0 a 12. Se trata de tres pruebas de 0 a 4 puntos cada una:
a) Equilibrio: se invitó al participante a mantenerse de pie con los pies en paralelo y en posición semi-tándem. Si mantuvieron el equilibrio adecuadamente por 10 segundos, se les consideró un punto para cada posición. Al invitar al participante a mantener el equilibrio en posición tándem, se le dio un punto si logró mantenerse entre tres y nueve segundos y dos puntos si llegó a 10 segundos.
b) Marcha: se invitó a los participantes a caminar a velocidad habitual una distancia de cuatro metros. Se asignó puntaje según el tiempo obtenido por cada paciente. Se dio 4 puntos a <4,82 segundos, 3 puntos entre 4,82 y 6,20 segundos, 2 puntos entre 6,21 y 8,7 segundos, 1 punto a >8,7 segundos y 0 puntos si el participante no pudo completar la prueba.
c) Levantarse de la silla: se invitó al participante a levantarse y sentarse de una silla sin braceras cinco veces, con los brazos cruzados sobre el pecho (silla de 44,3 centímetros de altura). Se asignó puntaje según el tiempo que demoró el participante, 4 puntos si tardó ≤ 11,19 segundos, 3 puntos entre 11,20 y 13,69 segundos, 2 puntos entre 13,70 y 16,79 segundos, 1 punto >16,70 segundos y 0 puntos si el participante no pudo completar la prueba. La variable fue utilizada como numérica (0-12), sin puntos de corte [21].
Índice de Barthel: es un cuestionario sobre 10 actividades básicas de la vida diaria (alimentación, ducha, vestirse, uso del sanitario, traslado cama-sillón, movilidad, uso de escaleras, aseo, continencia urinaria y fecal), con un puntaje total que va de 0 a 100. Se analizó como variable numérica [22].
Índice de Lawton: cuestionario sobre ocho actividades instrumentales de la vida diaria (uso del teléfono, ir de compras, preparación de alimentos, cuidar la casa, medios de transporte, lavado de ropa, medicación y uso de dinero). Puntaje de 0 a 8, se analizó como variable numérica [23].
Variables sociodemográficas: edad en años según historia clínica, sexo del participante según fenotipo y grado de instrucción según reporte de historia clínica.
Antecedentes patológicos: se recabaron los antecedentes de depresión, hipertensión arterial, diabetes tipo 2, insuficiencia cardiaca y enfermedad pulmonar obstructiva crónica, definidos como presencia de los mismos en la historia clínica geriátrica.
Aspectos éticos
El presente trabajo cuenta con la aprobación del Comité de Ética del Centro Médico Naval. Se preservó la integridad y los derechos fundamentales de los pacientes sujetos a investigación, de acuerdo con los lineamientos de las buenas prácticas clínicas y de ética en investigación biomédica.
Análisis estadístico
El análisis bivariado se realizó comparando dos grupos, según la variable desenlace: disminución del puntaje del Mini Mental State Examination (fisiológica versus patológica). Para las variables numéricas se utilizó t de Student y para las categóricas, Chi-cuadrado. Posteriormente se construyó un modelo de regresión de Cox, incluyendo tiempo de seguimiento, evaluaciones anuales funcionales y cognitivas, ajustando el modelo final por variables sociodemográficas, comorbilidades y evaluación funcional para predicción de deterioro de funciones cognitivas según Mini Mental State Examination.
Resultados
Encontramos un promedio de edad de 75,8 años, una mayor presencia de participantes de sexo masculino (50,91%) y, en su mayoría, participantes con estudios escolares completos (60,30%). Al iniciar el seguimiento, encontramos una prevalencia de hipertensión arterial de 26,67%, de diabetes tipo 2 de 15,45%, de enfermedad pulmonar obstructiva crónica de 10,90%, de insuficiencia cardiaca de 8,79% y 30% de depresión. Asimismo, obtuvimos una media del puntaje del Índice de Barthel de 89,81, de Índice de Lawton de 5,34, de Short Physical Performance Battery de 8,63, de Timed Up & Go Test de 12,73 segundos y un promedio del puntaje del Mini Mental State Examination de 27,73 puntos. Sólo incluimos en el análisis bivariado la comparación inicial versus la realizada luego de cuatro años de seguimiento de las variables numéricas. Esto, porque las prevalencias de variables sociodemográficas y de antecedentes patológicos variaron muy poco y no fueron el objetivo principal de nuestro estudio (Ver Tabla 1).
En la Tabla 1 se aprecia también el análisis bivariado con respecto a los grupos con disminución patológica versus fisiológica del puntaje del Mini Mental State Examination. Al comparar el promedio de edad y su variación después de cuatro años en ambos grupos de estudio, no se encontraron diferencias significativas.
En relación al género, se aprecia una frecuencia mayor del sexo femenino en el grupo con disminución patológica de valores de Mini Mental State Examination, con diferencias estadísticamente significativas. Algo similar sucede con el grado de instrucción, donde apreciamos una clara asociación entre baja escolaridad y progresión patológica de trastornos neurocognitivos.
Con respecto a antecedentes patológicos, vemos una asociación estadísticamente significativa con hipertensión arterial, diabetes tipo 2, insuficiencia cardiaca y depresión, con prevalencias mayores de éstas en el grupo con disminución patológica del puntaje de Mini Mental State Examination, con resultados significativos estadísticamente, a excepción de la variable enfermedad pulmonar obstructiva crónica.
Adicionalmente, observamos los promedios de las escalas funcionales. Se demostró una ejecución física inadecuada en el grupo con evolución patológica del puntaje del Mini Mental State Examination, además de un deterioro marcado luego de cuatro años de seguimiento, encontrando significancia estadística para todas las variables (Ver Tabla 1).
Luego de construir un modelo de regresión de Cox, se calcularon los hazard ratios para comparar los riesgos de padecer una disminución patológica del puntaje del Mini Mental State Examination. Como en el análisis bivariado, no se encontraron diferencias con respecto a edad, pero sí para las variables sexo y grado de instrucción. En ellas, ser mujer y tener baja escolaridad se asociaron estadísticamente con nuestra variable de desenlace. En el análisis crudo se encontró significancia estadística con todas las variables, a excepción de edad y enfermedad pulmonar obstructiva crónica. Pese a ello, se decidió incluir a la variable edad en el modelo final, pues se le consideró un confusor conocido por la literatura. En el modelo multivariable, al calcular hazard ratios ajustados, encontramos significancia estadística en relación a todas las covariables a excepción de la edad. Se constató que el hazard ratio de una disminución patológica vs una disminución fisiológica del puntaje del Mini Mental State Examination fue de 1,73 (con un intervalo de confianza de 95% entre 1,41 y 1,96), en relación al Timed Up & Go Test expresado en segundos. Adicionalmente, se descartó la multicolinealidad entre el índice de Barthel, índice de Lawton, Short Physical Performance Battery y Timed Up & Go Test, utilizando la técnica del variance inflation factor (VIF).
Discusión
El objetivo principal del estudio fue determinar la relación entre el Timed Up & Go Test y la progresión de trastornos neurocognitivos. Encontramos que el Timed Up & Go Test se asoció significativamente con una disminución patológica del puntaje del Mini Mental State Examination, tomando en cuenta en el análisis evaluaciones funcionales, comorbilidades y factores sociodemográficos. Encontramos un promedio del puntaje del Timed Up & Go Test significativamente mayor (lo que se traduce en un peor rendimiento físico) en el grupo con disminución patológica del puntaje del Mini Mental State Examination que en el grupo de disminución fisiológica luego de cuatro años de seguimiento.
Asimismo, se evaluaron otros instrumentos de funcionalidad en adultos mayores. En ellos se detectó una evolución desfavorable para actividades básicas (índice de Barthel) e instrumentales (Índice de Lawton), más marcada en el grupo de disminución patológica del puntaje de Mini Mental State Examination. Algo similar ocurrió al evaluar el Short Physical Performance Battery, donde en ambos grupos hubo una disminución del promedio del puntaje, pero fue más evidente en el grupo de disminución patológica del puntaje del Mini Mental State Examination.
Un estudio de validación de Timed Up & Go Test para la predicción de caídas menciona una estrecha relación entre este y problemas cognitivos [11]. Sin embargo en estudios con respecto al deterioro cognitivo mínimo, una mala ejecución en el Timed Up & Go Test, no tuvo mayor significancia estadística [24]. No obstante, estudios de intervención con programas de rehabilitación demuestran mejoras en el Timed Up & Go Test en pacientes con deterioro cognitivo [11], demostrando que es una herramienta útil en el seguimiento de la evolución de este grupo de pacientes [18].
En relación a valoración de actividades de la vida diaria, existe evidencia que la pérdida de independencia para actividades básicas e instrumentales se asocia con deterioro cognitivo, en especial medido por el índice de Lawton [7]. Al respecto, una revisión sistemática concluye que la dependencia para actividades instrumentales logra predecir deterioro cognitivo, pero la dependencia de actividades básicas no está asociada [25]. En general, en pacientes con deterioro cognitivo se suele recomendar el uso de escalas para medir dependencias básicas e instrumentales de la vida diaria, pues ambas ayudan en la evaluación de este tipo de pacientes [26], además son parte de los criterios recomendados por Diagnostic and Statistical Manual of Mental Disorders V (DSMV) [27]. En relación al Short Physical Performance Battery, la literatura consultada nos revela que existe una peor ejecución física y muscular en pacientes con trastornos neurocognitivos, principalmente en lo que respecta a evaluación de la marcha [8],[26],[28]. Estos hallazgos van en la misma línea de lo encontrado en nuestro análisis.
En nuestro estudio encontramos una asociación entre hipertensión arterial, diabetes mellitus tipo 2, insuficiencia cardiaca y depresión con una disminución patológica del puntaje del Mini Mental State Examination. Nuestros resultados se asemejan a publicaciones similares, donde las citadas comorbilidades están asociadas con mayor presencia, mayor riesgo o mayor severidad de trastornos neurocognitivos [1],[29],[30],[31],[32],[33]. En la bibliografía consultada encontramos que en la mayoría de los estudios determinan una asociación entre enfermedad pulmonar obstructiva crónica y trastornos neurocognitivos [34]. Sin embargo, existe evidencia de que la asociación entre enfermedad pulmonar obstructiva crónica y deterioro cognitivo estaría influenciada por factores inflamatorios, hipoxemia y depresión, además de comorbilidades, por lo que esta asociación es controversial. Por otro lado, un estudio reciente acerca de los factores de riesgo para trastornos neurocognitivos señala al tabaquismo como el factor de riesgo más importante y no a la enfermedad pulmonar obstructiva crónica [34].
Adicionalmente exploramos la asociación con factores sociodemográficos y observamos un mayor riesgo de trastornos neurocognitivos en pacientes mujeres y con bajo grado de instrucción [35]. En la literatura revisada, la edad suele ser un factor de riesgo para deterioro cognitivo [15] pero nuestros resultados no concuerdan con esos hallazgos, aunque existe evidencia que en militares retirados, expuestos a estilos de vida distintos, el efecto de la edad en riesgo de deterioro cognitivo sería algo controversial [36].
La particularidad de los participantes incluidos en el presente estudio, pacientes militares retirados y sus familiares, plantea la posibilidad de que nuestros resultados posiblemente no se puedan extrapolar a la población general. En relación a ello, encontramos evidencia que los militares retirados, por tener una compensación económica de por vida, cuentan con mejor calidad de vida. Sin embargo existen publicaciones, con poblaciones similares, con resultados potencialmente comparables con poblaciones adultas mayores en nuestro medio [37]. Luego de realizar una extensa revisión de la literatura, hemos encontrado que algunas variables debieron haber sido agregadas en el análisis, como tabaquismo, obesidad, dislipidemia, trastornos del sueño y actividad física. De todos modos, las variables enfermedad pulmonar obstructiva crónica y Short Physical Performance Battery fueron incluidas en el análisis, por lo que puede ser que exista un ajuste estadístico indirecto en relación a hábito tabáquico y actividad física.
Finalmente, caemos en cuenta que el promedio de edad de nuestros participantes es menor al de estudios similares de deterioro cognitivo. Esto podría deberse a que nuestro muestreo fue según el rol de citas del Centro Médico Naval de Perú y no a una aleatorización.
Si bien existen escasas publicaciones que respalden el rol de Timed Up & Go Test [24] como predictor de mala evolución del puntaje del Mini Mental State Examination, hemos encontrado literatura que indica que una correcta intervención en temas físicos en pacientes con deterioro cognitivo podría lograr mejorías en el Timed Up & Go Test [12].
Conclusión
Nuestros resultados sustentan la hipótesis de que los valores del puntaje del Timed Up & Go Test logran predecir el riesgo de una disminución patológica del Mini Mental State Examination, independientemente de factores sociodemográficos, comorbilidades y valoración funcional. Recomendamos estudios de intervención en actividad física, sarcopenia y funcionalidad para reducir el riesgo de trastornos neurocognitivos en adultos mayores.
Notas
Aspectos éticos
La Revista tiene constancia de que el Comité de Ética e Investigación del Centro Médico Naval, tuvo conocimiento sobre este estudio y su posible publicación en una revista de difusión biomédica.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.
Nota del editor
El autor principal o responsable afirma que este manuscrito es una transcripción honesta, precisa y transparente del estudio que se informa; que no se ha omitido ningún aspecto importante del estudio; y que las discrepancias entre los resultados del estudio y los previstos (si fueran relevantes) se han registrado y explicado.

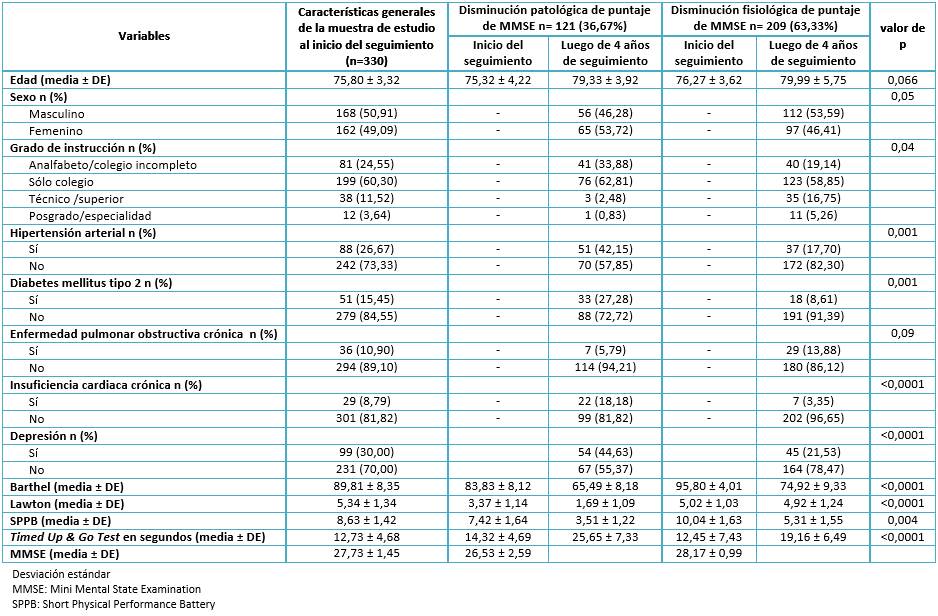 Tabla 1. Análisis bivariado basado en la disminución de funciones cognitivas luego de cuatro años de seguimiento (n=330).
Tabla 1. Análisis bivariado basado en la disminución de funciones cognitivas luego de cuatro años de seguimiento (n=330).

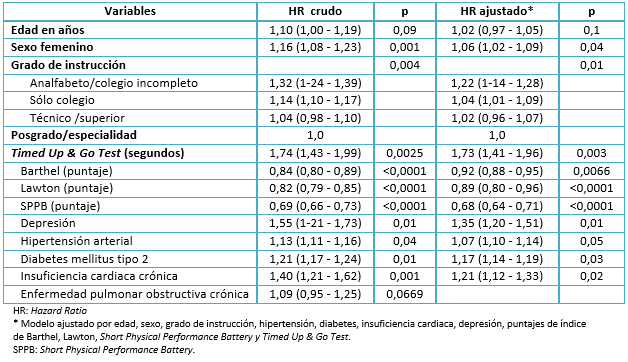 Tabla 2. Regresión de Cox para predicción de disminución patológica del puntaje Mini Mental State Examination (n = 330).
Tabla 2. Regresión de Cox para predicción de disminución patológica del puntaje Mini Mental State Examination (n = 330).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCCIÓN
Se estima que los trastornos neurocognitivos mayores afectarán a 115,4 millones de personas en 2050, lo que representa una carga financiera importante para la sociedad. Asimismo, la dependencia funcional para actividades básicas o instrumentales de la vida diaria suele ser consecuencia de la mayor prevalencia de patologías discapacitantes, y de la progresiva disminución de la reserva fisiológica propia del envejecimiento.
OBJETIVOS
Se persiguen dos objetivos: determinar la relación entre los test funcionales y la predicción de deterioro de funciones cognitivas en pacientes geriátricos; y establecer qué factores están asociados a disminución de las funciones cognitivas en pacientes geriátricos.
MÉTODOS
Estudio de tipo cohorte retrospectiva. Incluimos participantes que acudieron a los servicios ambulatorios de geriatría del Centro Médico Naval de Perú desde 2010 hasta 2014. Se formaron dos grupos, el primero con los que presentaron pérdida fisiológica de funciones cognitivas, definida como la disminución menor a 4,1 puntos en el puntaje del Mini Mental State Examination durante el seguimiento y otro con una pérdida patológica de funciones cognitivas, definida como la disminución de 4,2 puntos en promedio o más en el puntaje de esta misma encuesta durante el seguimiento. Los pacientes fueron seguidos por cuatro años, período en el que se les efectuaron evaluaciones funcionales y se recogieron datos de comorbilidades y factores sociodemográficos.
RESULTADOS
Se incluyeron 368 pacientes, cuya media de edad fue de 75,8 años y 50,91% fueron hombres. El género femenino (53,72%), la presencia de un bajo grado de instrucción (62,81%) y la presencia de comorbilidades fueron más prevalentes en el grupo con disminución de Mini Mental State Examination patológico. Las variables de evaluación funcional, incluyendo al Timed Up & Go Test, presentaron promedios inadecuados durante el seguimiento de cuatro años en el grupo con evolución patológica del puntaje del Mini Mental State Examination, en comparación con el grupo sano.
CONCLUSIONES
Los valores del puntaje del Timed Up & Go Test logran predecir el riesgo de una disminución patológica del Mini Mental State Examination, independientemente de factores sociodemográficos, comorbilidades y valoración funcional.
 Authors:
Gustavo Alberto Sandival Ampuero[1], Fernando M. Runzer-Colmenares[2,3], José F. Parodi[2]
Authors:
Gustavo Alberto Sandival Ampuero[1], Fernando M. Runzer-Colmenares[2,3], José F. Parodi[2]
Affiliation:
[1] Facultad de Medicina Humana, Universidad Nacional Federico Villarreal, Lima, Perú
[2] Centro de Investigación del Envejecimiento (CIEN), Facultad de Medicina Humana, Universidad de San Martin de Porres, Lima, Perú
[3] Unidad de geriatría, Centro Médico Naval, Callao, Perú
E-mail: gsandival19@gmail.com
Author address:
[1] Avenida Garcia Villon Manzana c6
Lote 7, Cercado de Lima
Lima
Perú

Citation: Sandival Ampuero GA, Runzer-Colmenares FM, Parodi JF. Functional assessment as a predictor of cognitive impairment: a retrospective cohort study. Medwave 2017 Nov-Dic;17(9):e7099 doi: 10.5867/medwave.2017.09.7099
Submission date: 3/6/2017
Acceptance date: 9/11/2017
Publication date: 12/12/2017
Origin: not requested
Type of review: reviewed by five external peer reviewers, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Haan MN, Mungas DM, Gonzalez HM, Ortiz TA, Acharya A, Jagust WJ. Prevalence of dementia in older latinos: the influence of type 2 diabetes mellitus, stroke and genetic factors. J Am Geriatr Soc. 2003 Feb;51(2):169-77. | PubMed |
- Duthey B, Background Paper 6,11 Alzheimer Disease and other Dementias. Update on 2004. Who. 2013;(February):1-77. | Link |
- Hurd MD, Martorell P, Delavande A, Mullen KJ, Langa KM. Monetary costs of dementia in the United States. N Engl J Med. 2013 Apr 4;368(14):1326-34. | CrossRef | PubMed |
- Folstein MF, Folstein SE, McHugh PR. "Mini-mental state". A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 1975 Nov;12(3):189-98. | PubMed |
- Biundo R, Weis L, Bostantjopoulou S, Stefanova E, Falup-Pecurariu C, Kramberger MG, et al. MMSE and MoCA in Parkinson's disease and dementia with Lewy bodies: a multicenter 1-year follow-up study. J Neural Transm (Vienna). 2016 Apr;123(4):431-8. | CrossRef | PubMed |
- Reig-Ferrer A, Cabrero-García J, Lizán Tudela L. [Assessment of functional capacity, psychological well-being and mental health in primary care]. Aten Primaria. 2009 Sep;41(9):515-9. | CrossRef | PubMed |
- Jefferson AL, Byerly LK, Vanderhill S, Lambe S, Wong S, Ozonoff A, et al. Characterization of activities of daily living in individuals with mild cognitive impairment. Am J Geriatr Psychiatry. 2008 May;16(5):375-83. | CrossRef | PubMed |
- McGough EL, Logsdon RG, Kelly VE, Teri L. Functional mobility limitations and falls in assisted living residents with dementia: physical performance assessment and quantitative gait analysis. J Geriatr Phys Ther. 2013 Apr-Jun;36(2):78-86. | CrossRef | PubMed |
- Inzitari M, Calle A, Esteve A, Casas Á, Torrents N, Martínez N. [Do you measure gait speed in your daily clinical practice? A review]. Rev Esp Geriatr Gerontol. 2017 Jan - Feb;52(1):35-43. | CrossRef | PubMed |
- Pavasini R, Guralnik J, Brown JC, di Bari M, Cesari M, Landi F, et al. Short Physical Performance Battery and all-cause mortality: systematic review and meta-analysis. BMC Med. 2016 Dec 22;14(1):215. | CrossRef | PubMed |
- Schoene D, Wu SM, Mikolaizak AS, Menant JC, Smith ST, Delbaere K, Lord SR. Discriminative ability and predictive validity of the timed up and go test in identifying older people who fall: systematic review and meta-analysis. J Am Geriatr Soc. 2013 Feb;61(2):202-8. | CrossRef | PubMed |
- Guralnik JM, Simonsick EM, Ferrucci L, Glynn RJ, Berkman LF, Blazer DG, et al. A short physical performance battery assessing lower extremity function: association with self-reported disability and prediction of mortality and nursing home admission. J Gerontol. 1994 Mar;49(2):M85-94. | PubMed |
- Quan M, Xun P, Chen C, Wen J, Wang Y, Wang R, et al. Walking Pace and the Risk of Cognitive Decline and Dementia in Elderly Populations: A Meta-analysis of Prospective Cohort Studies. J Gerontol A Biol Sci Med Sci. 2017 Feb;72(2):266-270. | CrossRef | PubMed |
- Beauchet O, Annweiler C, Callisaya ML, De Cock AM, Helbostad JL, Kressig RW, et al. Poor Gait Performance and Prediction of Dementia: Results From a Meta-Analysis. J Am Med Dir Assoc. 2016 Jun 1;17(6):482-90. | CrossRef | PubMed |
- Jacqmin-Gadda H, Fabrigoule C, Commenges D, Dartigues JF. A 5-year longitudinal study of the Mini-Mental State Examination in normal aging. Am J Epidemiol. 1997 Mar 15;145(6):498-506. | PubMed |
- Burns A, Jacoby R, Levy R. Progression of cognitive impairment in Alzheimer's disease. J Am Geriatr Soc. 1991 Jan;39(1):39-45. | PubMed |
- Runzer-Colmenares FM, Samper-Ternent R, Al Snih S, Ottenbacher KJ, Parodi JF, Wong R. Prevalence and factors associated with frailty among Peruvian older adults. Arch Gerontol Geriatr. 2014 Jan-Feb;58(1):69-73. | CrossRef | PubMed |
- Thomas VS, Hageman PA. Can neuromuscular strength and function in people with dementia be rehabilitated using resistance-exercise training? Results from a preliminary intervention study. J Gerontol A Biol Sci Med Sci. 2003 Aug;58(8):746-51. | PubMed |
- Custodio N, Montesinos R, Escobar J. Prevalencia de demencia en una población urbana de Lima-Perú : estudio puerta a puerta Dementia prevalence in a Lima . Peru urban community : door-to-door study. 2008;69(4):233–8. | Link |
- Lin MR, Hwang HF, Hu MH, Wu HD, Wang YW, Huang FC. Psychometric comparisons of the timed up and go, one-leg stand, functional reach, and Tinetti balance measures in community-dwelling older people. J Am Geriatr Soc. 2004 Aug;52(8):1343-8. | PubMed |
- Bean JF, Leveille SG, Kiely DK, Bandinelli S, Guralnik JM, Ferrucci L. A comparison of leg power and leg strength within the InCHIANTI study: which influences mobility more? J Gerontol A Biol Sci Med Sci. 2003 Aug;58(8):728-33. | PubMed |
- Millán-Calenti JC, Tubío J, Pita-Fernández S, González-Abraldes I, Lorenzo T, Fernández-Arruty T, et al. Prevalence of functional disability in activities of daily living (ADL), instrumental activities of daily living (IADL) and associated factors, as predictors of morbidity and mortality. Arch Gerontol Geriatr. 2010 May-Jun;50(3):306-10. | CrossRef | PubMed |
- Lund R, Nilsson CJ, Avlund K. Can the higher risk of disability onset among older people who live alone be alleviated by strong social relations? A longitudinal study of non-disabled men and women. Age Ageing. 2010 May;39(3):319-26. | CrossRef | PubMed |
- Mirelman A, Weiss A, Buchman AS, Bennett DA, Giladi N, Hausdorff JM. Association between performance on Timed Up and Go subtasks and mild cognitive impairment: further insights into the links between cognitive and motor function. J Am Geriatr Soc. 2014 Apr;62(4):673-8. | CrossRef | PubMed |
- Mariani E, Monastero R, Mecocci P. Mild cognitive impairment: a systematic review. J Alzheimers Dis. 2007 Aug;12(1):23-35. | PubMed |
- Jean L, Bergeron ME, Thivierge S, Simard M. Cognitive intervention programs for individuals with mild cognitive impairment: systematic review of the literature. Am J Geriatr Psychiatry. 2010 Apr;18(4):281-96. | CrossRef | PubMed |
- Narrow WE, Clarke DE, Kuramoto SJ, Kraemer HC, Kupfer DJ, Greiner L, et al. DSM-5 field trials in the United States and Canada, Part III: development and reliability testing of a cross-cutting symptom assessment for DSM-5. Am J Psychiatry. 2013 Jan;170(1):71-82. | CrossRef | PubMed |
- Cobo CMS, Pérez V, Hermosilla C, Nuñez MJ, Lorena P De. Prevalence of Sarcopenia in Elderly With Dementia Institutionalized : a Multicenter Study. J Aging Res Clin Pract. 2015;2040(12):24-7. | Link |
- Qiu C, Winblad B, Marengoni A, Klarin I, Fastbom J, Fratiglioni L. Heart failure and risk of dementia and Alzheimer disease: a population-based cohort study. Arch Intern Med. 2006 May 8;166(9):1003-8. | PubMed |
- Formiga F, Fort I, Robles MJ, Riu S, Sabartes O, Barranco E, et al. Comorbidity and clinical features in elderly patients with dementia: differences according to dementia severity. J Nutr Health Aging. 2009 May;13(5):423-7. | PubMed |
- Sharp SI, Aarsland D, Day S, Sønnesyn H; Alzheimer's Society Vascular Dementia Systematic Review Group, Ballard C. Hypertension is a potential risk factor for vascular dementia: systematic review. Int J Geriatr Psychiatry. 2011 Jul;26(7):661-9. | CrossRef | PubMed |
- Cheng G, Huang C, Deng H, Wang H. Diabetes as a risk factor for dementia and mild cognitive impairment: a meta-analysis of longitudinal studies. Intern Med J. 2012 May;42(5):484-91. | CrossRef | PubMed |
- Buntinx F, Kester A, Bergers J, Knottnerus JA. Is depression in elderly people followed by dementia? A retrospective cohort study based in general practice. Age Ageing. 1996 May;25(3):231-3. | PubMed |
- Singh B, Parsaik AK, Mielke MM, Roberts RO, Scanlon PD, Geda YE, et al. Chronic obstructive pulmonary disease and association with mild cognitive impairment: the Mayo Clinic Study of Aging. Mayo Clin Proc. 2013 Nov;88(11):1222-30. | CrossRef | PubMed |
- Schoenhofen E, Gatz M. Relationship between education and dementia: an updated systematic review. Alzheimer Dis Assoc Disord. 2011 Oct-Dec;25(4):289-304. | CrossRef | PubMed |
- Mueller SG, Schuff N, Yaffe K, Madison C, Miller B, Weiner MW. Hippocampal atrophy patterns in mild cognitive impairment and Alzheimer's disease. Hum Brain Mapp. 2010 Sep;31(9):1339-47. | CrossRef | PubMed |
- Rosenheck RA, Dausey DJ, Frisman L, Kasprow W. Outcomes after initial receipt of social security benefits among homeless veterans with mental illness. Psychiatr Serv. 2000 Dec;51(12):1549-54. | PubMed |
 Haan MN, Mungas DM, Gonzalez HM, Ortiz TA, Acharya A, Jagust WJ. Prevalence of dementia in older latinos: the influence of type 2 diabetes mellitus, stroke and genetic factors. J Am Geriatr Soc. 2003 Feb;51(2):169-77. | PubMed |
Haan MN, Mungas DM, Gonzalez HM, Ortiz TA, Acharya A, Jagust WJ. Prevalence of dementia in older latinos: the influence of type 2 diabetes mellitus, stroke and genetic factors. J Am Geriatr Soc. 2003 Feb;51(2):169-77. | PubMed | Duthey B, Background Paper 6,11 Alzheimer Disease and other Dementias. Update on 2004. Who. 2013;(February):1-77. | Link |
Duthey B, Background Paper 6,11 Alzheimer Disease and other Dementias. Update on 2004. Who. 2013;(February):1-77. | Link | Hurd MD, Martorell P, Delavande A, Mullen KJ, Langa KM. Monetary costs of dementia in the United States. N Engl J Med. 2013 Apr 4;368(14):1326-34. | CrossRef | PubMed |
Hurd MD, Martorell P, Delavande A, Mullen KJ, Langa KM. Monetary costs of dementia in the United States. N Engl J Med. 2013 Apr 4;368(14):1326-34. | CrossRef | PubMed | Folstein MF, Folstein SE, McHugh PR. "Mini-mental state". A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 1975 Nov;12(3):189-98. | PubMed |
Folstein MF, Folstein SE, McHugh PR. "Mini-mental state". A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res. 1975 Nov;12(3):189-98. | PubMed | Biundo R, Weis L, Bostantjopoulou S, Stefanova E, Falup-Pecurariu C, Kramberger MG, et al. MMSE and MoCA in Parkinson's disease and dementia with Lewy bodies: a multicenter 1-year follow-up study. J Neural Transm (Vienna). 2016 Apr;123(4):431-8. | CrossRef | PubMed |
Biundo R, Weis L, Bostantjopoulou S, Stefanova E, Falup-Pecurariu C, Kramberger MG, et al. MMSE and MoCA in Parkinson's disease and dementia with Lewy bodies: a multicenter 1-year follow-up study. J Neural Transm (Vienna). 2016 Apr;123(4):431-8. | CrossRef | PubMed | Reig-Ferrer A, Cabrero-García J, Lizán Tudela L. [Assessment of functional capacity, psychological well-being and mental health in primary care]. Aten Primaria. 2009 Sep;41(9):515-9. | CrossRef | PubMed |
Reig-Ferrer A, Cabrero-García J, Lizán Tudela L. [Assessment of functional capacity, psychological well-being and mental health in primary care]. Aten Primaria. 2009 Sep;41(9):515-9. | CrossRef | PubMed | Jefferson AL, Byerly LK, Vanderhill S, Lambe S, Wong S, Ozonoff A, et al. Characterization of activities of daily living in individuals with mild cognitive impairment. Am J Geriatr Psychiatry. 2008 May;16(5):375-83. | CrossRef | PubMed |
Jefferson AL, Byerly LK, Vanderhill S, Lambe S, Wong S, Ozonoff A, et al. Characterization of activities of daily living in individuals with mild cognitive impairment. Am J Geriatr Psychiatry. 2008 May;16(5):375-83. | CrossRef | PubMed | McGough EL, Logsdon RG, Kelly VE, Teri L. Functional mobility limitations and falls in assisted living residents with dementia: physical performance assessment and quantitative gait analysis. J Geriatr Phys Ther. 2013 Apr-Jun;36(2):78-86. | CrossRef | PubMed |
McGough EL, Logsdon RG, Kelly VE, Teri L. Functional mobility limitations and falls in assisted living residents with dementia: physical performance assessment and quantitative gait analysis. J Geriatr Phys Ther. 2013 Apr-Jun;36(2):78-86. | CrossRef | PubMed | Inzitari M, Calle A, Esteve A, Casas Á, Torrents N, Martínez N. [Do you measure gait speed in your daily clinical practice? A review]. Rev Esp Geriatr Gerontol. 2017 Jan - Feb;52(1):35-43. | CrossRef | PubMed |
Inzitari M, Calle A, Esteve A, Casas Á, Torrents N, Martínez N. [Do you measure gait speed in your daily clinical practice? A review]. Rev Esp Geriatr Gerontol. 2017 Jan - Feb;52(1):35-43. | CrossRef | PubMed | Pavasini R, Guralnik J, Brown JC, di Bari M, Cesari M, Landi F, et al. Short Physical Performance Battery and all-cause mortality: systematic review and meta-analysis. BMC Med. 2016 Dec 22;14(1):215. | CrossRef | PubMed |
Pavasini R, Guralnik J, Brown JC, di Bari M, Cesari M, Landi F, et al. Short Physical Performance Battery and all-cause mortality: systematic review and meta-analysis. BMC Med. 2016 Dec 22;14(1):215. | CrossRef | PubMed | Schoene D, Wu SM, Mikolaizak AS, Menant JC, Smith ST, Delbaere K, Lord SR. Discriminative ability and predictive validity of the timed up and go test in identifying older people who fall: systematic review and meta-analysis. J Am Geriatr Soc. 2013 Feb;61(2):202-8. | CrossRef | PubMed |
Schoene D, Wu SM, Mikolaizak AS, Menant JC, Smith ST, Delbaere K, Lord SR. Discriminative ability and predictive validity of the timed up and go test in identifying older people who fall: systematic review and meta-analysis. J Am Geriatr Soc. 2013 Feb;61(2):202-8. | CrossRef | PubMed | Guralnik JM, Simonsick EM, Ferrucci L, Glynn RJ, Berkman LF, Blazer DG, et al. A short physical performance battery assessing lower extremity function: association with self-reported disability and prediction of mortality and nursing home admission. J Gerontol. 1994 Mar;49(2):M85-94. | PubMed |
Guralnik JM, Simonsick EM, Ferrucci L, Glynn RJ, Berkman LF, Blazer DG, et al. A short physical performance battery assessing lower extremity function: association with self-reported disability and prediction of mortality and nursing home admission. J Gerontol. 1994 Mar;49(2):M85-94. | PubMed | Quan M, Xun P, Chen C, Wen J, Wang Y, Wang R, et al. Walking Pace and the Risk of Cognitive Decline and Dementia in Elderly Populations: A Meta-analysis of Prospective Cohort Studies. J Gerontol A Biol Sci Med Sci. 2017 Feb;72(2):266-270. | CrossRef | PubMed |
Quan M, Xun P, Chen C, Wen J, Wang Y, Wang R, et al. Walking Pace and the Risk of Cognitive Decline and Dementia in Elderly Populations: A Meta-analysis of Prospective Cohort Studies. J Gerontol A Biol Sci Med Sci. 2017 Feb;72(2):266-270. | CrossRef | PubMed | Beauchet O, Annweiler C, Callisaya ML, De Cock AM, Helbostad JL, Kressig RW, et al. Poor Gait Performance and Prediction of Dementia: Results From a Meta-Analysis. J Am Med Dir Assoc. 2016 Jun 1;17(6):482-90. | CrossRef | PubMed |
Beauchet O, Annweiler C, Callisaya ML, De Cock AM, Helbostad JL, Kressig RW, et al. Poor Gait Performance and Prediction of Dementia: Results From a Meta-Analysis. J Am Med Dir Assoc. 2016 Jun 1;17(6):482-90. | CrossRef | PubMed | Jacqmin-Gadda H, Fabrigoule C, Commenges D, Dartigues JF. A 5-year longitudinal study of the Mini-Mental State Examination in normal aging. Am J Epidemiol. 1997 Mar 15;145(6):498-506. | PubMed |
Jacqmin-Gadda H, Fabrigoule C, Commenges D, Dartigues JF. A 5-year longitudinal study of the Mini-Mental State Examination in normal aging. Am J Epidemiol. 1997 Mar 15;145(6):498-506. | PubMed | Burns A, Jacoby R, Levy R. Progression of cognitive impairment in Alzheimer's disease. J Am Geriatr Soc. 1991 Jan;39(1):39-45. | PubMed |
Burns A, Jacoby R, Levy R. Progression of cognitive impairment in Alzheimer's disease. J Am Geriatr Soc. 1991 Jan;39(1):39-45. | PubMed | Runzer-Colmenares FM, Samper-Ternent R, Al Snih S, Ottenbacher KJ, Parodi JF, Wong R. Prevalence and factors associated with frailty among Peruvian older adults. Arch Gerontol Geriatr. 2014 Jan-Feb;58(1):69-73. | CrossRef | PubMed |
Runzer-Colmenares FM, Samper-Ternent R, Al Snih S, Ottenbacher KJ, Parodi JF, Wong R. Prevalence and factors associated with frailty among Peruvian older adults. Arch Gerontol Geriatr. 2014 Jan-Feb;58(1):69-73. | CrossRef | PubMed | Thomas VS, Hageman PA. Can neuromuscular strength and function in people with dementia be rehabilitated using resistance-exercise training? Results from a preliminary intervention study. J Gerontol A Biol Sci Med Sci. 2003 Aug;58(8):746-51. | PubMed |
Thomas VS, Hageman PA. Can neuromuscular strength and function in people with dementia be rehabilitated using resistance-exercise training? Results from a preliminary intervention study. J Gerontol A Biol Sci Med Sci. 2003 Aug;58(8):746-51. | PubMed | Custodio N, Montesinos R, Escobar J. Prevalencia de demencia en una población urbana de Lima-Perú : estudio puerta a puerta Dementia prevalence in a Lima . Peru urban community : door-to-door study. 2008;69(4):233–8. | Link |
Custodio N, Montesinos R, Escobar J. Prevalencia de demencia en una población urbana de Lima-Perú : estudio puerta a puerta Dementia prevalence in a Lima . Peru urban community : door-to-door study. 2008;69(4):233–8. | Link | Lin MR, Hwang HF, Hu MH, Wu HD, Wang YW, Huang FC. Psychometric comparisons of the timed up and go, one-leg stand, functional reach, and Tinetti balance measures in community-dwelling older people. J Am Geriatr Soc. 2004 Aug;52(8):1343-8. | PubMed |
Lin MR, Hwang HF, Hu MH, Wu HD, Wang YW, Huang FC. Psychometric comparisons of the timed up and go, one-leg stand, functional reach, and Tinetti balance measures in community-dwelling older people. J Am Geriatr Soc. 2004 Aug;52(8):1343-8. | PubMed | Bean JF, Leveille SG, Kiely DK, Bandinelli S, Guralnik JM, Ferrucci L. A comparison of leg power and leg strength within the InCHIANTI study: which influences mobility more? J Gerontol A Biol Sci Med Sci. 2003 Aug;58(8):728-33. | PubMed |
Bean JF, Leveille SG, Kiely DK, Bandinelli S, Guralnik JM, Ferrucci L. A comparison of leg power and leg strength within the InCHIANTI study: which influences mobility more? J Gerontol A Biol Sci Med Sci. 2003 Aug;58(8):728-33. | PubMed | Millán-Calenti JC, Tubío J, Pita-Fernández S, González-Abraldes I, Lorenzo T, Fernández-Arruty T, et al. Prevalence of functional disability in activities of daily living (ADL), instrumental activities of daily living (IADL) and associated factors, as predictors of morbidity and mortality. Arch Gerontol Geriatr. 2010 May-Jun;50(3):306-10. | CrossRef | PubMed |
Millán-Calenti JC, Tubío J, Pita-Fernández S, González-Abraldes I, Lorenzo T, Fernández-Arruty T, et al. Prevalence of functional disability in activities of daily living (ADL), instrumental activities of daily living (IADL) and associated factors, as predictors of morbidity and mortality. Arch Gerontol Geriatr. 2010 May-Jun;50(3):306-10. | CrossRef | PubMed | Lund R, Nilsson CJ, Avlund K. Can the higher risk of disability onset among older people who live alone be alleviated by strong social relations? A longitudinal study of non-disabled men and women. Age Ageing. 2010 May;39(3):319-26. | CrossRef | PubMed |
Lund R, Nilsson CJ, Avlund K. Can the higher risk of disability onset among older people who live alone be alleviated by strong social relations? A longitudinal study of non-disabled men and women. Age Ageing. 2010 May;39(3):319-26. | CrossRef | PubMed | Mirelman A, Weiss A, Buchman AS, Bennett DA, Giladi N, Hausdorff JM. Association between performance on Timed Up and Go subtasks and mild cognitive impairment: further insights into the links between cognitive and motor function. J Am Geriatr Soc. 2014 Apr;62(4):673-8. | CrossRef | PubMed |
Mirelman A, Weiss A, Buchman AS, Bennett DA, Giladi N, Hausdorff JM. Association between performance on Timed Up and Go subtasks and mild cognitive impairment: further insights into the links between cognitive and motor function. J Am Geriatr Soc. 2014 Apr;62(4):673-8. | CrossRef | PubMed | Mariani E, Monastero R, Mecocci P. Mild cognitive impairment: a systematic review. J Alzheimers Dis. 2007 Aug;12(1):23-35. | PubMed |
Mariani E, Monastero R, Mecocci P. Mild cognitive impairment: a systematic review. J Alzheimers Dis. 2007 Aug;12(1):23-35. | PubMed | Jean L, Bergeron ME, Thivierge S, Simard M. Cognitive intervention programs for individuals with mild cognitive impairment: systematic review of the literature. Am J Geriatr Psychiatry. 2010 Apr;18(4):281-96. | CrossRef | PubMed |
Jean L, Bergeron ME, Thivierge S, Simard M. Cognitive intervention programs for individuals with mild cognitive impairment: systematic review of the literature. Am J Geriatr Psychiatry. 2010 Apr;18(4):281-96. | CrossRef | PubMed | Narrow WE, Clarke DE, Kuramoto SJ, Kraemer HC, Kupfer DJ, Greiner L, et al. DSM-5 field trials in the United States and Canada, Part III: development and reliability testing of a cross-cutting symptom assessment for DSM-5. Am J Psychiatry. 2013 Jan;170(1):71-82. | CrossRef | PubMed |
Narrow WE, Clarke DE, Kuramoto SJ, Kraemer HC, Kupfer DJ, Greiner L, et al. DSM-5 field trials in the United States and Canada, Part III: development and reliability testing of a cross-cutting symptom assessment for DSM-5. Am J Psychiatry. 2013 Jan;170(1):71-82. | CrossRef | PubMed | Cobo CMS, Pérez V, Hermosilla C, Nuñez MJ, Lorena P De. Prevalence of Sarcopenia in Elderly With Dementia Institutionalized : a Multicenter Study. J Aging Res Clin Pract. 2015;2040(12):24-7. | Link |
Cobo CMS, Pérez V, Hermosilla C, Nuñez MJ, Lorena P De. Prevalence of Sarcopenia in Elderly With Dementia Institutionalized : a Multicenter Study. J Aging Res Clin Pract. 2015;2040(12):24-7. | Link | Qiu C, Winblad B, Marengoni A, Klarin I, Fastbom J, Fratiglioni L. Heart failure and risk of dementia and Alzheimer disease: a population-based cohort study. Arch Intern Med. 2006 May 8;166(9):1003-8. | PubMed |
Qiu C, Winblad B, Marengoni A, Klarin I, Fastbom J, Fratiglioni L. Heart failure and risk of dementia and Alzheimer disease: a population-based cohort study. Arch Intern Med. 2006 May 8;166(9):1003-8. | PubMed | Formiga F, Fort I, Robles MJ, Riu S, Sabartes O, Barranco E, et al. Comorbidity and clinical features in elderly patients with dementia: differences according to dementia severity. J Nutr Health Aging. 2009 May;13(5):423-7. | PubMed |
Formiga F, Fort I, Robles MJ, Riu S, Sabartes O, Barranco E, et al. Comorbidity and clinical features in elderly patients with dementia: differences according to dementia severity. J Nutr Health Aging. 2009 May;13(5):423-7. | PubMed | Sharp SI, Aarsland D, Day S, Sønnesyn H; Alzheimer's Society Vascular Dementia Systematic Review Group, Ballard C. Hypertension is a potential risk factor for vascular dementia: systematic review. Int J Geriatr Psychiatry. 2011 Jul;26(7):661-9. | CrossRef | PubMed |
Sharp SI, Aarsland D, Day S, Sønnesyn H; Alzheimer's Society Vascular Dementia Systematic Review Group, Ballard C. Hypertension is a potential risk factor for vascular dementia: systematic review. Int J Geriatr Psychiatry. 2011 Jul;26(7):661-9. | CrossRef | PubMed | Cheng G, Huang C, Deng H, Wang H. Diabetes as a risk factor for dementia and mild cognitive impairment: a meta-analysis of longitudinal studies. Intern Med J. 2012 May;42(5):484-91. | CrossRef | PubMed |
Cheng G, Huang C, Deng H, Wang H. Diabetes as a risk factor for dementia and mild cognitive impairment: a meta-analysis of longitudinal studies. Intern Med J. 2012 May;42(5):484-91. | CrossRef | PubMed | Buntinx F, Kester A, Bergers J, Knottnerus JA. Is depression in elderly people followed by dementia? A retrospective cohort study based in general practice. Age Ageing. 1996 May;25(3):231-3. | PubMed |
Buntinx F, Kester A, Bergers J, Knottnerus JA. Is depression in elderly people followed by dementia? A retrospective cohort study based in general practice. Age Ageing. 1996 May;25(3):231-3. | PubMed | Singh B, Parsaik AK, Mielke MM, Roberts RO, Scanlon PD, Geda YE, et al. Chronic obstructive pulmonary disease and association with mild cognitive impairment: the Mayo Clinic Study of Aging. Mayo Clin Proc. 2013 Nov;88(11):1222-30. | CrossRef | PubMed |
Singh B, Parsaik AK, Mielke MM, Roberts RO, Scanlon PD, Geda YE, et al. Chronic obstructive pulmonary disease and association with mild cognitive impairment: the Mayo Clinic Study of Aging. Mayo Clin Proc. 2013 Nov;88(11):1222-30. | CrossRef | PubMed | Schoenhofen E, Gatz M. Relationship between education and dementia: an updated systematic review. Alzheimer Dis Assoc Disord. 2011 Oct-Dec;25(4):289-304. | CrossRef | PubMed |
Schoenhofen E, Gatz M. Relationship between education and dementia: an updated systematic review. Alzheimer Dis Assoc Disord. 2011 Oct-Dec;25(4):289-304. | CrossRef | PubMed | Mueller SG, Schuff N, Yaffe K, Madison C, Miller B, Weiner MW. Hippocampal atrophy patterns in mild cognitive impairment and Alzheimer's disease. Hum Brain Mapp. 2010 Sep;31(9):1339-47. | CrossRef | PubMed |
Mueller SG, Schuff N, Yaffe K, Madison C, Miller B, Weiner MW. Hippocampal atrophy patterns in mild cognitive impairment and Alzheimer's disease. Hum Brain Mapp. 2010 Sep;31(9):1339-47. | CrossRef | PubMed | Rosenheck RA, Dausey DJ, Frisman L, Kasprow W. Outcomes after initial receipt of social security benefits among homeless veterans with mental illness. Psychiatr Serv. 2000 Dec;51(12):1549-54. | PubMed |
Rosenheck RA, Dausey DJ, Frisman L, Kasprow W. Outcomes after initial receipt of social security benefits among homeless veterans with mental illness. Psychiatr Serv. 2000 Dec;51(12):1549-54. | PubMed |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis








