Key Words: cost-effectiveness analysis, duloxetine, pregabalin, painful diabetic neuropathy, Venezuela.
Resumen
INTRODUCCIÓN
La neuropatía diabética periférica dolorosa (NDPD) afecta a 40-50% de los pacientes con neuropatía diabética y se asocia con un deterioro significativo de la calidad de vida y con costos de magnitud considerable. Tanto duloxetina (DUL) como pregabalina (PGB) cuentan con sustento científico basado en evidencias y han sido formalmente aprobados para controlar la NDPD.
MÉTODOS
Se utilizó un modelo de decisión a 12 semanas para examinar el tratamiento de primera línea para la neuropatía diabética periférica dolorosa, con dosis diarias de duloxetina 60 mg o con pregabalina 300 mg, bajo la perspectiva del Instituto Venezolano de los Seguros Sociales. Los parámetros del modelo proceden de literatura publicada y opinión de expertos, enfocándose en la magnitud del alivio del dolor, la presencia de eventos adversos, la posibilidad de abandono debido a eventos adversos intolerables o por falta de eficacia y en los años de vida ajustados por calidad esperados con cada estrategia. Se analizaron los costos médicos directos (expresados en bolívares fuertes), integrados por la adquisición de medicamentos, además del cuidado adicional que se origina por el tratamiento de los eventos adversos y como consecuencia de un pobre alivio del dolor. Se llevaron a cabo análisis de sensibilidad de tipo determinístico y probabilístico.
RESULTADOS
Los costos totales esperados por cada 1000 pacientes fueron de 1 046 146 bolívares fuertes (26%) más bajos con duloxetina en comparación con la pregabalina. La mayor parte de estos ahorros (91%), corresponde a la diferencia en el costo de adquisición entre ambos medicamentos. La duloxetina también se asoció con ganancias de 23 pacientes que lograron un buen alivio del dolor y de dos años de vida ajustados por calidad por cada 1000 tratados. El modelo se mantuvo robusto ante cambios plausibles en sus parámetros principales. La duloxetina continuó siendo la opción preferida en 93,9% de las simulaciones de Monte Carlo de segundo orden generadas.
CONCLUSIONES
El presente estudio sugiere que la duloxetina domina a (es más efectiva, conduce a ganancias en años de vida ajustados por calidad y es menos costosa que) la pregabalina, para el tratamiento de la neuropatía diabética periférica dolorosa.
Introducción
La neuropatía diabética periférica dolorosa es una condición neuropática dolorosa crónica que afecta a pacientes con diabetes mellitus. Sus síntomas principales incluyen sensación de dolor, ardor, punzada u hormigueo, los que suelen comenzar en los pies y comúnmente empeoran durante la noche [1],[2]. La prevalencia reportada de dolor crónico con características neuropáticas varía de 10 a 20% en el conjunto de la población diabética y oscila entre el 40 y 50% en aquellos con neuropatía diabética [3].
La neuropatía diabética periférica dolorosa es un problema de salud pública relevante, pues se asocia con trastornos del sueño, ansiedad, depresión e interferencia con las actividades cotidianas. Todo lo anterior se refleja en un bajo funcionamiento, tanto físico como mental, contribuyendo al deterioro de la calidad de vida [3],[4],[5].
Además, la neuropatía diabética periférica dolorosa impone una carga económica considerable en términos de costos médicos directos y de costos indirectos relacionados con pérdidas de productividad laboral debido al ausentismo y/o a mermas en el desempeño (presentismo) [6],[7],[8].
El manejo farmacológico de la neuropatía diabética periférica dolorosa incluye tratamiento con antidepresivos tricíclicos, otros tipos de antidepresivos, anticonvulsivos y agentes que actúan de forma semejante a los opiáceos [9]. Sin embargo, sólo la duloxetina (un inhibidor de la recaptura de serotonina y norepinefrina) y la pregabalina (un anticonvulsivo), cuentan con soporte basado en evidencias para el control de la neuropatía diabética periférica dolorosa [10]. Además, están formalmente aprobados para el manejo de esta condición, tanto en Europa [11] como en Estados Unidos [12]. El Consenso Venezolano sobre Dolor Neuropático, recomienda el uso de cualquiera de estos dos agentes [2].
Para poder realizar una asignación óptima de los recursos disponibles, y así maximizar los beneficios clínicos y económicos de la sociedad, se requiere examinar el perfil farmacoeconómico de los nuevos medicamentos [13]. El objetivo del presente estudio es evaluar los costos y desenlaces en salud, cuando la duloxetina y la pregabalina se administran como primera línea de tratamiento de la neuropatía diabética periférica dolorosa. Este análisis se realiza desde la perspectiva del Instituto Venezolano de los Seguros Sociales.
Métodos
Se realizó un análisis de costo-efectividad, complementado por uno de costo-utilidad. La población objetivo se definió como aquellos adultos con neuropatía diabética periférica dolorosa, en quienes la duloxetina o pregabalina fue prescrita como terapia de primera línea para el manejo del dolor de moderada a severa intensidad.
Se evaluaron las siguientes intervenciones competitivas: duloxetina 60 mg una vez al día y pregabalina 150 mg dos veces al día (300 mg diarios), ambas administradas por vía oral. Estas dosis son generalmente recomendadas para el manejo de neuropatía diabética periférica dolorosa [1],[2],[14],[15] y han sido empleadas en algunos estudios publicados recientemente [16],[17]. Además, dichos esquemas fueron también validados por tres especialistas del Instituto Venezolano de los Seguros Sociales.
Al igual que en otros análisis económicos de tratamientos farmacológicos para neuropatía diabética periférica dolorosa [16],[18], se consideró un horizonte temporal de 12 semanas. Este lapso es consistente con la duración de la fase de cegamiento de los ensayos clínicos aleatorizados y controlados por placebo de duloxetina en neuropatía diabética periférica dolorosa [19],[20],[21]. Asimismo, refleja el periodo de tiempo habitualmente dedicado a evaluar una terapia de primera línea para esta condición [18]. Por lo tanto, no se les aplicó ninguna tasa de descuento a los costos y a los beneficios, ya que todos ellos ocurren dentro del marco temporal del primer año [22].
Modelo de decisión
Se utilizó un árbol de decisión con una estructura similar a la publicada por Carlos et al [16] (Figura 1). El modelo consiste en siete trayectorias diferentes definidas conforme a la magnitud del alivio del dolor, la presencia de eventos adversos y la posibilidad de abandono a causa de eventos adversos intolerables o por falta de eficacia, con o sin eventos adversos tolerables. Tanto un pobre alivio del dolor como los eventos adversos conducen a costos adicionales y a la pérdida de utilidad (disutilidad). Se asumió que todos los estados de salud resultantes de los tratamientos están presentes durante el horizonte temporal completo, y que el alivio del dolor se refiere a la reducción en los síntomas y no a la duración del dolor [16],[18].
Uso de recursos y costos
Se analizaron tres diferentes categorías de costo directo médico:
- Costo de adquisición del medicamento considerado en cada intervención.
- Costos adicionales por atención de eventos adversos tolerables e intolerables.
- Costos adicionales atribuibles a un pobre alivio del dolor.
Ya que el análisis se realizó desde la perspectiva del Instituto Venezolano de los Seguros Sociales, se excluyeron los costos indirectos relacionados con pérdidas de productividad laboral al igual que los costos intangibles.
Figura 1. Estructura del modelo
El costo de los agentes farmacológicos involucrados en cada intervención competitiva se calculó como el producto de tres factores: la duración de la terapia (expresada en días), la tasa de adherencia y el costo diario de cada medicamento.
Se asumió que los pacientes que alcanzaron un buen alivio del dolor completaron las 12 semanas de tratamiento, independientemente de si el individuo en cuestión experimentó o no eventos adversos tolerables. También se asumió que una proporción de pacientes con pobre alivio del dolor podía permanecer en la terapia asignada durante el periodo completo de 12 semanas, debido a una percepción de haber alcanzado cierto grado de alivio del dolor. En contraste, otros pacientes con pobre alivio del dolor pudieron haber abandonado la terapia a la que fueron asignados de manera prematura. Este abandono puede atribuirse a falta de eficacia o a la coexistencia de eventos adversos tolerables y falta de eficacia. Por definición, todos los pacientes que experimentaron eventos adversos intolerables discontinuaron el tratamiento prematuramente. La duración promedio del tratamiento en aquellos pacientes que suspendieron la terapia por eventos adversos intolerables o como consecuencia de falta de eficacia, fue establecida en siete y 14 días respectivamente. Los pacientes con falta de eficacia y eventos adversos tolerables, también permanecieron 14 días en terapia. Estos supuestos fueron validados por tres especialistas del Instituto Venezolano de los Seguros Sociales.
La adherencia al tratamiento depende de la frecuencia diaria con que cada agente deba ser administrado. Se usaron ciertas estimaciones de adherencia para calcular los costos esperados de cada medicamento. Las estimaciones de adherencia fueron derivadas de una revisión sistemática efectuada por Saini et al [24]. De acuerdo con un análisis realizado a dicha fuente, la proporción de número de dosis correctamente tomadas (la proporción del total de aperturas correctas), es más alta para los esquemas con una sola dosis al día (promedio de adherencia de 93%), que en los esquemas que necesitan dos administraciones diarias (promedio de adherencia de 87%) [16]. Los precios promedio de cada medicamento al Instituto Venezolano de los Seguros Sociales, fueron obtenidos mediante comunicación personal con distribuidores mayoristas.
Se llevó a cabo una entrevista a tres expertos del Instituto Venezolano de los Seguros Sociales, con el objetivo de definir el uso de recursos típico que se brinda de forma adicional a los pacientes con neuropatía diabética periférica dolorosa, que experimentan eventos adversos tolerables e intolerables o que fallan en alcanzar un buen alivio del dolor. Por ejemplo, en comparación a los pacientes que alcanzaron un buen alivio del dolor permaneciendo libres de eventos adversos, aquellos pacientes con buen alivio del dolor pero con eventos adversos tolerables tuvieron una consulta médica extra (20% con un médico general y 80% con un especialista). Para estimar el costo unitario de una visita al médico general o al especialista, se dividió el ingreso mensual promedio en cada caso [24] por la frecuencia de consultas ambulatorias que ellos otorgan durante un mes típico.
El costo unitario por visita al departamento de urgencias fue calculado de manera similar. El costo por día de hospitalización se estimó como la suma de la nómina mensual al equipo, más los cargos mensuales atribuibles a la adquisición de bienes y servicios destinados al cuidado intrahospitalario, divididos por el número de camas activas que mantiene el Instituto Venezolano de los Seguros Sociales durante un mes típico. La Tabla 1 muestra el uso de recursos, el costo unitario por recurso y los costos adicionales esperados por tipo de paciente. Todos los costos fueron calculados y se expresan en bolívares fuertes del año 2014 (tasa de cambio al momento de realizar el estudio: 6,30 bolívares fuertes por 1 dólar americano y 7,89 bolívares fuertes por 1 euro) [25]. El costo esperado por recurso está calculado como el producto de tres factores: la probabilidad de uso, la frecuencia en caso de uso y el costo unitario. Al final, todos los costos esperados por recurso en cada tipo de evento se suman para obtener un total general por evento.
Tabla 1. Uso de recursos y costo esperado asociado con eventos adversos y falta de eficacia
Resultados en salud
La medida de efectividad se consideró como el alcanzar un buen alivio del dolor. Carlos et al [16] describen en detalle los métodos que emplearon para definir dicho desenlace. Estos autores calcularon la proporción acumulada de pacientes que alcanzaron buen alivio del dolor en todos los brazos asignados a placebo en 14 ensayos clínicos (incluyendo tres estudios para duloxetina [19],[20],[21] y siete para pregabalina [26],[27],[28],[29],[30],[31],[32]), identificados mediante una revisión sistemática. Esa cifra representa el “riesgo basal”. Después, condujeron una comparación indirecta de tratamientos para estimar el riesgo relativo de alcanzar buen alivio del dolor con cada intervención específica, en comparación con el uso de placebo. En consecuencia, la probabilidad de alcanzar buen alivio del dolor con cada intervención competitiva es el producto del riesgo basal y el riesgo relativo correspondiente. Un abordaje similar fue utilizado por ellos para estimar las probabilidades de experimentar cualquier evento adverso y de abandonar la terapia asignada por eventos adversos intolerables [16]. Todos esos valores fueron empleados en el presente modelo. La probabilidad de abandono como consecuencia de pobre alivio del dolor fue obtenida de O´Connor et al [18].
Los años de vida ajustados por calidad fueron seleccionados como el principal resultado en salud para el análisis de costo-utilidad, empleando los mismos ponderadores de utilidad según nivel de dolor que Carlos et al [16]. Por lo tanto, los pacientes con pobre alivio del dolor (el nivel de dolor basal, que incluye al dolor moderado y severo) tuvieron un puntaje de utilidad de 0,38, mientras que aquellos que sí alcanzaron un buen alivio del dolor (los que mejoraron hasta experimentar un dolor leve) tuvieron un puntaje de utilidad de 0,64. Ambos puntajes de utilidad se localizan en una escala de 0 a 1, donde 0 es equivalente a la muerte y 1 representa un estado de salud perfecto.
El valor de 0,38 es el promedio ponderado de la utilidad media en el puntaje del instrumento EuroQol de 5 Dimensiones (EQ-5D®) reportado en tres estudios [4],[33],[34] para niveles de dolor moderado (0,48) y severo (0,22), considerando una razón de 63%/37% para las probabilidades de experimentar dolor moderado/severo. Ello, según lo indicado en una encuesta de corte transversal en la que participaron 255 pacientes con neuropatía diabética periférica dolorosa en Estados Unidos [4]. El 0,64 es el promedio simple de los puntajes de utilidad para dolor leve, reportados en los estudios previamente señalados [4],[33],[34]. Al igual que en otros artículos [16],[17],[18], se usaron riesgo relativo de 0,95 y de 0,90 para indicar que la presencia de eventos adversos tolerables e intolerables se encuentra asociada a pérdidas relativas en la utilidad de 5 y 10%, respectivamente.
Análisis estadístico
Todo el análisis se llevó a cabo en el software TreeAge (TreeAge Pro Suite 2013, TreeAge Software, Inc., Williamstown, MA). Específicamente, se calcularon los valores de costo y efectividad (utilidad) esperados para una cohorte hipotética de 2000 pacientes, divididos en dos grupos de 1000 cada uno. Dichos pacientes fueron asignados a cada una de las dos estrategias competitivas.
El análisis del caso base se complementó con un análisis de sensibilidad de tipo determinístico y probabilístico. Los resultados del análisis de sensibilidad determinístico se muestran de forma resumida mediante un diagrama de tornado para el beneficio monetario neto (BMN) de duloxetina, calculado como BMN: U * WTP – C; donde U es el número esperado de años de vida ajustados por calidad con duloxetina, WTP es la disponibilidad a pagar (el umbral del tomador de decisiones) por cada año de vida ajustado por calidad adicional, y C es el costo esperado con duloxetina. El valor de la disponibilidad a pagar (WTP) se fijó en 106 615 bolívares fuertes, cifra que representa el valor del producto interno bruto per cápita proyectado para Venezuela en 2014 [35]. Como parte del análisis de sensibilidad probabilístico, se generaron 1000 simulaciones de Monte Carlo de segundo orden, cuyos resultados se despliegan gráficamente en términos de un diagrama de dispersión de costo-utilidad incremental. La Tabla 2 presenta los parámetros del modelo. En ella, los puntajes de utilidad según dolor fueron multiplicados por el factor de ajuste por disutilidad para crear la utilidad del estado de salud combinado (presencia de eventos adversos junto con la magnitud del dolor).
Tabla 2. Valores de los parámetros del modelo: caso-base, rangos y distribuciones
Resultados
La Tabla 3 muestra el resumen de la evaluación económica. La adquisición de duloxetina o pregabalina fue el principal rubro de gasto, representando 44,9% y 56,6% del costo total esperado con cada intervención competitiva. El cuidado adicional otorgado a los pacientes con pobre alivio del dolor fue la segunda categoría en términos de costos, contabilizando 43% en el grupo de duloxetina y 33,6% en el grupo de pregabalina. Los costos totales esperados por cada 1000 pacientes resultaron 1 046 146 bolívares fuertes (26%) más bajos con duloxetina que con pregabalina. La mayoría de estos ahorros (91%) corresponde a la diferencia en el costo de adquisición de cada medicamento, seguido por diferencias en costos adicionales atribuibles a un pobre alivio del dolor y al manejo de eventos adversos, los cuales contabilizaron 6 y 3% de los ahorros netos a favor de duloxetina.
Tabla 3. Resultados del análisis para el caso base (por cada 1000 pacientes con cifras redondeadas)
La duloxetina resultó no sólo menos costosa que pregabalina, sino también más efectiva, proveyendo 23 pacientes adicionales con buen alivio del dolor por cada 1000 tratados. Los ligeramente mejores perfiles de eficacia y seguridad de duloxetina versus pregabalina, significaron una ganancia de alrededor de dos años de vida ajustados por calidad por cada 1000 tratados. Por lo tanto, la duloxetina dominó a la pregabalina.
La Figura 2 despliega el diagrama de tornado para el beneficio monetario neto de duloxetina bajo el análisis de costo-utilidad. Por simplicidad, únicamente se muestran los diez parámetros con mayor influencia en el beneficio monetario neto. La longitud de cada barra indica el efecto de la respectiva variable sobre el beneficio monetario neto calculado. El beneficio monetario neto se expresa en bolívares fuertes y fue calculado para una disponibilidad a pagar de 106 615 bolívares fuertes, cifra que corresponde al producto interno bruto per cápita proyectado para Venezuela en 2014.
Figura 2. Diagrama de tornado para el beneficio monetario neto de duloxetina
El diagrama de dispersión de costo-utilidad incremental se muestra en la Figura 3, en él cada punto representa una simulación de la evaluación económica de duloxetina versus pregabalina. Se calculó que 635 de las 1000 simulaciones se ubicaron en el cuadrante IV, situación que indica que la duloxetina resultó menos costosa y al mismo tiempo se asoció con ganancias en años de vida ajustados por calidad, al ser comparada con la pregabalina. Además, y para una disponibilidad a pagar máxima por cada año de vida ajustado por calidad adicional (definida a igual al valor del producto interno bruto per cápita de Venezuela), la duloxetina resultó la opción preferida en otras 304 simulaciones.
Figura 3. Diagrama de dispersión de costo-utilidad incremental (duloxetina versus pregabalina)
Discusión
La prevalencia actual de la diabetes mellitus en Venezuela es de 6,61% [36]. Se espera que tanto la prevalencia como la carga económica generada por la diabetes mellitus y sus complicaciones aumenten considerablemente durante las próximas décadas imponiendo la necesidad de un uso más racional de los recursos disponibles [35],[36]. En este estudio se evaluaron los costos y beneficios esperados con duloxetina y con pregabalina para el manejo de neuropatía diabética periférica dolorosa desde la perspectiva del Instituto Venezolano de los Seguros Sociales y se encontró que la primera se asocia con costos totales 26% más bajos. Esta disminución relativa es comparable a los ahorros totales proporcionales a favor de la duloxetina reportados con modelos similares en México (22%) [16] y Estados Unidos (20%) [18]. La duloxetina exhibió ahorros netos en todas las categorías que se analizaron: 947 bolívares fuertes (41%) en los costos de adquisición de los agentes, 65 (5%) bolívares fuertes en el cuidado adicional atribuible a un pobre alivio del dolor y 34 bolívares fuertes (8%) en el tratamiento de eventos adversos emergentes por paciente.
Se estimó que por cada 1000 pacientes tratados con duloxetina en lugar de recibir pregabalina, un total de 23 pacientes adicionales alcanzarían un buen alivio del dolor y que además habría una ganancia de dos años de vida ajustados por calidad. Estas pequeñas diferencias son consistentes con la literatura publicada, la cual muestra que los perfiles de eficacia y de seguridad de estos dos agentes son relativamente comparables [9],[16],[17],[18],[38]. Por lo tanto, incluso si se adoptara un enfoque más conservador de minimización de costos, la duloxetina sería seleccionada como la opción preferida.
Se encontró que los resultados del modelo son robustos ante cambios plausibles en los parámetros. La adquisición de los agentes farmacológicos fue el principal rubro de gasto, mientras que las probabilidades de alcanzar buen alivio del dolor con duloxetina y los puntajes de utilidad asignados al buen alivio del dolor y al pobre alivio del dolor se ubicaron entre los parámetros con mayor influencia en el análisis de sensibilidad determinístico. La probabilidad de que la duloxetina resultara dominante, o al menos costo-efectiva para un umbral definido como el valor del producto interno bruto per cápita en Venezuela, fue de 93,9%.
Los pacientes suelen preferir medicamentos con esquemas de una sola toma al día, en lugar de aquellos que requieren de múltiples tomas diarias, ya que los primeros resultan más cómodos y conducen a un mayor cumplimiento comparado con esquemas de tratamiento con dos o tres dosis diarias [23]. Zhao et al reportaron que los pacientes con neuropatía diabética periférica dolorosa que inician con duloxetina tienen significativamente una mayor adherencia terapéutica y costos médicos más bajos que aquellos que inician con pregabalina [39]. En otro estudio observacional, el promedio de la mediana de las dosis diarias realmente tomadas durante seis meses con pregabalina fue tan sólo de 173,5 mg, cifra muy lejana de la dosis recomendada de 300 mg. Mientras, la dosis diaria para la duloxetina fue cercana a los 60 mg. Lo anterior podría explicar la baja efectividad mostrada por la pregabalina en dicho estudio [40].
Los autores del presente estudio consideran que éste cumple con buenos estándares de calidad. Sin embargo, existen ciertas limitaciones que ameritan discusión. En primer lugar, uno podría razonablemente argumentar que un horizonte temporal más amplio podría representar de mejor manera la naturaleza crónica de la neuropatía diabética periférica dolorosa.
No obstante, el adoptar un horizonte temporal corto evita la necesidad de establecer supuestos acerca de los esquemas de titulación, sobre la composición de los esquemas de tratamiento secuencial o sobre la sostenibilidad de los efectos [16]. Las evaluaciones farmacoeconómicas que han explorado horizontes temporales más amplios e incluido terapias secuenciales, también resultan a favor de duloxetina sobre pregabalina [14],[17],[41].
Los costos unitarios de servicios considerados en el modelo se basan en cálculos propios, por lo que las cifras específicas de ahorros de costos deben ser tomadas con cierta cautela. No obstante, lo anterior no afecta la condición de dominancia a favor de la duloxetina ya que más del 90% de los ahorros totales son atribuibles a las diferencias en los costos de adquisición de los agentes comparados. Lo mismo aplica para el uso de recursos derivado del panel de expertos.
Por otra parte, se asignaron puntajes de utilidad obtenidos de la literatura publicada, lo cual es común en América Latina debido a la escasez de datos que reflejen las preferencias locales por estados de salud [16]. Dado que el horizonte temporal es corto y que la diferencia en los años de vida ajustados por calidad esperados es pequeña, el efecto de dicha limitación sobre los resultados es poco relevante.
El presente estudio sugiere que administrar 60 mg diarios de duloxetina es más efectiva y conduce a ganancias en años de vida ajustados por calidad, permaneciendo menos costosa que 300 mg diarios de pregabalina para el tratamiento de individuos con neuropatía diabética periférica dolorosa, afiliados al Instituto Venezolano de los Seguros Sociales. Este hallazgo es consistente con estudios previos, basados en modelaje estadístico y con la evidencia derivada de otros estudios observacionales.
Notas
Financiamiento
El estudio fue financiado por una subvención de Eli Lilly y Compañía de México, S.A. de C.V.
Conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran lo que se describe a continuación. Fernando Carlos reporta haber recibido una subvención de Eli Lilly y Compañía de México, S.A. de C.V., para la realización de este estudio; también reporta haber recibido subvenciones de Eli Lilly y Compañía de México, S.A. de C.V. y de Pfizer, S.A. de C.V., no relacionadas con este estudio. Luis Espejel reporta subvenciones de R A C Salud Consultores, S.A. de C.V. no relacionadas con este estudio. Diego Novick reporta otras relaciones financieras con Eli Lilly and Company Limited, no relacionadas con este estudio. Rubén López es empleado de Lilly. Daniel Flores reporta otras relaciones financieras con Eli Lilly Interamerica, no relacionadas con este estudio. No se reportan otros conflictos de intereses por parte de los autores. Los formularios pueden ser solicitados al autor responsable o a la dirección editorial de la Revista.

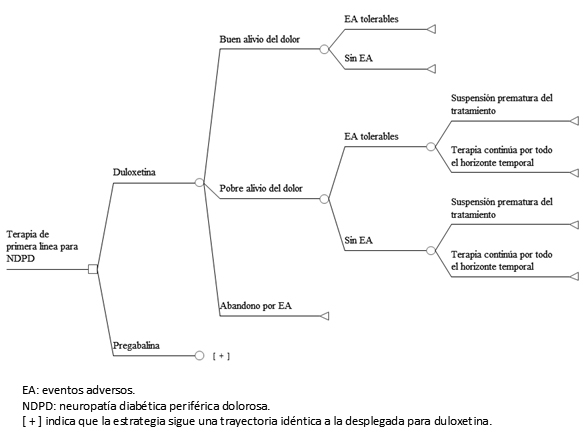 Figura 1. Estructura del modelo
Figura 1. Estructura del modelo

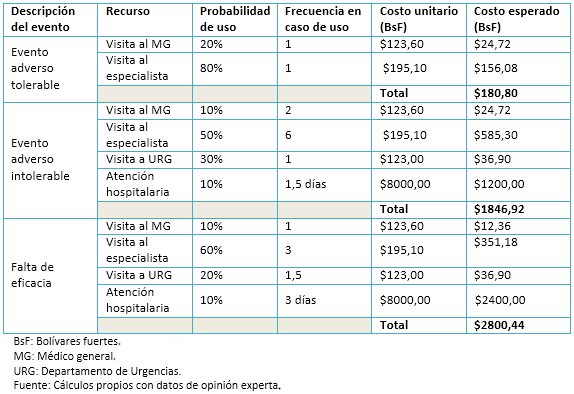 Tabla 1. Uso de recursos y costo esperado asociado con eventos adversos y falta de eficacia
Tabla 1. Uso de recursos y costo esperado asociado con eventos adversos y falta de eficacia

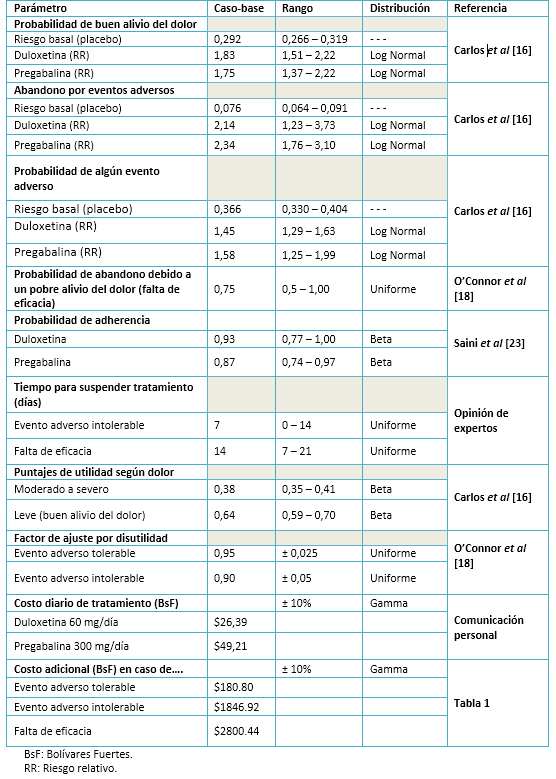 Tabla 2. Valores de los parámetros del modelo: caso-base, rangos y distribuciones
Tabla 2. Valores de los parámetros del modelo: caso-base, rangos y distribuciones

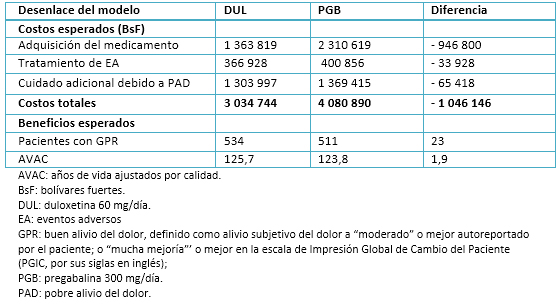 Tabla 3. Resultados del análisis para el caso base (por cada 1000 pacientes con cifras redondeadas)
Tabla 3. Resultados del análisis para el caso base (por cada 1000 pacientes con cifras redondeadas)

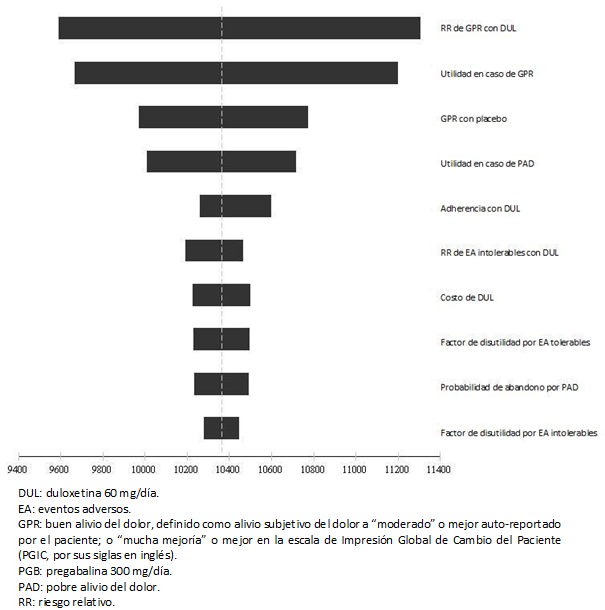 Figura 2. Diagrama de tornado para el beneficio monetario neto de duloxetina
Figura 2. Diagrama de tornado para el beneficio monetario neto de duloxetina

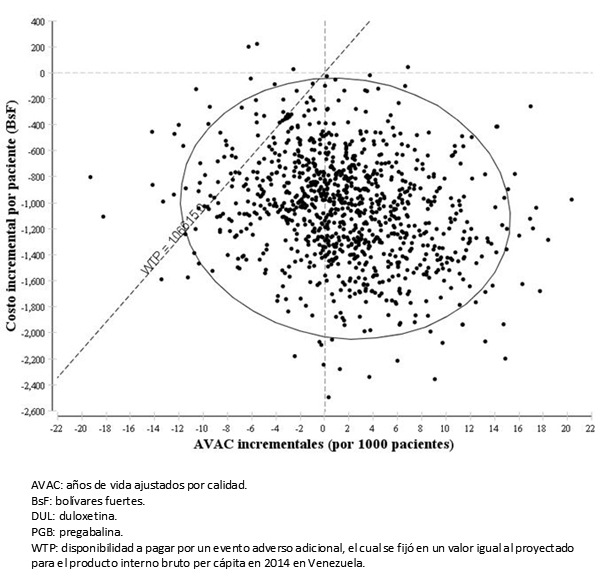 Figura 3. Diagrama de dispersión de costo-utilidad incremental (duloxetina versus pregabalina)
Figura 3. Diagrama de dispersión de costo-utilidad incremental (duloxetina versus pregabalina)
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

INTRODUCCIÓN
La neuropatía diabética periférica dolorosa (NDPD) afecta a 40-50% de los pacientes con neuropatía diabética y se asocia con un deterioro significativo de la calidad de vida y con costos de magnitud considerable. Tanto duloxetina (DUL) como pregabalina (PGB) cuentan con sustento científico basado en evidencias y han sido formalmente aprobados para controlar la NDPD.
MÉTODOS
Se utilizó un modelo de decisión a 12 semanas para examinar el tratamiento de primera línea para la neuropatía diabética periférica dolorosa, con dosis diarias de duloxetina 60 mg o con pregabalina 300 mg, bajo la perspectiva del Instituto Venezolano de los Seguros Sociales. Los parámetros del modelo proceden de literatura publicada y opinión de expertos, enfocándose en la magnitud del alivio del dolor, la presencia de eventos adversos, la posibilidad de abandono debido a eventos adversos intolerables o por falta de eficacia y en los años de vida ajustados por calidad esperados con cada estrategia. Se analizaron los costos médicos directos (expresados en bolívares fuertes), integrados por la adquisición de medicamentos, además del cuidado adicional que se origina por el tratamiento de los eventos adversos y como consecuencia de un pobre alivio del dolor. Se llevaron a cabo análisis de sensibilidad de tipo determinístico y probabilístico.
RESULTADOS
Los costos totales esperados por cada 1000 pacientes fueron de 1 046 146 bolívares fuertes (26%) más bajos con duloxetina en comparación con la pregabalina. La mayor parte de estos ahorros (91%), corresponde a la diferencia en el costo de adquisición entre ambos medicamentos. La duloxetina también se asoció con ganancias de 23 pacientes que lograron un buen alivio del dolor y de dos años de vida ajustados por calidad por cada 1000 tratados. El modelo se mantuvo robusto ante cambios plausibles en sus parámetros principales. La duloxetina continuó siendo la opción preferida en 93,9% de las simulaciones de Monte Carlo de segundo orden generadas.
CONCLUSIONES
El presente estudio sugiere que la duloxetina domina a (es más efectiva, conduce a ganancias en años de vida ajustados por calidad y es menos costosa que) la pregabalina, para el tratamiento de la neuropatía diabética periférica dolorosa.
 Authors:
Fernando Carlos[1], Luis Espejel[2], Diego Novick[3], Rubén López[4], Daniel Flores[5]
Authors:
Fernando Carlos[1], Luis Espejel[2], Diego Novick[3], Rubén López[4], Daniel Flores[5]
Affiliation:
[1] R A C Salud Consultores, S.A. de C.V.
[2] Consultor independiente
[3] Eli Lilly and Company, Windlesham, Surrey, UK
[4] Eli Lilly and Company, Caracas, Venezuela
[5] Eli Lilly and Company, Buenos Aires, Argentina
E-mail: fernando.carlos@racsalud.com
Author address:
[1] Insurgentes Sur 598 P2-204 Mza.
Col. Del Valle, Deleg. Benito Juárez
Ciudad de México, D.F.
México
C.P. 03100

Citation: Carlos F, Espejel L, Novick D, López R, Flores D. Duloxetine for the treatment of painful diabetic peripheral neuropathy in Venezuela: economic evaluation. Medwave 2015 Sep;15(8):e6265 doi: 10.5867/medwave.2015.08.6265
Submission date: 30/6/2015
Acceptance date: 20/8/2015
Publication date: 2/10/2015
Origin: not requested
Type of review: reviewed by two external peer reviewers, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Gobierno Federal, Estados Unidos Mexicanos. Diagnóstico y tratamiento médico del dolor por neuropatía diabética en adultos en el primer nivel de atención. México: Secretaría de Salud; 2009. | Link |
- Asociación Venezolana para el Estudio del Dolor. Consenso Venezolano sobre Dolor Neuropático, Caracas: AVED; 2007.
- Veves A, Backonja M, Malik RA. Painful diabetic neuropathy: epidemiology, natural history, early diagnosis, and treatment options. Pain Med. 2008 Sep;9(6):660-74. | PubMed |
- Gore M, Brandenburg NA, Dukes E, Hoffman DL, Tai KS, Stacey B. Pain severity in diabetic peripheral neuropathy is associated with patient functioning, symptom levels of anxiety and depression, and sleep. J Pain Symptom Manage. 2005 Oct;30(4):374-85. | PubMed |
- Hoffman DL, Sadosky A, Alvir J. Cross-national burden of painful diabetic peripheral neuropathy in Asia, Latin America, and the Middle East. Pain Pract.2009 Jan-Feb;9(1):35-42. | CrossRef | PubMed |
- Gore M, Brandenburg NA, Hoffman DL, Tai KS, Stacey B. Burden of illness in painful diabetic peripheral neuropathy: the patients' perspectives. J Pain. 2006 Dec;7(12):892-900. | PubMed |
- Ritzwoller DP, Ellis JL, Korner EJ, Hartsfield CL, Sadosky A. Comorbidities, healthcare service utilization and costs for patients identified with painful DPN in a managed-care setting. Curr Med Res Opin. 2009 Jun;25(6):1319-28. | CrossRef | PubMed |
- Mehra M, Merchant S, Gupta S, Potluri RC. Diabetic peripheral neuropathy: resource utilization and burden of illness. J Med Econ. 2014 Sep;17(9):637-45. | CrossRef | PubMed |
- Snedecor SJ, Sudharshan L, Cappelleri JC, Sadosky A, Mehta S, Botteman M. Systematic review and meta-analysis of pharmacological therapies for painful diabetic peripheral neuropathy. Pain Pract. 2014 Feb;14(2):167-84. | CrossRef | PubMed |
- Iyer S, Tanenberg RJ. Pharmacologic management of diabetic peripheral neuropathic pain. Expert Opin Pharmacother. 2013 Sep;14(13):1765-75. | CrossRef | PubMed |
- European Medicines Agency. CHMP summary of positive opinion for Duloxetine Lilly. London ,UK: EMA; 2014 [on line]. | Link |
- Silver Spring MD. Highlights of prescribing information, Cymbalta. United States: FDA; 2014. | Link |
- Kobelt G. Health economics: an introduction to economic evaluation. 2nd ed. London, UK: Office for Health Economics; 2002.
- National Institute for Health and Clinical Excellence. Neuropathic pain: the pharmacological management of neuropathic pain in adults in nonspecialist settings of neuropathic pain in adults in non-specialist settings. London: NICE clinical guideline 96; 2010. | Link |
- Bril V, England J, Franklin GM, Backonja M, Cohen J, Del Toro D, et al. Evidence-based guideline: treatment of painful diabetic neuropathy: report of the American Academy of Neurology, the American Association of Neuromuscular and Electrodiagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation. Neurology. 2011 May 17;76(20):1758-65. | CrossRef | PubMed |
- Carlos F, Ramírez-Gámez J, Dueñas H, Galindo-Suárez RM, Ramos E. Economic evaluation of duloxetine as a first-line treatment for painful diabetic peripheral neuropathy in Mexico. J Med Econ. 2012;15(2):233-44. | CrossRef | PubMed |
- Bellows BK, Dahal A, Jiao T, Biskupiak J. A cost-utility analysis of pregabalin versus duloxetine for the treatment of painful diabetic neuropathy. J Pain Palliat Care Pharmacother. 2012;26(2):153-64. | CrossRef |
- O'Connor AB, Noyes K, Holloway RG. A cost-utility comparison of four first-line medications in painful diabetic neuropathy. Pharmacoeconomics. 2008;26(12):1045-64. | CrossRef | PubMed |
- Goldstein DJ, Lu Y, Detke MJ, Lee TC, Iyengar S. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain. 2005 Jul;116(1-2):109-18. | PubMed |
- Raskin J, Pritchett YL, Wang F, D'Souza DN, Waninger AL, Iyengar S, et al. A double-blind, randomized multicenter trial comparing duloxetine with placebo in the management of diabetic peripheral neuropathic pain. Pain Med. 2005 Sep-Oct;6(5):346-56. | PubMed |
- Wernicke JF, Pritchett YL, D'Souza DN, Waninger A, Tran P, Iyengar S, et al. A randomized controlled trial of duloxetine in diabetic peripheral neuropathic pain. Neurology. 2006 Oct 24;67(8):1411-20. | PubMed |
- Drummond MF, Sculpher MJ, Torrance G, O'Brien BJ, Stoddart GL. Methods for the economic evaluation of health care programmes. 3rd ed. Oxford, UK: Oxford University Press; 2005.
- Saini SD, Schoenfeld P, Kaulback K, Dubinsky MC. Effect of medication dosing frequency on adherence in chronic diseases. Am J Manag Care. 2009 Jun 1;15(6):e22-33. | PubMed |
- República Bolivariana de Venezuela, Tribunal Supremo de Justicia. Gaceta Oficial Número 40.253. tsj.gov.ve [on line]. | Link |
- Banco Central de Venezuela. Tipos de Cambio de Referencia. bcv.org.ve [on line]. | Link |
- Arezzo JC, Rosenstock J, Lamoreaux L, Pauer L. Efficacy and safety of pregabalin 600 mg/d for treating painful diabetic peripheral neuropathy: a double-blind placebo-controlled trial. BMC Neurol. 2008 Sep 16;8:33. | CrossRef | PubMed |
- Tölle T, Freynhagen R, Versavel M, Trostmann U, Young JP Jr. Pregabalin for relief of neuropathic pain associated with diabetic neuropathy: a randomized, double-blind study. Eur J Pain. 2008 Feb;12(2):203-13. Epub 2007 Jul 16. | PubMed |
- Silver Spring MD. Center for Drug Evaluation and Research. Lyrica (pregabalin) capsules. Company: Pfizer Global Research & Development. Application No.: 021446. Approval date: 12/30/2004. United States: FDA; 2005. | Link |
- Freynhagen R, Strojek K, Griesing T, Whalen E, Balkenohl M. Efficacy of pregabalin in neuropathic pain evaluated in a 12-week, randomised, double-blind, multicentre, placebo-controlled trial of flexible- and fixed-dose regimens. Pain. 2005 Jun;115(3):254-63. | PubMed |
- Richter RW, Portenoy R, Sharma U, Lamoreaux L, Bockbrader H, Knapp LE. Relief of painful diabetic peripheral neuropathy with pregabalin: a randomized, placebo-controlled trial. J Pain. 2005 Apr;6(4):253-60. | PubMed |
- Lesser H, Sharma U, LaMoreaux L, Poole RM. Pregabalin relieves symptoms of painful diabetic neuropathy: a randomized controlled trial. Neurology. 2004 Dec 14;63(11):2104-10. | PubMed |
- Rosenstock J, Tuchman M, LaMoreaux L, Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo-controlled trial. Pain. 2004 Aug;110(3):628-38. | PubMed |
- Tölle T, Xu X, Sadosky AB. Painful diabetic neuropathy: a cross-sectional survey of health state impairment and treatment patterns. J Diabetes Complications. 2006 Jan-Feb;20(1):26-33. | PubMed |
- Currie CJ, Poole CD, Woehl A, Morgan CL, Cawley S, Rousculp MD, et al. The health-related utility and health-related quality of life of hospital-treated subjects with type 1 or type 2 diabetes with particular reference to differing severity of peripheral neuropathy. Diabetologia. 2006 Oct;49(10):2272-80. | PubMed |
- International Monetary Fund. World Economic Outlook Database, October 2014 edition Washington, D.C: IMF; 2014[on line]. | Link |
- International Diabetes Federation. IDF Diabetes atlas, 6th ed. Brussels, Belgium: IDF; 2013. | PubMed |
- Giannini C, Mohn A, Chiarelli F. Technology and the issue of cost/benefit in diabetes. Diabetes Metab Res Rev. 2009 Sep;25 Suppl 1:S34-44. | CrossRef | PubMed |
- Quilici S, Chancellor J, Löthgren M, Simon D, Said G, Le TK, et al. Meta-analysis of duloxetine vs. pregabalin and gabapentin in the treatment of diabetic peripheral neuropathic pain. BMC Neurol. 2009 Feb 10;9:6. | CrossRef | PubMed |
- Zhao Y, Sun P, Watson P. Medication adherence and healthcare costs among patients with diabetic peripheral neuropathic pain initiating duloxetine versus pregabalin. Curr Med Res Opin. 2011 Apr;27(4):785-92. | CrossRef | PubMed |
- Happich M, Schneider E, Boess FG, Wilhelm S, Schacht A, Birklein F, et al. Effectiveness of duloxetine compared with pregabalin and gabapentin in diabetic peripheral neuropathic pain: results from a German observational study. Clin J Pain. 2014 Oct;30(10):875-85. | CrossRef | PubMed |
- Beard SM, McCrink L, Le TK, Garcia-Cebrian A, Monz B, Malik RA. Cost effectiveness of duloxetine in the treatment of diabetic peripheral neuropathic pain in the UK. Curr Med Res Opin. 2008 Feb;24(2):385-99. | PubMed |
 Gobierno Federal, Estados Unidos Mexicanos. Diagnóstico y tratamiento médico del dolor por neuropatía diabética en adultos en el primer nivel de atención. México: Secretaría de Salud; 2009. | Link |
Gobierno Federal, Estados Unidos Mexicanos. Diagnóstico y tratamiento médico del dolor por neuropatía diabética en adultos en el primer nivel de atención. México: Secretaría de Salud; 2009. | Link | Asociación Venezolana para el Estudio del Dolor. Consenso Venezolano sobre Dolor Neuropático, Caracas: AVED; 2007.
Asociación Venezolana para el Estudio del Dolor. Consenso Venezolano sobre Dolor Neuropático, Caracas: AVED; 2007.  Veves A, Backonja M, Malik RA. Painful diabetic neuropathy: epidemiology, natural history, early diagnosis, and treatment options. Pain Med. 2008 Sep;9(6):660-74. | PubMed |
Veves A, Backonja M, Malik RA. Painful diabetic neuropathy: epidemiology, natural history, early diagnosis, and treatment options. Pain Med. 2008 Sep;9(6):660-74. | PubMed | Gore M, Brandenburg NA, Dukes E, Hoffman DL, Tai KS, Stacey B. Pain severity in diabetic peripheral neuropathy is associated with patient functioning, symptom levels of anxiety and depression, and sleep. J Pain Symptom Manage. 2005 Oct;30(4):374-85. | PubMed |
Gore M, Brandenburg NA, Dukes E, Hoffman DL, Tai KS, Stacey B. Pain severity in diabetic peripheral neuropathy is associated with patient functioning, symptom levels of anxiety and depression, and sleep. J Pain Symptom Manage. 2005 Oct;30(4):374-85. | PubMed | Hoffman DL, Sadosky A, Alvir J. Cross-national burden of painful diabetic peripheral neuropathy in Asia, Latin America, and the Middle East. Pain Pract.2009 Jan-Feb;9(1):35-42. | CrossRef | PubMed |
Hoffman DL, Sadosky A, Alvir J. Cross-national burden of painful diabetic peripheral neuropathy in Asia, Latin America, and the Middle East. Pain Pract.2009 Jan-Feb;9(1):35-42. | CrossRef | PubMed | Gore M, Brandenburg NA, Hoffman DL, Tai KS, Stacey B. Burden of illness in painful diabetic peripheral neuropathy: the patients' perspectives. J Pain. 2006 Dec;7(12):892-900. | PubMed |
Gore M, Brandenburg NA, Hoffman DL, Tai KS, Stacey B. Burden of illness in painful diabetic peripheral neuropathy: the patients' perspectives. J Pain. 2006 Dec;7(12):892-900. | PubMed | Ritzwoller DP, Ellis JL, Korner EJ, Hartsfield CL, Sadosky A. Comorbidities, healthcare service utilization and costs for patients identified with painful DPN in a managed-care setting. Curr Med Res Opin. 2009 Jun;25(6):1319-28. | CrossRef | PubMed |
Ritzwoller DP, Ellis JL, Korner EJ, Hartsfield CL, Sadosky A. Comorbidities, healthcare service utilization and costs for patients identified with painful DPN in a managed-care setting. Curr Med Res Opin. 2009 Jun;25(6):1319-28. | CrossRef | PubMed | Mehra M, Merchant S, Gupta S, Potluri RC. Diabetic peripheral neuropathy: resource utilization and burden of illness. J Med Econ. 2014 Sep;17(9):637-45. | CrossRef | PubMed |
Mehra M, Merchant S, Gupta S, Potluri RC. Diabetic peripheral neuropathy: resource utilization and burden of illness. J Med Econ. 2014 Sep;17(9):637-45. | CrossRef | PubMed | Snedecor SJ, Sudharshan L, Cappelleri JC, Sadosky A, Mehta S, Botteman M. Systematic review and meta-analysis of pharmacological therapies for painful diabetic peripheral neuropathy. Pain Pract. 2014 Feb;14(2):167-84. | CrossRef | PubMed |
Snedecor SJ, Sudharshan L, Cappelleri JC, Sadosky A, Mehta S, Botteman M. Systematic review and meta-analysis of pharmacological therapies for painful diabetic peripheral neuropathy. Pain Pract. 2014 Feb;14(2):167-84. | CrossRef | PubMed | Iyer S, Tanenberg RJ. Pharmacologic management of diabetic peripheral neuropathic pain. Expert Opin Pharmacother. 2013 Sep;14(13):1765-75. | CrossRef | PubMed |
Iyer S, Tanenberg RJ. Pharmacologic management of diabetic peripheral neuropathic pain. Expert Opin Pharmacother. 2013 Sep;14(13):1765-75. | CrossRef | PubMed | European Medicines Agency. CHMP summary of positive opinion for Duloxetine Lilly. London ,UK: EMA; 2014 [on line]. | Link |
European Medicines Agency. CHMP summary of positive opinion for Duloxetine Lilly. London ,UK: EMA; 2014 [on line]. | Link | Silver Spring MD. Highlights of prescribing information, Cymbalta. United States: FDA; 2014. | Link |
Silver Spring MD. Highlights of prescribing information, Cymbalta. United States: FDA; 2014. | Link | Kobelt G. Health economics: an introduction to economic evaluation. 2nd ed. London, UK: Office for Health Economics; 2002.
Kobelt G. Health economics: an introduction to economic evaluation. 2nd ed. London, UK: Office for Health Economics; 2002.  National Institute for Health and Clinical Excellence. Neuropathic pain: the pharmacological management of neuropathic pain in adults in nonspecialist settings of neuropathic pain in adults in non-specialist settings. London: NICE clinical guideline 96; 2010. | Link |
National Institute for Health and Clinical Excellence. Neuropathic pain: the pharmacological management of neuropathic pain in adults in nonspecialist settings of neuropathic pain in adults in non-specialist settings. London: NICE clinical guideline 96; 2010. | Link | Bril V, England J, Franklin GM, Backonja M, Cohen J, Del Toro D, et al. Evidence-based guideline: treatment of painful diabetic neuropathy: report of the American Academy of Neurology, the American Association of Neuromuscular and Electrodiagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation. Neurology. 2011 May 17;76(20):1758-65. | CrossRef | PubMed |
Bril V, England J, Franklin GM, Backonja M, Cohen J, Del Toro D, et al. Evidence-based guideline: treatment of painful diabetic neuropathy: report of the American Academy of Neurology, the American Association of Neuromuscular and Electrodiagnostic Medicine, and the American Academy of Physical Medicine and Rehabilitation. Neurology. 2011 May 17;76(20):1758-65. | CrossRef | PubMed | Carlos F, Ramírez-Gámez J, Dueñas H, Galindo-Suárez RM, Ramos E. Economic evaluation of duloxetine as a first-line treatment for painful diabetic peripheral neuropathy in Mexico. J Med Econ. 2012;15(2):233-44.
| CrossRef | PubMed |
Carlos F, Ramírez-Gámez J, Dueñas H, Galindo-Suárez RM, Ramos E. Economic evaluation of duloxetine as a first-line treatment for painful diabetic peripheral neuropathy in Mexico. J Med Econ. 2012;15(2):233-44.
| CrossRef | PubMed | Bellows BK, Dahal A, Jiao T, Biskupiak J. A cost-utility analysis of pregabalin versus duloxetine for the treatment of painful diabetic neuropathy. J Pain Palliat Care Pharmacother. 2012;26(2):153-64. | CrossRef |
Bellows BK, Dahal A, Jiao T, Biskupiak J. A cost-utility analysis of pregabalin versus duloxetine for the treatment of painful diabetic neuropathy. J Pain Palliat Care Pharmacother. 2012;26(2):153-64. | CrossRef | O'Connor AB, Noyes K, Holloway RG. A cost-utility comparison of four first-line medications in painful diabetic neuropathy. Pharmacoeconomics. 2008;26(12):1045-64.
| CrossRef | PubMed |
O'Connor AB, Noyes K, Holloway RG. A cost-utility comparison of four first-line medications in painful diabetic neuropathy. Pharmacoeconomics. 2008;26(12):1045-64.
| CrossRef | PubMed | Goldstein DJ, Lu Y, Detke MJ, Lee TC, Iyengar S. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain. 2005 Jul;116(1-2):109-18. | PubMed |
Goldstein DJ, Lu Y, Detke MJ, Lee TC, Iyengar S. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain. 2005 Jul;116(1-2):109-18. | PubMed | Raskin J, Pritchett YL, Wang F, D'Souza DN, Waninger AL, Iyengar S, et al. A double-blind, randomized multicenter trial comparing duloxetine with placebo in the management of diabetic peripheral neuropathic pain. Pain Med. 2005 Sep-Oct;6(5):346-56. | PubMed |
Raskin J, Pritchett YL, Wang F, D'Souza DN, Waninger AL, Iyengar S, et al. A double-blind, randomized multicenter trial comparing duloxetine with placebo in the management of diabetic peripheral neuropathic pain. Pain Med. 2005 Sep-Oct;6(5):346-56. | PubMed | Wernicke JF, Pritchett YL, D'Souza DN, Waninger A, Tran P, Iyengar S, et al. A randomized controlled trial of duloxetine in diabetic peripheral neuropathic pain. Neurology. 2006 Oct 24;67(8):1411-20. | PubMed |
Wernicke JF, Pritchett YL, D'Souza DN, Waninger A, Tran P, Iyengar S, et al. A randomized controlled trial of duloxetine in diabetic peripheral neuropathic pain. Neurology. 2006 Oct 24;67(8):1411-20. | PubMed | Drummond MF, Sculpher MJ, Torrance G, O'Brien BJ, Stoddart GL. Methods for the economic evaluation of health care programmes. 3rd ed. Oxford, UK: Oxford University Press; 2005.
Drummond MF, Sculpher MJ, Torrance G, O'Brien BJ, Stoddart GL. Methods for the economic evaluation of health care programmes. 3rd ed. Oxford, UK: Oxford University Press; 2005.  Saini SD, Schoenfeld P, Kaulback K, Dubinsky MC. Effect of medication dosing frequency on adherence in chronic diseases. Am J Manag Care. 2009 Jun 1;15(6):e22-33. | PubMed |
Saini SD, Schoenfeld P, Kaulback K, Dubinsky MC. Effect of medication dosing frequency on adherence in chronic diseases. Am J Manag Care. 2009 Jun 1;15(6):e22-33. | PubMed | República Bolivariana de Venezuela, Tribunal Supremo de Justicia. Gaceta Oficial Número 40.253. tsj.gov.ve [on line]. | Link |
República Bolivariana de Venezuela, Tribunal Supremo de Justicia. Gaceta Oficial Número 40.253. tsj.gov.ve [on line]. | Link | Arezzo JC, Rosenstock J, Lamoreaux L, Pauer L. Efficacy and safety of pregabalin 600 mg/d for treating painful diabetic peripheral neuropathy: a double-blind placebo-controlled trial. BMC Neurol. 2008 Sep 16;8:33. | CrossRef | PubMed |
Arezzo JC, Rosenstock J, Lamoreaux L, Pauer L. Efficacy and safety of pregabalin 600 mg/d for treating painful diabetic peripheral neuropathy: a double-blind placebo-controlled trial. BMC Neurol. 2008 Sep 16;8:33. | CrossRef | PubMed | Tölle T, Freynhagen R, Versavel M, Trostmann U, Young JP Jr. Pregabalin for relief of neuropathic pain associated with diabetic neuropathy: a randomized, double-blind study. Eur J Pain. 2008 Feb;12(2):203-13. Epub 2007 Jul 16. | PubMed |
Tölle T, Freynhagen R, Versavel M, Trostmann U, Young JP Jr. Pregabalin for relief of neuropathic pain associated with diabetic neuropathy: a randomized, double-blind study. Eur J Pain. 2008 Feb;12(2):203-13. Epub 2007 Jul 16. | PubMed | Silver Spring MD. Center for Drug Evaluation and Research. Lyrica (pregabalin) capsules. Company: Pfizer Global Research & Development. Application No.: 021446. Approval date: 12/30/2004. United States: FDA; 2005. | Link |
Silver Spring MD. Center for Drug Evaluation and Research. Lyrica (pregabalin) capsules. Company: Pfizer Global Research & Development. Application No.: 021446. Approval date: 12/30/2004. United States: FDA; 2005. | Link | Freynhagen R, Strojek K, Griesing T, Whalen E, Balkenohl M. Efficacy of pregabalin in neuropathic pain evaluated in a 12-week, randomised, double-blind, multicentre, placebo-controlled trial of flexible- and fixed-dose regimens. Pain. 2005 Jun;115(3):254-63. | PubMed |
Freynhagen R, Strojek K, Griesing T, Whalen E, Balkenohl M. Efficacy of pregabalin in neuropathic pain evaluated in a 12-week, randomised, double-blind, multicentre, placebo-controlled trial of flexible- and fixed-dose regimens. Pain. 2005 Jun;115(3):254-63. | PubMed | Richter RW, Portenoy R, Sharma U, Lamoreaux L, Bockbrader H, Knapp LE. Relief of painful diabetic peripheral neuropathy with pregabalin: a randomized, placebo-controlled trial. J Pain. 2005 Apr;6(4):253-60. | PubMed |
Richter RW, Portenoy R, Sharma U, Lamoreaux L, Bockbrader H, Knapp LE. Relief of painful diabetic peripheral neuropathy with pregabalin: a randomized, placebo-controlled trial. J Pain. 2005 Apr;6(4):253-60. | PubMed | Lesser H, Sharma U, LaMoreaux L, Poole RM. Pregabalin relieves symptoms of painful diabetic neuropathy: a randomized controlled trial. Neurology. 2004 Dec 14;63(11):2104-10. | PubMed |
Lesser H, Sharma U, LaMoreaux L, Poole RM. Pregabalin relieves symptoms of painful diabetic neuropathy: a randomized controlled trial. Neurology. 2004 Dec 14;63(11):2104-10. | PubMed | Rosenstock J, Tuchman M, LaMoreaux L, Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo-controlled trial. Pain. 2004 Aug;110(3):628-38. | PubMed |
Rosenstock J, Tuchman M, LaMoreaux L, Sharma U. Pregabalin for the treatment of painful diabetic peripheral neuropathy: a double-blind, placebo-controlled trial. Pain. 2004 Aug;110(3):628-38. | PubMed | Tölle T, Xu X, Sadosky AB. Painful diabetic neuropathy: a cross-sectional survey of health state impairment and treatment patterns. J Diabetes Complications. 2006 Jan-Feb;20(1):26-33. | PubMed |
Tölle T, Xu X, Sadosky AB. Painful diabetic neuropathy: a cross-sectional survey of health state impairment and treatment patterns. J Diabetes Complications. 2006 Jan-Feb;20(1):26-33. | PubMed | Currie CJ, Poole CD, Woehl A, Morgan CL, Cawley S, Rousculp MD, et al. The health-related utility and health-related quality of life of hospital-treated subjects with type 1 or type 2 diabetes with particular reference to differing severity of peripheral neuropathy. Diabetologia. 2006 Oct;49(10):2272-80. | PubMed |
Currie CJ, Poole CD, Woehl A, Morgan CL, Cawley S, Rousculp MD, et al. The health-related utility and health-related quality of life of hospital-treated subjects with type 1 or type 2 diabetes with particular reference to differing severity of peripheral neuropathy. Diabetologia. 2006 Oct;49(10):2272-80. | PubMed | International Monetary Fund. World Economic Outlook Database, October 2014 edition Washington, D.C: IMF; 2014[on line]. | Link |
International Monetary Fund. World Economic Outlook Database, October 2014 edition Washington, D.C: IMF; 2014[on line]. | Link | International Diabetes Federation. IDF Diabetes atlas, 6th ed. Brussels, Belgium: IDF; 2013. | PubMed |
International Diabetes Federation. IDF Diabetes atlas, 6th ed. Brussels, Belgium: IDF; 2013. | PubMed | Giannini C, Mohn A, Chiarelli F. Technology and the issue of cost/benefit in diabetes. Diabetes Metab Res Rev. 2009 Sep;25 Suppl 1:S34-44. | CrossRef | PubMed |
Giannini C, Mohn A, Chiarelli F. Technology and the issue of cost/benefit in diabetes. Diabetes Metab Res Rev. 2009 Sep;25 Suppl 1:S34-44. | CrossRef | PubMed | Quilici S, Chancellor J, Löthgren M, Simon D, Said G, Le TK, et al. Meta-analysis of duloxetine vs. pregabalin and gabapentin in the
treatment of diabetic peripheral neuropathic pain. BMC Neurol. 2009 Feb 10;9:6. | CrossRef | PubMed |
Quilici S, Chancellor J, Löthgren M, Simon D, Said G, Le TK, et al. Meta-analysis of duloxetine vs. pregabalin and gabapentin in the
treatment of diabetic peripheral neuropathic pain. BMC Neurol. 2009 Feb 10;9:6. | CrossRef | PubMed | Zhao Y, Sun P, Watson P. Medication adherence and healthcare costs among patients with diabetic peripheral neuropathic pain initiating duloxetine versus pregabalin. Curr Med Res Opin. 2011 Apr;27(4):785-92. | CrossRef | PubMed |
Zhao Y, Sun P, Watson P. Medication adherence and healthcare costs among patients with diabetic peripheral neuropathic pain initiating duloxetine versus pregabalin. Curr Med Res Opin. 2011 Apr;27(4):785-92. | CrossRef | PubMed | Happich M, Schneider E, Boess FG, Wilhelm S, Schacht A, Birklein F, et al. Effectiveness of duloxetine compared with pregabalin and gabapentin in diabetic peripheral neuropathic pain: results from a German observational study. Clin J Pain. 2014 Oct;30(10):875-85. | CrossRef | PubMed |
Happich M, Schneider E, Boess FG, Wilhelm S, Schacht A, Birklein F, et al. Effectiveness of duloxetine compared with pregabalin and gabapentin in diabetic peripheral neuropathic pain: results from a German observational study. Clin J Pain. 2014 Oct;30(10):875-85. | CrossRef | PubMed | Beard SM, McCrink L, Le TK, Garcia-Cebrian A, Monz B, Malik RA. Cost effectiveness of duloxetine in the treatment of diabetic peripheral neuropathic pain in the UK. Curr Med Res Opin. 2008 Feb;24(2):385-99.
| PubMed |
Beard SM, McCrink L, Le TK, Garcia-Cebrian A, Monz B, Malik RA. Cost effectiveness of duloxetine in the treatment of diabetic peripheral neuropathic pain in the UK. Curr Med Res Opin. 2008 Feb;24(2):385-99.
| PubMed |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis








