
 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: non-alcoholic fatty liver disease, liver steatosis, advanced glycation end products, liver fibrosis, adipocytokines
La enfermedad hepática no alcohólica se refiere a un espectro de enfermedades que va desde hígado graso, hasta esteatohepatitis y que puede cursar por fibrosis, cirrosis y hepatocarcinoma. Dado que a nivel mundial se ha incrementado la prevalencia de la obesidad, los cambios en el estilo de vida y la alimentación desbalanceada, la enfermedad hepática no alcohólica se ha convertido en un problema de salud pública. Se le considera como la manifestación hepática del síndrome metabólico, asociada a resistencia a la insulina, obesidad central, diabetes mellitus tipo 2, e hipertrigliceridemia. Se estima que la resistencia a la insulina, juega un papel detonador en la patogénesis de la enfermedad hepática no alcohólica. En este artículo se describen diferentes aspectos de la enfermedad hepática no alcohólica: la epidemiología, la patofisiología, su progresión hacia esteatohepatitis con particular énfasis en la fibrosis hepática, la participación de los productos finales de glicación avanzada, y los diferentes tratamientos reportados. Se realizó una búsqueda de artículos en la base de datos de PubMed con los términos esteatohepatitis, esteatosis, productos finales de glicación avanzada, fibrosis hepática y adipocinas. Los artículos fueron seleccionados por su relevancia en el tema.
La enfermedad hepática no alcohólica se ha convertido en un padecimiento común debido al incremento de la obesidad. El primer evento que se presenta es la esteatosis hepática, siendo la esteatohepatitis no alcohólica la forma más agresiva de la enfermedad hepática no alcohólica ya que puede progresar a fibrosis, cirrosis y hepatocarcinoma [1]. El término de esteatohepatitis no alcohólica fue empleado originalmente para describir hallazgos histopatológicos típicos de la enfermedad hepática alcohólica en pacientes sin consumo significativo de alcohol (<20 gramos al día) [2]. La enfermedad hepática no alcohólica se considera la manifestación hepática del síndrome metabólico.
Con un rápido incremento en la prevalencia del síndrome metabólico, la enfermedad hepática no alcohólica se ha convertido en la forma más común de enfermedad hepática [3], se considera un problema de salud pública [4]. Esta revisión tiene como objetivo presentar la importancia de esta patología debido a su relación con la obesidad. Aborda los aspectos moleculares involucrados en la progresión de esteatosis hacia esteatohepatitis, así como las principales estrategias terapéuticas.
Se realizó una búsqueda de artículos en la base de datos de PubMed, incluidas referencias personales. Se eligieron artículos indexados desde el año 2000 al año 2016. También fueron elegidos artículos de años anteriores a 2000 por su relevancia en el tema. Se incluyeron artículos de revisión, ensayos clínicos y experimentales en modelos animales. Para la búsqueda se emplearon los términos esteatohepatitis, enfermedad hepática no alcohólica, adipocinas, en combinación con fibrosis hepática, productos finales de glicación avanzada, esteatosis y esteatohepatitis.
Prevalencia
La enfermedad hepática no alcohólica afecta entre 20 y 30% de la población mundial. Se calcula que la prevalencia de esteatohepatitis es de 15 a 20% mayor en pacientes con obesidad. La prevalencia de esteatosis en la población hispana es de 45%, en población caucásica 33% y en los afroamericanos de 24%. En cuanto al género, la incidencia está presente en 42% en hombres y 24% en mujeres [5]. En Estados Unidos, la enfermedad hepática no alcohólica se incrementó del 47% al 75% en el periodo desde 1988 hasta 2008. No es casual que en este mismo periodo se reportara un aumento en la prevalencia de obesidad, diabetes mellitus 2, obesidad visceral, resistencia a la insulina e hipertensión [1]. Con respecto a la población infantil se registra una prevalencia de 7,6% en la población en general y 34,2% en población infantil referida con obesidad [6]. Se estima que en México la prevalencia puede ser del 20% [7]. Sin embargo, datos recientes lo colocan en el cuarto lugar con una prevalencia de 26,1%, antecedido por Belice y Barbados con 28% y 28,2% respectivamente [8]. Mientras que los valores más bajos son para Nigeria con 9% e Irán con 4,1% [9].
Diagnóstico
La mayoría de los pacientes son asintomáticos al momento del diagnóstico. Usualmente un ultrasonido abdominal puede indicar esteatosis hepática. La detección de la enfermedad hepática no alcohólica se fundamenta en el aumento de transaminasas, así como en el desarrollo de hepatomegalia. Los niveles bioquímicos marcadores de pacientes con la enfermedad hepática no alcohólica son la hiperlipidemia, la hiperglucemia, e hiperinsulinemia. Los valores de transaminasas se incrementan con un cociente de aspartato transaminasa/alanina transaminasa menor de 1. Cuando el cociente es mayor a 1, sugiere la progresión a cirrosis [10]. Otros métodos no invasivos incluyen elastografía por resonancia magnética, que mide el grosor del hígado para inferir el grado de fibrosis. La resonancia magnética espectroscópica es un método cuantitativo para medir grasa hepática, su uso se limita en la clínica debido a su disponibilidad y costo. Sin embargo, la biopsia hepática continúa siendo el “estándar de oro”, ya que permite distinguir entre simple esteatosis y fibrosis [11].
Etiología
La etiología se puede dividir en dos grandes grupos:
Aspectos moleculares
El desarrollo de la enfermedad hepática no alcohólica es un proceso complejo. No queda claro por qué algunos pacientes con esta patología desarrollan esteatohepatitis, mientras que otros no. Una explicación probable radica en la predisposición genética. Se calcula que 10% de pacientes con hígado graso progresa hacia esteatohepatitis, de estos pacientes entre 8 y 26% deriva hacia cirrosis y hepatocarcinoma [13].
La progresión hacia esteatohepatitis es un evento en dos pasos conocido como la teoría de doble “hit”, o doble golpe. El primer paso involucra el depósito de grasa en el hígado como resultado de la resistencia a la insulina. El segundo paso comprende el estrés oxidante de grasa hepática derivada por la liberación de citocinas, la hiperinsulinemia y la lipoperoxidación [14]. Sin embargo, se ha reportado que este proceso podría ser un evento multifactorial [15]. La acumulación de grasa, fundamentalmente de triglicéridos, es el punto central para el desarrollo de la enfermedad hepática no alcohólica [16]. A continuación, se describirán a los actores principales del desarrollo de la enfermedad hepática no alcohólica.
Resistencia a la insulina y lípidos hepáticos
La resistencia a la insulina se define como la disminución en la capacidad para responder a la señal de insulina por sus tejidos blancos, principalmente músculo esquelético, hígado y tejido adiposo. La insulina es un inhibidor de la producción de glucosa endógena, la cual es alterada en presencia de la resistencia a la insulina hepática [17]. El aumento de grasa visceral se asocia con la resistencia a la insulina hepática ya que la grasa visceral es altamente lipídica, y los ácidos grasos son directamente liberados a la vena porta. Estudios en modelos animales indican que el hígado puede acumular lípidos en pocas semanas y, más aún, en pocos días. Se ha reportado que la alteración en la síntesis y secreción de ácidos grasos de muy baja densidad, así como un incremento en la síntesis y oxidación de ácidos grasos, resulta en el desarrollo de hígado graso [18].
La enfermedad hepática no alcohólica afecta principalmente a pacientes con obesidad visceral, dislipidemia, resistencia a la insulina y glucosa alterada, que son factores comunes del síndrome metabólico. Por esta razón es considerada la manifestación hepática del síndrome metabólico [19]. Ambos desórdenes se caracterizan por un incremento en la tendencia para desarrollar un proceso aterosclerótico temprano.
La enfermedad hepática no alcohólica es un marcador de la acumulación patológica de grasa ectópica. El depósito de gotas de lípidos en el hígado, disminuye la eficacia de señalización de insulina. Además, provoca la generación de estrés oxidante que conduce a la activación del factor nuclear kB, provocando la inhibición de la fosforilación del receptor de insulina-1 [20].
Evidencia reciente sugiere que la enfermedad hepática no alcohólica es un factor de riesgo para enfermedades cardiovasculares de manera independiente a los riesgos tradicionales. Esta información implica que esta enfermedad puede estar directamente involucrada en la patogénesis de riesgo cardiovascular [21]. Se considera que el mecanismo potencial por el cual la enfermedad hepática no alcohólica incrementa el riesgo cardiovascular, se basa en el desarrollo de la inflamación de tejido adiposo visceral. Esta es la principal fuente del flujo de ácidos grasos libres hacia la vena porta provocando la acumulación de grasa hepática [22].
Adipocinas
Las citocinas presentan un papel clave en el desarrollo de la patogénesis de la enfermedad hepática no alcohólica. El tejido adiposo es un órgano metabólico antiinflamatorio que modula las señales y el metabolismo del cerebro, hígado, músculo y sistema cardiovascular [23]. La homeostasis energética es mantenida por la integración de las funciones metabólicas como la lipogénesis, la lipólisis y la oxidación de ácidos grasos, las que son mediadas por el tejido adiposo [24]. El tejido adiposo blanco se relaciona con el balance de energía y se incrementa en estados de obesidad. El desbalance en la producción de adipocinas pro y antiinflamatorias liberadas por el tejido adiposo contribuye a la patogénesis de la enfermedad hepática no alcohólica [25]. Las citocinas secretadas por adipocitos, como el factor de necrosis tumoral-α, el factor de crecimiento transformante-β y la interleucina-6, están implicados en esta enfermedad así como la leptina y la adiponectina [26], entre otros.
Leptina
Es una péptido hormona de 16 κDa sintetizada por adipocitos, y en cantidades menores por el hígado y el músculo esquelético [27]. La señalización de leptina es regulada por la tirosina cinasa citoplasmática, la fosfatidil inositol 3 kinasa y la proteína cinasa activada por adenosín monofosfato. A través de estas vías, la leptina actúa en el hipotálamo para reducir el apetito [28]. La estimulación de estas vías favorece la oxidación de ácidos grasos y disminuye la lipogénesis. La leptina reduce el depósito de grasa ectópica en músculo e hígado, actúa a nivel de páncreas inhibiendo la secreción de la insulina y de glucagon, promoviendo la homeostásis de la glucosa [29].
Aun cuando es considerada una hormona que activa la vía anoréxica, bajo ciertas condiciones se incrementa como resultado de resistencia a sus acciones en estados hipercalóricos como en la obesidad. La hiperleptinemia se asocia con la inactivación del receptor de la leptina. Esta regulación negativa se observa en el hipotálamo y en hígado de ratas obesas [30]. En modelos animales, la leptina previene la acumulación de lípidos en tejidos no adiposos. En el hígado este efecto es realizado mediante la disminución de la expresión de la proteína lipogénica, llamada proteína de unión al elemento de respuesta a esteroles [31].
En pacientes con severas lipodistrofias, los tratamientos con leptina revierten los niveles de la enfermedad hepática no alcohólica. Sin embargo, en pacientes con enfermedad hepática no alcohólica asociados con obesidad, los valores de esta hormona se incrementan y el hígado no responde a los efectos de la leptina. Esta hormona está involucrada en la progresión hacia esteatohepatitis, ya que se relaciona con el desarrollo de la resistencia a la insulina. A nivel hepático la leptina ejerce una acción proinflamatoria, así como de expresión de genes involucrados con la fibrogénesis hepática como procolágena-1 (α), factor de crecimiento transformante-β, factor de crecimiento de tejido conectivo y actina de músculo liso [32], [33].
Adiponectina
Es una hormona de 30 κDa, considerada candidata promisoria para el tratamiento de enfermedades hepáticas por sus cualidades antiinflamatorias y a su sensibilidad a la insulina. Ello, porque disminuye la producción de glucosa hepática, incrementa la utilización de la glucosa en el músculo y la oxidación de ácidos grasos en músculo e hígado. En conjunto, este proceso reduce la secreción de citocinas pro-inflamatorias como la interleucina-6, la Interleucina-8 y de la proteína quimioatrayente de monocitos-1. Los receptores de la adiponectina activan la protein quinasa activada por adenosin monofosfato (AMPK), la proteína p38 y el receptor proliferador activador de peroxisoma-α, que en turnos regulan el metabolismo de ácidos grasos [34].
Los niveles bajos de adiponectina se asocian con el estrés oxidante y la disfunción endotelial. Se han identificado cuatro grupos, también llamados Acrp30, AdipoQ, apM1 y GBP28 [35]. La adiponectina ha atraído la atención por sus efectos benéficos en disfunciones relacionadas con la obesidad. Se considera que la hipoadiponectinemia es el factor etiológico clave relacionado con la obesidad. La adiponectina se ensambla en diversas isoformas oligoméricas que incluyen trímeros, hexámeros y complejos oligoméricos. Los individuos obesos muestran una distribución diferente en las isoformas de adiponectina presentando un contenido menor de la isoforma de complejos oligoméricos [36].
El incremento en el cociente de complejos oligoméricos contra el total de adiponectina, se correlaciona con un aumento en la sensibilidad de insulina durante el tratamiento con tiazolidinedionas en pacientes con diabetes mellitus tipo 2. Se ha reportado un incremento en los niveles de la isoforma de complejos oligoméricos en pacientes que redujeron peso por restricción calórica o por cirugía bariátrica.
Existe una relación inversa entre los niveles de la alanina transaminasa y de la isoforma de complejos oligoméricos, sugiriendo que los efectos benéficos de adiponectina es mediada principalmente por esta isoforma. Además, los bajos niveles se consideran un factor etiológico importante que relaciona la obesidad con complicaciones médicas [36].
Receptor proliferador activador de peroxisomas
El elemento clave en el proceso de la lipogénesis y la lipólisis en el tejido adiposo y no adiposo es mediado a través de los receptores proliferadores activadores de peroxisomas, miembros de la súper familia de receptores nucleares esteroides/retinoides. Estos actúan en dos vías: transactivación y transrepresión [37].
Se conocen tres isoformas: receptor proliferador activador de peroxisomas α, γ, y β. El receptor proliferador activador de peroxisoma-α se expresan en hígado, riñón, corazón, músculo y tejido adiposo, mientras que el receptor proliferador activador de peroxisomas-b, se localiza en cerebro, tejido adiposo y la piel. Los receptores proliferadores activadores de peroxisomas -γ (γ-2 y γ-3) se expresan en el tejido adiposo.
El receptor proliferador activador de peroxisomas -γ presenta un papel en la sensibilidad a la insulina y adipogénesis, pues regula la expresión de genes involucrados en la beta-oxidación mitocondrial, de peroxisomas, hígado y músculo esquelético. El receptor proliferador activador de peroxisomas -γ2 es el regulador central de la adipogénesis, favoreciendo el depósito de calorías excedente en los adipocitos. La activación de receptor proliferador activador de peroxisomas -γ promueve la secreción de adipocinas antihiperglucémicas como la adiponectina [38].
Fibrosis hepática
La fibrosis hepática es la consecuencia de la formación de una cicatriz, en respuesta a un daño agudo o crónico. Durante el daño agudo, los cambios en la arquitectura hepática son transitorios y reversibles. Mientras que en el crónico, hay sustitución progresiva del parénquima por el tejido de cicatrización. Los agentes etiológicos incluyen virus, abuso de alcohol, enfermedades metabólicas, autoinmunes y coleostáticas. Histológicamente se caracteriza por un aumento en el depósito de casi diez veces de proteínas de la matriz extracelular, y una alteración en la composición de ésta [39].
La principal población fibrogénica son las células estelares hepáticas, ya que son una importante fuente de la matriz extracelular. Después de un insulto estas células sufren un fenómeno llamado transdiferenciación determinado por la expresión de α-actina, la pérdida de retinoides, la expresión de citocinas y factores de crecimiento con carácter inflamatorio (interleucina-1, factor de necrosis tumoral-α), mitogénico (factor de crecimiento derivado de plaquetas), profibrogénico (factor de crecimiento transformante-β, interleucina-6), reducción en la expresión de factores adipogénicos-lipogénicos, y la expresión de receptores de factores quimiotácticos [40],[41].
Productos finales de glicación avanzada
Son un grupo heterogéneo de moléculas producidas in vivo por glicación y oxidación. La glicación es la principal causa espontánea de daño de proteínas y de complicaciones patológicas, asociadas a diabetes mellitus tipo 2, arterosclerosis, falla renal, fibrosis hepática y esteatohepatitis [42].
La reacción de Maillard, conocida como glicación, es la ruta que más se describe en la formación de productos finales de glicación avanzada. Inicia con la formación inestable de una base de Schiff, la cual presenta un rearreglo para rendir una estructura más estable, formando productos conocidos como “productos Amadori”. Éstos poseen grupos carbonilos, que se condensan con grupos amino dando lugar a los productos finales de glicación avanzada.
El incremento en la producción de productos Amadori resulta en un daño irreversible, si no actúan los mecanismos para controlar su excesiva formación. Se ha encontrado que en estados de hiperglucemia y de resistencia a la insulina hay un incremento en los productos de Amadori, que finalmente contribuyen a la formación de productos finales de glicación avanzada [43].
Productos finales de glicación avanzada y enfermedad hepática no alcohólica
Los niveles séricos de productos finales de glicación avanzada en condiciones normales, se encuentran en concentraciones bajas debido a su constante recambio. Pueden ser detectados in vivo una vez que los niveles de azúcares se presenten elevados, como ocurre en la diabetes mellitus tipo 2 [44].
La participación de los productos finales de glicación avanzada en la fibrosis hepática es importante, debido al nivel de epidemia que ha adquirido la esteatohepatitis relacionada con la obesidad y el síndrome metabólico. Ambas condiciones se asocian al incremento de los productos finales de glicación avanzada con sus receptores.
Se ha documentado que los productos finales de glicación avanzada provocan la activación y la proliferación de las células estelares hepáticas, promoviendo la sobreexpresión de genes involucrados en la fibrogénesis hepática. Los productos finales de glicación avanzada derivados del gliceraldehído, forman parte de los productos finales de glicación avanzada conocidos como tóxicos, los cuales se encuentran elevados en pacientes con esteatohepatitis [45]. Estos activan a las células estelares hepáticas, incrementando la expresión de factor de crecimiento transformante-β y colágena-1(α). Estos datos suman información sobre la fibrogénesis hepática, planteando que los productos finales de glicación avanzada derivados del gliceraldehído presentan un importante papel en la progresión hacia esteatohepatitis [46]. En la Figura 1 se muestra la evolución de los diferentes factores que conducen hacia esteatohepatitis. Se inicia con obesidad y sobrepeso. Se presenta un aumento de adipocinas y se incrementa el flujo de ácidos grasos libres hacia el hígado, se desarrolla resistencia a la insulina, que dispara cambios metabólicos responsables para el desarrollo de esteatosis hepática. Hay un incremento en la lipoperoxidación, que favorece la glicación de proteínas para formar productos finales de glicación avanzada, uno de los factores que activan a las células estelares hepáticas, que precede el desarrollo de fibrosis hepática.
Figura 1. Evolución de la enfermedad hepática no alcohólica hacia esteatohepatitis.
No existe un procedimiento farmacológico que haya demostrado ser de utilidad para la enfermedad hepática no alcohólica. Aun cuando son muchos los tratamientos reportados, los resultados son controversiales. El diagnóstico temprano es la base del éxito en el tratamiento. Algunas de las estrategias reportadas incluyen un cambio de estilo de vida, sensibilizadores de insulina, agentes hipolipemiantes, antioxidantes y citoprotectores [47].
Intervenciones en estilo de vida
La enfermedad hepática no alcohólica está relacionada con el sobrepeso, una dieta poco saludable e inactividad física. En la progresión hacia esteatohepatitis, además de estar determinada a nivel genético, también influyen factores como la obesidad, el síndrome metabólico y la diabetes mellitus tipo 2; elementos asociados con un estilo de vida poco saludable.
Bajo esta perspectiva, la guía para el manejo de pacientes con esteatosis son las modificaciones en el estilo de vida. Diversos reportes indican que la reducción del 5% del peso corporal mejora la actividad de alanina transaminasa, mientras que una reducción del 10% disminuye la esteatosis y la necroinflamación [48].
Un estudio en pacientes con enfermedad hepática no alcohólica, por 11 semanas con una dieta de 1000 kilocalorías al día baja en carbohidratos, reportó un decremento de 7,6% de peso y disminución de la concentración intrahepática de triacilglicerol de 38%. Por otra parte, en una dieta ketogénica con una duración de 24 semanas, se encontró una disminución de uno a dos niveles en esteatosis, así como de la necroinflamación y de fibrosis hepática centrilobular. En tanto que en una dieta de 800 kilocalorías al día, basada en proteína de soya, se encontró un decremento de peso del 11% y una disminución de alanina transaminasa y aspartato transaminasa de 21% y 13% respectivamente [49].
Koch y colaboradores reportan [50] que la intervención de la dieta mediterránea durante seis semanas, reduce los niveles de grasa hepática. Aun cuando se conoce la participación de fructosa en el desarrollo de la enfermedad hepática no alcohólica, Chung y colaboradores no encontraron asociación con bebidas altas en fructosa y la enfermedad hepática no alcohólica [51]. Datos recientes indican que una dieta baja en carbohidratos resulta apropiada para pacientes con enfermedad hepática no alcohólica, ya que la ingesta rica en carbohidratos favorece la resistencia a la insulina hepática [52]. La suplementación con vitamina E disminuye de manera significativa los valores de aspartato transaminasa, alanina transaminasa y fosfatasa alcalina, así como la balonización de los hepatocitos [53].
Mantener un peso bajo sostenido como medida en el cambio de estilo de vida puede resultar difícil y los pacientes con la enfermedad hepática no alcohólica pueden evolucionar hacia esteatohepatitis. Por ello la cirugía bariátrica representa una buena alternativa en el manejo de obesidad. Esta no sólo puede implicar la pérdida de peso (del rango de 15,1 puntos del índice de masa corporal), sino que también está involucrada en la resolución de diversos factores como la normalización de la tolerancia a la insulina (lo cual puede resultar en la resolución de diabetes mellitus tipo 2), y la reducción de riesgo cardiovascular. A nivel bioquímico e histológico se ha reportado el papel benéfico de la cirugía bariátrica en pacientes con enfermedad hepática no alcohólica. En un meta-análisis realizado por Bower y colaboradores, describen que pacientes sometidos a cirugía bariátrica presentaron una disminución de 50,2% en la incidencia de esteatosis, 3,8% en los niveles de esteatohepatitis, 67,7% en la balonización de hepatocitos, así como en los valores de transaminasas [54].
Impacto de la actividad física en la enfermedad hepática no alcohólica
Con respecto a la intervención de cambio de estilo de vida que compete a la realización de actividad física, diversos estudios indican que impacta en la reducción de esteatosis hepática, puede disminuir la progresión hacia cirrosis, mejorar la sensibilidad a la insulina y la salud cardiovascular. En este sentido se ha reportado que un programa con una carga de trabajo físico mayor que 10 000 kilocalorías se refleja en el decremento de grasa intrahepática de 3,46%. Esto es una disminución significativa en los niveles de ácidos grasos libres [55] y de transaminasas [56]. Sin embargo, se carece de información precisa en cuanto a la duración exacta requerida, para tener una mejoría en pacientes con enfermedad hepática no alcohólica [57].
Metformina
La asociación que existe entre la resistencia a la insulina y la enfermedad hepática no alcohólica, hace que la resistencia a la insulina sea un blanco terapéutico lógico. En este sentido, se han empleado dos clases de fármacos, las biguanidas y las tiazolidinedionas.
La metformina es una biguanida empleada en el tratamiento de la diabetes mellitus tipo 2 por ser sensibilizador de la insulina, reduciendo así la hiperinsulinemia.
Sus principales efectos incluyen la reducción de la producción de glucosa hepática [58]. Se ha descrito que presenta resultados favorables en pacientes con enfermedad hepática no alcohólica. Los valores de aminotransferasas disminuyeron posiblemente debido la reducción de peso [59]. A nivel histológico, se reportó una mejoría en los niveles de esteatosis, necroinflamación y fibrosis hepática. En pacientes con esteatosis, el tratamiento con metformima combinada con una dieta restringida en lípidos durante seis meses, resultó en un restablecimiento en los valores de transaminasas y la sensibilidad de la insulina [60]. Sin embargo, los resultados con este fármaco son controversiales en esteatosis, incluso para esteatosis. En la Tabla 1 se recapitulan estudios al respecto.
Tabla 1. Agentes farmacológicos para el tratamiento de la enfermedad hepática no alcohólica.
Tiazolidinedionas
La pioglitazona y la rosiglitazona son empleadas en el tratamiento para la enfermedad hepática no alcohólica por su acción contra la hiperinsulinemia. Sanyal y colaboradores [71], reportaron que la pioglitazona disminuye los valores de aspartato transaminasa y alanina transaminasa. A nivel histológico, se observó una disminución de los rangos de esteatosis. Un tratamiento por 48 semanas (30 milígramos al día), mejoró los niveles bioquímicos e histológicos. Sin embargo, su uso se limita significativamente debido al incremento de peso [72]. Por otro lado, Aithal y colaboradores [73], no sólo observaron un incremento de peso sino también de fibrosis hepática.
Agonista del receptor Farsenoide X
Es un sensor de bilis que juega un papel importante en su regulación y la homeostasis de colesterol, el metabolismo y la sensibilidad de glucosa. Aguilar y colaboradores reportaron una sobreexpresión del receptor farsenoide X en pacientes con esteatohepatitis, no así en pacientes con esteatosis, sugiriendo que el receptor farsenoide X está involucrado en la progresión a esteatohepatitis [74].
Adiponectina
La adiponectina y sus agonistas representan una terapia prometedora para el tratamiento y/o prevención de disfunciones hepáticas [75]. El diseño de fármacos que incrementen la producción de esta hormona puede representar un tratamiento adecuado para la prevención de la enfermedad hepática no alcohólica [47].
Vitamina E
Es un eficaz antioxidante, su uso es reconocido como un tratamiento apropiado para pacientes con esteatohepatitis, sin que cursen por diabetes. En estos pacientes la suplementación con vitamina E disminuyó los niveles de transaminasas y de esteatohepatitis [76]. Sin embargo, resultados contrarios fueron reportados por Lavine y colaboradores [64].
Estatinas
Son inhibidores competitivos de la hidroximetil coenzima A. El uso de rosuvastatina (10 milígramos al día) normalizó el perfil de lípidos, disminuyó los valores de transaminasas y la resolución total de esteatohepatitis en cinco de seis pacientes. No obstante, la limitante de este estudio fue el reducido número de pacientes [77]. Mientras que en un estudio de 22 pacientes, el tratamiento con atorvastatina (80 milígramos al día) por seis meses, disminuyó los niveles de transaminasas junto con el perfil de lípidos [78].
La enfermedad hepática no alcohólica es el desorden hepático más común, se ha convertido en un problema creciente a nivel mundial y es considerado la manifestación hepática del síndrome metabólico. Debido a la alta incidencia y prevalencia de obesidad se considera ya una pandemia. Por lo tanto, es un problema de salud pública. Esta situación resulta alarmante para nuestro país en el presente y en los próximos años, considerando que actualmente México ocupa el primer lugar de obesidad infantil y el segundo en adultos en el mundo.
A pesar de los avances que se han realizado en torno a la la enfermedad hepática no alcohólica, aún quedan puntos importantes por resolver como investigaciones en el desarrollo de marcadores tempranos de la enfermedad. Urgen también investigaciones a nivel molecular, bioquímico y genético que permitan establecer estrategias terapéuticas adecuadas. Como se ha visto, el tratamiento en torno a la enfermedad hepática no alcohólica resulta controversial. Desde nuestro punto de vista, la intervención y los cambios de estilo de vida son fundamentales para hacer frente a la obesidad, el síndrome metabólico y la diabetes mellitus tipo 2.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.

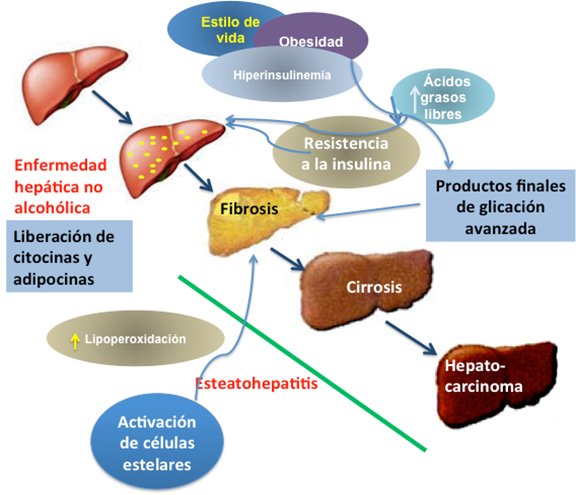 Figura 1. Evolución de la enfermedad hepática no alcohólica hacia esteatohepatitis.
Figura 1. Evolución de la enfermedad hepática no alcohólica hacia esteatohepatitis.

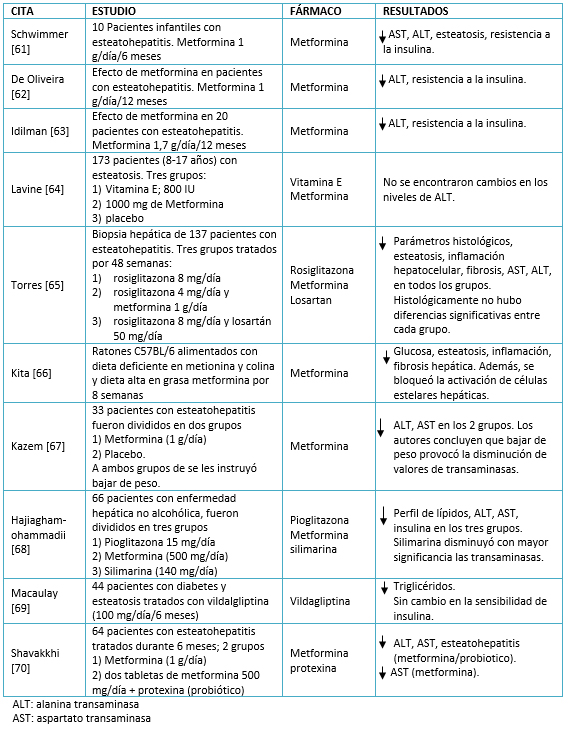 Tabla 1. Agentes farmacológicos para el tratamiento de la enfermedad hepática no alcohólica.
Tabla 1. Agentes farmacológicos para el tratamiento de la enfermedad hepática no alcohólica.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Non-alcoholic fatty liver disease refers to a disease spectrum that ranges from steatosis to non-alcoholic steatohepatitis, which leads to fibrosis, cirrhosis and hepatocellular carcinoma. Given the increasing prevalence of obesity worldwide, the incidence of non-alcoholic fatty liver disease has become a world health problem. Non-alcoholic fatty liver disease is considered to be the hepatic manifestation of metabolic syndrome associated with insulin resistance, central obesity, and type 2 diabetes mellitus. Allegedly, insulin resistance plays a pivotal role in its pathogenesis. Here we highlight non-alcoholic fatty liver disease epidemiology and pathophysiology, its progression towards steatohepatitis with particular emphasis in liver fibrosis and participation of advanced glycation end products. The different treatments reported are described here as well. We conducted a search in PubMed with the terms steatohepatitis, steatosis advanced glycation end products, liver fibrosis and adipocytokines. Articles were selected according to their relevance.
 Autores:
Elizabeth Hernández-Pérez[1,2], Plácido Enrique León García[2], Norma Edith López-Díazguerrero[1], Fernando Rivera-Cabrera[1], Elizabeth del Ángel Benítez[1]
Autores:
Elizabeth Hernández-Pérez[1,2], Plácido Enrique León García[2], Norma Edith López-Díazguerrero[1], Fernando Rivera-Cabrera[1], Elizabeth del Ángel Benítez[1]

Citación: Hernández-Pérez E, León García PE, López-Díazguerrero NE, Rivera-Cabrera F, del Ángel Benítez E. Liver steatosis and nonalcoholic steatohepatitis: from pathogenesis to therapy. Medwave 2016 Sep;16(8):e6535 doi: 10.5867/medwave.2016.08.6535
Fecha de envío: 18/5/2016
Fecha de aceptación: 22/8/2016
Fecha de publicación: 13/9/2016
Origen: no solicitado
Tipo de revisión: con revisión por tres pares revisores externos, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Angulo P, Lindor KD. Non-alcoholic fatty liver disease. J Gastroenterol Hepatol. 2002 Feb;17 Suppl:S186-90. | PubMed |
Angulo P, Lindor KD. Non-alcoholic fatty liver disease. J Gastroenterol Hepatol. 2002 Feb;17 Suppl:S186-90. | PubMed | Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc. 1980 Jul;55(7):434-8. | PubMed |
Ludwig J, Viggiano TR, McGill DB, Oh BJ. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc. 1980 Jul;55(7):434-8. | PubMed | Krawczyk M, Bonfrate L, Portincasa P. Nonalcoholic fatty liver disease. Best Pract Res Clin Gastroenterol. 2010 Oct;24(5):695-708. | CrossRef | PubMed |
Krawczyk M, Bonfrate L, Portincasa P. Nonalcoholic fatty liver disease. Best Pract Res Clin Gastroenterol. 2010 Oct;24(5):695-708. | CrossRef | PubMed | Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther. 2011 Aug;34(3):274-85. | CrossRef | PubMed |
Vernon G, Baranova A, Younossi ZM. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults. Aliment Pharmacol Ther. 2011 Aug;34(3):274-85. | CrossRef | PubMed | Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, Grundy SM, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004 Dec;40(6):1387-95. | PubMed |
Browning JD, Szczepaniak LS, Dobbins R, Nuremberg P, Horton JD, Cohen JC, Grundy SM, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity. Hepatology. 2004 Dec;40(6):1387-95. | PubMed | Anderson E, Howe L, Jones H, Higgins J, Lawlor D, Frasse A. the prevalence of non-alcoholic. fatty liver disease in children and adolescent: a systematic review and meta-analysis, Plos one. 2015 oct;10(10) | CrossRef |
Anderson E, Howe L, Jones H, Higgins J, Lawlor D, Frasse A. the prevalence of non-alcoholic. fatty liver disease in children and adolescent: a systematic review and meta-analysis, Plos one. 2015 oct;10(10) | CrossRef | Wolpert E, Kershenobich D. Esteatosis y esteatohepatitis no alcoholica. facmed.unam.mx [on line]. | Link |
Wolpert E, Kershenobich D. Esteatosis y esteatohepatitis no alcoholica. facmed.unam.mx [on line]. | Link | López-Velázquez JA, Silva-Vidal KV, Ponciano-Rodríguez G, Chávez-Tapia NC, Arrese M, Uribe M, et al. The prevalence of nonalcoholic fatty liver disease in the Americas. Ann Hepatol. 2014 Mar-Apr;13(2):166-78. | PubMed |
López-Velázquez JA, Silva-Vidal KV, Ponciano-Rodríguez G, Chávez-Tapia NC, Arrese M, Uribe M, et al. The prevalence of nonalcoholic fatty liver disease in the Americas. Ann Hepatol. 2014 Mar-Apr;13(2):166-78. | PubMed | Sherif ZA, Saeed A, Ghavimi S, Nouraie SM, Laiyemo AO, Brim H, et al. Global Epidemiology of Nonalcoholic Fatty Liver Disease and Perspectives on US Minority Populations. Dig Dis Sci. 2016 May;61(5):1214-25. | CrossRef | PubMed |
Sherif ZA, Saeed A, Ghavimi S, Nouraie SM, Laiyemo AO, Brim H, et al. Global Epidemiology of Nonalcoholic Fatty Liver Disease and Perspectives on US Minority Populations. Dig Dis Sci. 2016 May;61(5):1214-25. | CrossRef | PubMed | Basaranoglu M,Ormeci N. Nonalcoholic fatty liver disease diagnosis, pathogenesis and management. Turk J Gastroenterol. 2014 Apr;25:127-32. | CrossRef | PubMed |
Basaranoglu M,Ormeci N. Nonalcoholic fatty liver disease diagnosis, pathogenesis and management. Turk J Gastroenterol. 2014 Apr;25:127-32. | CrossRef | PubMed | Szczepaniak LS, Nurenberg P, Leonard D, Browning JD, Reingold JS, Grundy S, et al. Magnetic resonance spectroscopy to measure hepatic triglyceride content: prevalence of hepatic steatosis in the general population. Am J Physiol Endocrinol Metab. 2005 Feb;28 (2):E462-8. | PubMed |
Szczepaniak LS, Nurenberg P, Leonard D, Browning JD, Reingold JS, Grundy S, et al. Magnetic resonance spectroscopy to measure hepatic triglyceride content: prevalence of hepatic steatosis in the general population. Am J Physiol Endocrinol Metab. 2005 Feb;28 (2):E462-8. | PubMed | Marchesini G, Bugianesi E, Forlani G, Cerrelli F, Lenzi M, Manini R, et al. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome. Hepatology. 2003 Apr;37(4):917-23. | PubMed |
Marchesini G, Bugianesi E, Forlani G, Cerrelli F, Lenzi M, Manini R, et al. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome. Hepatology. 2003 Apr;37(4):917-23. | PubMed | Yatsuji S, Hashimoto E, Tobari M, Taniai M, Tokushige K, Shiratori K. Clinical features and outcomes of cirrhosis due to non-alcoholic steatohepatitis compared with cirrhosis caused by chronic hepatitis C. J Gastroenterol Hepatol. 2009 Feb;24(2):248-54. | CrossRef | PubMed |
Yatsuji S, Hashimoto E, Tobari M, Taniai M, Tokushige K, Shiratori K. Clinical features and outcomes of cirrhosis due to non-alcoholic steatohepatitis compared with cirrhosis caused by chronic hepatitis C. J Gastroenterol Hepatol. 2009 Feb;24(2):248-54. | CrossRef | PubMed | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998 Apr;114(4):842-5. | PubMed |
Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998 Apr;114(4):842-5. | PubMed | Tilg H, Moschen AR. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis. Hepatology. 2010 Nov;52(5):1836-46. | CrossRef | PubMed |
Tilg H, Moschen AR. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis. Hepatology. 2010 Nov;52(5):1836-46. | CrossRef | PubMed | Marra F, Gastaldelli A, Svegliati Baroni G, Tell G, Tiribelli C. Molecular basis and mechanisms of progression of non-alcoholic steatohepatitis. Trends Mol Med. 2008 Feb;14(2):72-81. | CrossRef | PubMed |
Marra F, Gastaldelli A, Svegliati Baroni G, Tell G, Tiribelli C. Molecular basis and mechanisms of progression of non-alcoholic steatohepatitis. Trends Mol Med. 2008 Feb;14(2):72-81. | CrossRef | PubMed | Utzschneider KM, Kahn SE. Review: The role of insulin resistance in nonalcoholic fatty liver disease. J Clin Endocrinol Metab. 2006 Dec;91(12):4753-61. | PubMed |
Utzschneider KM, Kahn SE. Review: The role of insulin resistance in nonalcoholic fatty liver disease. J Clin Endocrinol Metab. 2006 Dec;91(12):4753-61. | PubMed | Samuel VT, Liu ZX, Qu X, Elder BD, Bilz S, Befroy D, et al. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease. J Biol Chem. 2004 Jul 30;279(31):32345-53. | PubMed |
Samuel VT, Liu ZX, Qu X, Elder BD, Bilz S, Befroy D, et al. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease. J Biol Chem. 2004 Jul 30;279(31):32345-53. | PubMed | Gaudio E, Nobili V, Franchitto A, Onori P, Carpino G. Nonalcoholic fatty liver disease and atherosclerosis. Intern Emerg Med. 2012 Oct;7 Suppl 3:S297-305. | CrossRef | PubMed |
Gaudio E, Nobili V, Franchitto A, Onori P, Carpino G. Nonalcoholic fatty liver disease and atherosclerosis. Intern Emerg Med. 2012 Oct;7 Suppl 3:S297-305. | CrossRef | PubMed | Byrne CD, Targher G. Ectopic fat, insulin resistance, and nonalcoholic fatty liver disease: implications for cardiovascular disease. Arterioscler Thromb Vasc Biol. 2014 Jun;34(6):1155-61. | CrossRef | PubMed |
Byrne CD, Targher G. Ectopic fat, insulin resistance, and nonalcoholic fatty liver disease: implications for cardiovascular disease. Arterioscler Thromb Vasc Biol. 2014 Jun;34(6):1155-61. | CrossRef | PubMed | Yoo HJ, Choi KM. Hepatokines as a Link between Obesity and Cardiovascular Diseases. Diabetes Metab J. 2015 Feb;39(1):10-5. | CrossRef | PubMed |
Yoo HJ, Choi KM. Hepatokines as a Link between Obesity and Cardiovascular Diseases. Diabetes Metab J. 2015 Feb;39(1):10-5. | CrossRef | PubMed | Björntorp P. "Portal" adipose tissue as a generator of risk factors for cardiovascular disease and diabetes. Arteriosclerosis. 1990 Jul-Aug;10(4):493-6.
| PubMed |
Björntorp P. "Portal" adipose tissue as a generator of risk factors for cardiovascular disease and diabetes. Arteriosclerosis. 1990 Jul-Aug;10(4):493-6.
| PubMed | Petersen KF, Dufour S, Befroy D, Lehrke M, Hendler RE, Shulman GI. Reversal of nonalcoholic hepatic steatosis, hepatic insulin resistance, and hyperglycemia by moderate weight reduction in patients with type 2 diabetes. Diabetes. 2005 Mar;54(3):603-8. | PubMed |
Petersen KF, Dufour S, Befroy D, Lehrke M, Hendler RE, Shulman GI. Reversal of nonalcoholic hepatic steatosis, hepatic insulin resistance, and hyperglycemia by moderate weight reduction in patients with type 2 diabetes. Diabetes. 2005 Mar;54(3):603-8. | PubMed | Matsuzawa Y. Adiponectin: a key player in obesity related disorders. Curr Pharm Des. 2010 Jun;16(17):1896-901. | PubMed |
Matsuzawa Y. Adiponectin: a key player in obesity related disorders. Curr Pharm Des. 2010 Jun;16(17):1896-901. | PubMed | Mirza MS. Obesity, Visceral Fat, and NAFLD: Querying the Role of Adipokines in the Progression of Nonalcoholic Fatty Liver Disease. ISRN Gastroenterol. 2011;2011:592404. | CrossRef | PubMed |
Mirza MS. Obesity, Visceral Fat, and NAFLD: Querying the Role of Adipokines in the Progression of Nonalcoholic Fatty Liver Disease. ISRN Gastroenterol. 2011;2011:592404. | CrossRef | PubMed | Tarantino G, Savastano S, Colao A. Hepatic steatosis, low-grade chronic inflammation and hormone/growth factor/adipokine imbalance. World J Gastroenterol. 2010 Oct 14;16(38):4773-83. | PubMed |
Tarantino G, Savastano S, Colao A. Hepatic steatosis, low-grade chronic inflammation and hormone/growth factor/adipokine imbalance. World J Gastroenterol. 2010 Oct 14;16(38):4773-83. | PubMed | Giby VG, Ajith TA. Role of adipokines and peroxisome proliferator-activated receptors in nonalcoholic fatty liver disease. World J Hepatol. 2014 Aug 27;6(8):570-9. | CrossRef | PubMed |
Giby VG, Ajith TA. Role of adipokines and peroxisome proliferator-activated receptors in nonalcoholic fatty liver disease. World J Hepatol. 2014 Aug 27;6(8):570-9. | CrossRef | PubMed | Wauman J, Tavernier J. Leptin receptor signaling: pathways to leptin resistance. Front Biosci (Landmark Ed). 2011 Jun 1;16:2771-93. | PubMed |
Wauman J, Tavernier J. Leptin receptor signaling: pathways to leptin resistance. Front Biosci (Landmark Ed). 2011 Jun 1;16:2771-93. | PubMed | Denver RJ, Bonett RM, Boorse GC. Evolution of leptin structure and function. Neuroendocrinology. 2011;94(1):21-38. | CrossRef | PubMed |
Denver RJ, Bonett RM, Boorse GC. Evolution of leptin structure and function. Neuroendocrinology. 2011;94(1):21-38. | CrossRef | PubMed | Marroquí L, Vieira E, Gonzalez A, Nadal A, Quesada I. Leptin downregulates expression of the gene encoding glucagon in alphaTC1-9 cells and mouse islets. Diabetologia. 2011 Apr;54(4):843-51. | CrossRef | PubMed |
Marroquí L, Vieira E, Gonzalez A, Nadal A, Quesada I. Leptin downregulates expression of the gene encoding glucagon in alphaTC1-9 cells and mouse islets. Diabetologia. 2011 Apr;54(4):843-51. | CrossRef | PubMed | Fuentes T, Ara I, Guadalupe-Grau A, Larsen S, Stallknecht B, Olmedillas H, et al. Leptin receptor 170 kDa (OB-R170) protein expression is reduced in obese human skeletal muscle: a potential mechanism of leptin resistance. Exp Physiol. 2010 Jan;95(1):160-71. | CrossRef | PubMed |
Fuentes T, Ara I, Guadalupe-Grau A, Larsen S, Stallknecht B, Olmedillas H, et al. Leptin receptor 170 kDa (OB-R170) protein expression is reduced in obese human skeletal muscle: a potential mechanism of leptin resistance. Exp Physiol. 2010 Jan;95(1):160-71. | CrossRef | PubMed | Fiorenza CG, Chou SH, Mantzoros CS. Lipodystrophy: pathophysiology and advances in treatment. Nat Rev Endocrinol. 2011 Mar;7(3):137-50. | CrossRef | PubMed |
Fiorenza CG, Chou SH, Mantzoros CS. Lipodystrophy: pathophysiology and advances in treatment. Nat Rev Endocrinol. 2011 Mar;7(3):137-50. | CrossRef | PubMed | Kukla M, Mazur W, Bułdak RJ, Zwirska-Korczala K. Potential role of leptin, adiponectin and three novel adipokines--visfatin, chemerin and vaspin--in chronic hepatitis. Mol Med. 2011;17(11-12):1397-410. | CrossRef | PubMed |
Kukla M, Mazur W, Bułdak RJ, Zwirska-Korczala K. Potential role of leptin, adiponectin and three novel adipokines--visfatin, chemerin and vaspin--in chronic hepatitis. Mol Med. 2011;17(11-12):1397-410. | CrossRef | PubMed | Tarantino G, Finelli C, Colao A, Capone D, Tarantino M, Grimaldi E, et al. Are hepatic steatosis and carotid intima media thickness associated in obese patients with normal or slightly elevated gamma-glutamyl-transferase? J Transl Med. 2012 Mar 16;10:50. | CrossRef | PubMed |
Tarantino G, Finelli C, Colao A, Capone D, Tarantino M, Grimaldi E, et al. Are hepatic steatosis and carotid intima media thickness associated in obese patients with normal or slightly elevated gamma-glutamyl-transferase? J Transl Med. 2012 Mar 16;10:50. | CrossRef | PubMed | Yoon MJ, Lee GY, Chung JJ, Ahn YH, Hong SH, Kim JB. Adiponectin increases fatty acid oxidation in skeletal muscle cells by sequential activation of AMP-activated protein kinase, p38 mitogen-activated protein kinase, and peroxisome proliferator-activated receptor alpha. Diabetes. 2006 Sep;55(9):2562-70. | PubMed |
Yoon MJ, Lee GY, Chung JJ, Ahn YH, Hong SH, Kim JB. Adiponectin increases fatty acid oxidation in skeletal muscle cells by sequential activation of AMP-activated protein kinase, p38 mitogen-activated protein kinase, and peroxisome proliferator-activated receptor alpha. Diabetes. 2006 Sep;55(9):2562-70. | PubMed | Bracale R, Labruna G, Finelli C, Daniele A, Sacchetti L, Oriani G, et al. The absence of polymorphisms in ADRB3, UCP1, PPARγ, and ADIPOQ genes protects morbid obese patients toward insulin resistance. J Endocrinol Invest. 2012 Jan;35(1):2-4. | PubMed |
Bracale R, Labruna G, Finelli C, Daniele A, Sacchetti L, Oriani G, et al. The absence of polymorphisms in ADRB3, UCP1, PPARγ, and ADIPOQ genes protects morbid obese patients toward insulin resistance. J Endocrinol Invest. 2012 Jan;35(1):2-4. | PubMed | Simpson F, Whitehead JP. Adiponectin--it's all about the modifications. Int J Biochem Cell Biol. 2010 Jun;42(6):785-8. | CrossRef | PubMed |
Simpson F, Whitehead JP. Adiponectin--it's all about the modifications. Int J Biochem Cell Biol. 2010 Jun;42(6):785-8. | CrossRef | PubMed | Gervois P, Fruchart JC, Staels B. Drug Insight: mechanisms of action and therapeutic applications for agonists of peroxisome proliferator-activated receptors. Nat Clin Pract Endocrinol Metab. 2007 Feb;3(2):145-56. | PubMed |
Gervois P, Fruchart JC, Staels B. Drug Insight: mechanisms of action and therapeutic applications for agonists of peroxisome proliferator-activated receptors. Nat Clin Pract Endocrinol Metab. 2007 Feb;3(2):145-56. | PubMed | Gressner OA, Gao C. Monitoring fibrogenic progression in the liver. Clin Chim Acta. 2014 Jun 10;433:111-22. | CrossRef | PubMed |
Gressner OA, Gao C. Monitoring fibrogenic progression in the liver. Clin Chim Acta. 2014 Jun 10;433:111-22. | CrossRef | PubMed | Hernández E, Bucio L, Souza V, Escobar MC, Gómez-Quiroz LE, Farfán B, et al. Pentoxifylline downregulates alpha (I) collagen expression by the inhibition of Ikappabalpha degradation in liver stellate cells. Cell Biol Toxicol. 2008 Aug;24(4):303-14. | PubMed |
Hernández E, Bucio L, Souza V, Escobar MC, Gómez-Quiroz LE, Farfán B, et al. Pentoxifylline downregulates alpha (I) collagen expression by the inhibition of Ikappabalpha degradation in liver stellate cells. Cell Biol Toxicol. 2008 Aug;24(4):303-14. | PubMed | Gaens KH, Niessen PM, Rensen SS, Buurman WA, Greve JW, Driessen A, et al. Endogenous formation of Nε-(carboxymethyl)lysine is increased in fatty livers and induces inflammatory markers in an in vitro model of hepatic steatosis. J Hepatol. 2012 Mar;56(3):647-55. | CrossRef | PubMed |
Gaens KH, Niessen PM, Rensen SS, Buurman WA, Greve JW, Driessen A, et al. Endogenous formation of Nε-(carboxymethyl)lysine is increased in fatty livers and induces inflammatory markers in an in vitro model of hepatic steatosis. J Hepatol. 2012 Mar;56(3):647-55. | CrossRef | PubMed | Piarulli F, Sartore G, Lapolla A. Glyco-oxidation and cardiovascular complications in type 2 diabetes: a clinical update. Acta Diabetol. 2013 Apr;50(2):101-10. | CrossRef | PubMed |
Piarulli F, Sartore G, Lapolla A. Glyco-oxidation and cardiovascular complications in type 2 diabetes: a clinical update. Acta Diabetol. 2013 Apr;50(2):101-10. | CrossRef | PubMed | Lohwasser C, Neureiter D, Popov Y, Bauer M, Schuppan D. Role of the receptor for advanced glycation end products in hepatic fibrosis. World J Gastroenterol. 2009 Dec 14;15(46):5789-98.
| PubMed |
Lohwasser C, Neureiter D, Popov Y, Bauer M, Schuppan D. Role of the receptor for advanced glycation end products in hepatic fibrosis. World J Gastroenterol. 2009 Dec 14;15(46):5789-98.
| PubMed | Takeuchi M, Takino J, Sakasai-Sakai A, Takata T, Ueda T, Tsutsumi T, et al. Involvement of the TAGE:RAGE system in non-alcoholic steatohepatitis: novel treatment strategies. World J Hepatol. 2014 Dec 27;6(12):880-93. | CrossRef | PubMed |
Takeuchi M, Takino J, Sakasai-Sakai A, Takata T, Ueda T, Tsutsumi T, et al. Involvement of the TAGE:RAGE system in non-alcoholic steatohepatitis: novel treatment strategies. World J Hepatol. 2014 Dec 27;6(12):880-93. | CrossRef | PubMed | Iwamoto K, Kanno K, Hyogo H, Yamagishi S, Takeuchi M, Tazuma S, et al. Advanced glycation end products enhance the proliferation and activation of hepatic stellate cells. J Gastroenterol. 2008;43(4):298-304. | CrossRef | PubMed |
Iwamoto K, Kanno K, Hyogo H, Yamagishi S, Takeuchi M, Tazuma S, et al. Advanced glycation end products enhance the proliferation and activation of hepatic stellate cells. J Gastroenterol. 2008;43(4):298-304. | CrossRef | PubMed | Finelli C, Tarantino G. What is the role of adiponectin in obesity related non-alcoholic fatty liver disease? World J Gastroenterol. 2013 Feb 14;19(6):802-12. | CrossRef | PubMed |
Finelli C, Tarantino G. What is the role of adiponectin in obesity related non-alcoholic fatty liver disease? World J Gastroenterol. 2013 Feb 14;19(6):802-12. | CrossRef | PubMed | Promrat K, Kleiner DE, Niemeier HM, Jackvony E, Kearns M, Wands JR, et al. Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis. Hepatology. 2010 Jan;51(1):121-9. | CrossRef | PubMed |
Promrat K, Kleiner DE, Niemeier HM, Jackvony E, Kearns M, Wands JR, et al. Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis. Hepatology. 2010 Jan;51(1):121-9. | CrossRef | PubMed | Thoma C, Day CP, Trenell MI. Lifestyle interventions for the treatment of non-alcoholic fatty liver disease in adults: a systematic review. J Hepatol. 2012 Jan;56(1):255-66. | CrossRef | PubMed |
Thoma C, Day CP, Trenell MI. Lifestyle interventions for the treatment of non-alcoholic fatty liver disease in adults: a systematic review. J Hepatol. 2012 Jan;56(1):255-66. | CrossRef | PubMed | Koch M, Nöthlings U, Lieb W. Dietary patterns and fatty liver disease. Curr Opin Lipidol. 2015 Feb;26(1):35-41. | CrossRef | PubMed |
Koch M, Nöthlings U, Lieb W. Dietary patterns and fatty liver disease. Curr Opin Lipidol. 2015 Feb;26(1):35-41. | CrossRef | PubMed | Chung M, Ma J, Patel K, Berger S, Lau J, Lichtenstein AH. Fructose, high-fructose corn syrup, sucrose, and nonalcoholic fatty liver disease or indexes of liver health: a systematic review and meta-analysis. Am J Clin Nutr.2014 Sep;100(3):833-49. | CrossRef | PubMed |
Chung M, Ma J, Patel K, Berger S, Lau J, Lichtenstein AH. Fructose, high-fructose corn syrup, sucrose, and nonalcoholic fatty liver disease or indexes of liver health: a systematic review and meta-analysis. Am J Clin Nutr.2014 Sep;100(3):833-49. | CrossRef | PubMed | Hashemi Kani A, Alavian SM, Haghighatdoost F, Azadbakht L. Diet macronutrients composition in nonalcoholic Fatty liver disease: a review on the related documents. Hepat Mon. 2014 Feb 17;14(2):e10939. | CrossRef | PubMed |
Hashemi Kani A, Alavian SM, Haghighatdoost F, Azadbakht L. Diet macronutrients composition in nonalcoholic Fatty liver disease: a review on the related documents. Hepat Mon. 2014 Feb 17;14(2):e10939. | CrossRef | PubMed | Sato K, Gosho M, Yamamoto T, Kobayashi Y, Ishii N, Ohashi T, et al. Vitamin E has a beneficial effect on nonalcoholic fatty liver disease: a meta-analysis of randomized controlled trials. Nutrition. 2015 Jul-Aug;31(7-8):923-30. | CrossRef | PubMed |
Sato K, Gosho M, Yamamoto T, Kobayashi Y, Ishii N, Ohashi T, et al. Vitamin E has a beneficial effect on nonalcoholic fatty liver disease: a meta-analysis of randomized controlled trials. Nutrition. 2015 Jul-Aug;31(7-8):923-30. | CrossRef | PubMed | Bower G, Toma T, Harling L, Jiao LR, Efthimiou E, Darzi A, et al. Bariatric Surgery and Non-Alcoholic Fatty Liver Disease: a Systematic Review of Liver Biochemistry and Histology. Obes Surg. 2015 Dec;25(12):2280-9. | CrossRef | PubMed |
Bower G, Toma T, Harling L, Jiao LR, Efthimiou E, Darzi A, et al. Bariatric Surgery and Non-Alcoholic Fatty Liver Disease: a Systematic Review of Liver Biochemistry and Histology. Obes Surg. 2015 Dec;25(12):2280-9. | CrossRef | PubMed | Smart NA, King N, McFarlane JR, Graham PL, Dieberg G. Effect of exercise training on liver function in adults who are overweight or exhibit fatty liver disease: a systematic review and meta-analysis. Br J Sports Med. 2016 Jun 17. pii: bjsports-2016-096197. | CrossRef | PubMed |
Smart NA, King N, McFarlane JR, Graham PL, Dieberg G. Effect of exercise training on liver function in adults who are overweight or exhibit fatty liver disease: a systematic review and meta-analysis. Br J Sports Med. 2016 Jun 17. pii: bjsports-2016-096197. | CrossRef | PubMed | Orci LA, Gariani K, Oldani G, Delaune V, Morel P, Toso C. Exercise-based Interventions for Nonalcoholic Fatty Liver Disease: A Meta-analysis and Meta-regression. Clin Gastroenterol Hepatol. 2016 May 4. pii: S1542-3565(16)30149-5. | CrossRef | PubMed |
Orci LA, Gariani K, Oldani G, Delaune V, Morel P, Toso C. Exercise-based Interventions for Nonalcoholic Fatty Liver Disease: A Meta-analysis and Meta-regression. Clin Gastroenterol Hepatol. 2016 May 4. pii: S1542-3565(16)30149-5. | CrossRef | PubMed | Whitsett M, VanWagner L. Physical activity as a treatment of non-alcoholic fatty liver disease: A systematic review. World J Hepatol. 2015 Aug 8;7(16):2041-52. | CrossRef | PubMed |
Whitsett M, VanWagner L. Physical activity as a treatment of non-alcoholic fatty liver disease: A systematic review. World J Hepatol. 2015 Aug 8;7(16):2041-52. | CrossRef | PubMed | Kirpichnikov D, McFarlane SI, Sowers J. Metformin: an update. Ann Intern Med. 2002 Jul;137(1):25. | PubMed |
Kirpichnikov D, McFarlane SI, Sowers J. Metformin: an update. Ann Intern Med. 2002 Jul;137(1):25. | PubMed | Angelico F, Burattin M, Alessandri C, Del Ben M, Lirussi F. Drugs improving insulin resistance for non-alcoholic fatty liver disease and/or non-alcoholic steatohepatitis. Cochrane Database Syst Rev. 2007 Jan 24;(1):CD005166.
| PubMed |
Angelico F, Burattin M, Alessandri C, Del Ben M, Lirussi F. Drugs improving insulin resistance for non-alcoholic fatty liver disease and/or non-alcoholic steatohepatitis. Cochrane Database Syst Rev. 2007 Jan 24;(1):CD005166.
| PubMed | Bugianesi E, Gentilcore E, Manini R, Natale S, Vanni E, Villanova N, et al. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol. 2005 May;100(5):1082-90. | PubMed |
Bugianesi E, Gentilcore E, Manini R, Natale S, Vanni E, Villanova N, et al. A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol. 2005 May;100(5):1082-90. | PubMed | Schwimmer JB, Behling C, Newbury R, Deutsch R, Nievergelt C, Schork NJ, et al. Histopathology of pediatric nonalcoholic fatty liver disease. Hepatology. 2005 Sep;42(3):641-9. | PubMed |
Schwimmer JB, Behling C, Newbury R, Deutsch R, Nievergelt C, Schork NJ, et al. Histopathology of pediatric nonalcoholic fatty liver disease. Hepatology. 2005 Sep;42(3):641-9. | PubMed | de Oliveira CP, Stefano JT, de Siqueira ER, Silva LS, de Campos Mazo DF, Lima VM, et al. Combination of N-acetylcysteine and metformin improves histological steatosis and fibrosis in patients with non-alcoholic steatohepatitis. Hepatol Res. 2008;38(2):159-65.
| CrossRef | PubMed |
de Oliveira CP, Stefano JT, de Siqueira ER, Silva LS, de Campos Mazo DF, Lima VM, et al. Combination of N-acetylcysteine and metformin improves histological steatosis and fibrosis in patients with non-alcoholic steatohepatitis. Hepatol Res. 2008;38(2):159-65.
| CrossRef | PubMed | Idilman R, Mizrak D, Corapcioglu D, Bektas M, Doganay B, Sayki M, et al. Clinical trial: insulin-sensitizing agents may reduce consequences of insulin resistance in individuals with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2008 Jul;28(2):200-8. | CrossRef | PubMed |
Idilman R, Mizrak D, Corapcioglu D, Bektas M, Doganay B, Sayki M, et al. Clinical trial: insulin-sensitizing agents may reduce consequences of insulin resistance in individuals with non-alcoholic steatohepatitis. Aliment Pharmacol Ther. 2008 Jul;28(2):200-8. | CrossRef | PubMed | Lavine JE, Schwimmer JB, Van Natta ML, Molleston JP, Murray KF, Rosenthal P. et al. Effect of vitamin E or metformin for treatment of nonalcoholic fatty liver disease in children and adolescents: the TONIC randomized controlled trial. JAMA. 2011;305(16):1659-68. | CrossRef | PubMed |
Lavine JE, Schwimmer JB, Van Natta ML, Molleston JP, Murray KF, Rosenthal P. et al. Effect of vitamin E or metformin for treatment of nonalcoholic fatty liver disease in children and adolescents: the TONIC randomized controlled trial. JAMA. 2011;305(16):1659-68. | CrossRef | PubMed | Torres DM, Jones FJ, Shaw JC, Williams CD, Ward JA, Harrison SA. Rosiglitazone versus rosiglitazone and metformin versus rosiglitazone and losartan in the treatment of nonalcoholic steatohepatitis in humans: a 12-month randomized, prospective, open- label trial. Hepatology. 2011 Nov;54(5):1631-9. | CrossRef | PubMed |
Torres DM, Jones FJ, Shaw JC, Williams CD, Ward JA, Harrison SA. Rosiglitazone versus rosiglitazone and metformin versus rosiglitazone and losartan in the treatment of nonalcoholic steatohepatitis in humans: a 12-month randomized, prospective, open- label trial. Hepatology. 2011 Nov;54(5):1631-9. | CrossRef | PubMed | Kita Y, Takamura T, Misu H, Ota T, Kurita S, Takeshita Y, et al. Metformin prevents and reverses inflammation in a non-diabetic mouse model of nonalcoholic steatohepatitis. PLoS One. 2012;7(9):e43056. | CrossRef | PubMed |
Kita Y, Takamura T, Misu H, Ota T, Kurita S, Takeshita Y, et al. Metformin prevents and reverses inflammation in a non-diabetic mouse model of nonalcoholic steatohepatitis. PLoS One. 2012;7(9):e43056. | CrossRef | PubMed | Kazemi R, Aduli M, Sotoudeh M, Malekzadeh R, Seddighi N, Sepanlou SG, et al. Metformin in nonalcoholic steatohepatitis: a randomized controlled trial. Middle East J Dig Dis. 2012 Jan;4(1):16-22. | PubMed |
Kazemi R, Aduli M, Sotoudeh M, Malekzadeh R, Seddighi N, Sepanlou SG, et al. Metformin in nonalcoholic steatohepatitis: a randomized controlled trial. Middle East J Dig Dis. 2012 Jan;4(1):16-22. | PubMed | Hajiaghamohammadi AA, Ziaee A, Oveisi S, Masroor H. Effects of metformin, pioglitazone, and silymarin treatment on non-alcoholic Fatty liver disease: a randomized controlled pilot study. Hepat Mon. 2012 Aug;12(8):e6099. | CrossRef | PubMed |
Hajiaghamohammadi AA, Ziaee A, Oveisi S, Masroor H. Effects of metformin, pioglitazone, and silymarin treatment on non-alcoholic Fatty liver disease: a randomized controlled pilot study. Hepat Mon. 2012 Aug;12(8):e6099. | CrossRef | PubMed | Macauley M, Hollingsworth KG, Smith FE, Thelwall PE, Al-Mrabeh A, Schweizer A, et al. Effect of vildagliptin on hepatic steatosis. J Clin Endocrinol Metab. 2015 Apr;100(4):1578-85. | CrossRef | PubMed |
Macauley M, Hollingsworth KG, Smith FE, Thelwall PE, Al-Mrabeh A, Schweizer A, et al. Effect of vildagliptin on hepatic steatosis. J Clin Endocrinol Metab. 2015 Apr;100(4):1578-85. | CrossRef | PubMed | Shavakhi A, Minakari M, Firouzian H, Assali R, Hekmatdoost A, Ferns G. Effect of a Probiotic and Metformin on Liver Aminotransferases in Non-alcoholic Steatohepatitis: A Double Blind Randomized Clinical Trial. Int J Prev Med. 2013 May;4(5):531-7. | PubMed |
Shavakhi A, Minakari M, Firouzian H, Assali R, Hekmatdoost A, Ferns G. Effect of a Probiotic and Metformin on Liver Aminotransferases in Non-alcoholic Steatohepatitis: A Double Blind Randomized Clinical Trial. Int J Prev Med. 2013 May;4(5):531-7. | PubMed | Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010 May 6;362(18):1675-85. | CrossRef | PubMed |
Sanyal AJ, Chalasani N, Kowdley KV, McCullough A, Diehl AM, Bass NM, et al. Pioglitazone, vitamin E, or placebo for nonalcoholic steatohepatitis. N Engl J Med. 2010 May 6;362(18):1675-85. | CrossRef | PubMed | Lutchman G, Modi A, Kleiner DE, Promrat K, Heller T, Ghany M, et al. The effects of discontinuing pioglitazone in patients with nonalcoholic steatohepatitis. Hepatology. 2007 Aug;46(2):424-9. | PubMed |
Lutchman G, Modi A, Kleiner DE, Promrat K, Heller T, Ghany M, et al. The effects of discontinuing pioglitazone in patients with nonalcoholic steatohepatitis. Hepatology. 2007 Aug;46(2):424-9. | PubMed | Aithal GP, Thomas JA, Kaye PV, Lawson A, Ryder SD, Spendlove I, et al. Randomized, placebo-controlled trial of pioglitazone in nondiabetic subjects with nonalcoholic steatohepatitis. Gastroenterology. 2008 Oct;135(4):1176-84. | CrossRef | PubMed |
Aithal GP, Thomas JA, Kaye PV, Lawson A, Ryder SD, Spendlove I, et al. Randomized, placebo-controlled trial of pioglitazone in nondiabetic subjects with nonalcoholic steatohepatitis. Gastroenterology. 2008 Oct;135(4):1176-84. | CrossRef | PubMed | Aguilar-Olivos NE, Carrillo-Córdova D, Oria-Hernández J, Sánchez-Valle V, Ponciano-Rodríguez G, Ramírez-Jaramillo M, et al. The nuclear receptor FXR, but not LXR, up-regulates bile acid transporter expression in non-alcoholic fatty liver disease. Ann Hepatol. 2015 Jul-Aug;14(4):487-93. | PubMed |
Aguilar-Olivos NE, Carrillo-Córdova D, Oria-Hernández J, Sánchez-Valle V, Ponciano-Rodríguez G, Ramírez-Jaramillo M, et al. The nuclear receptor FXR, but not LXR, up-regulates bile acid transporter expression in non-alcoholic fatty liver disease. Ann Hepatol. 2015 Jul-Aug;14(4):487-93. | PubMed | Elias M, Jimenez-Castro M, Mendes-Braz M, Casillas-Ramírez A, PeraltaC. The current knowledge of the role of PPAR in hepatic Ischemia-reperfusion injury. PPAR Res. 2012;2012:802384. | CrossRef | PubMed |
Elias M, Jimenez-Castro M, Mendes-Braz M, Casillas-Ramírez A, PeraltaC. The current knowledge of the role of PPAR in hepatic Ischemia-reperfusion injury. PPAR Res. 2012;2012:802384. | CrossRef | PubMed | Corey KE, Vuppalanchi R, Wilson LA, Cummings OW, Chalasani N; NASH CRN. NASH resolution is associated with improvements in HDL and triglyceride levels but not improvement in LDL or non-HDL-C levels. Aliment Pharmacol Ther. 2015 Feb;41(3):301-9. | CrossRef | PubMed |
Corey KE, Vuppalanchi R, Wilson LA, Cummings OW, Chalasani N; NASH CRN. NASH resolution is associated with improvements in HDL and triglyceride levels but not improvement in LDL or non-HDL-C levels. Aliment Pharmacol Ther. 2015 Feb;41(3):301-9. | CrossRef | PubMed | Kargiotis K, Katsiki N, Athyros VG, Giouleme O, Patsiaoura K, et al. Effect of rosuvastatin on non-alcoholic steatohepatitis in patients with metabolic syndrome and hypercholesterolaemia: a preliminary report. Curr Vasc Pharmacol. 2014 May;12(3):505-11. | PubMed |
Kargiotis K, Katsiki N, Athyros VG, Giouleme O, Patsiaoura K, et al. Effect of rosuvastatin on non-alcoholic steatohepatitis in patients with metabolic syndrome and hypercholesterolaemia: a preliminary report. Curr Vasc Pharmacol. 2014 May;12(3):505-11. | PubMed | Gómez-Domínguez E, Gisbert JP, Moreno-Monteagudo JA, García-Buey L, Moreno-Otero R. A pilot study of atorvastatin treatment in dyslipemid, non-alcoholic fatty liver patients. Aliment Pharmacol Ther. 2006 Jun 1;23(11):1643-7. | PubMed |
Gómez-Domínguez E, Gisbert JP, Moreno-Monteagudo JA, García-Buey L, Moreno-Otero R. A pilot study of atorvastatin treatment in dyslipemid, non-alcoholic fatty liver patients. Aliment Pharmacol Ther. 2006 Jun 1;23(11):1643-7. | PubMed |