
 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: KDIGO, Acute Kidney Injury, Biomarkers, Therapy
La insuficiencia renal aguda es el síndrome caracterizado por una disminución brusca, sostenida y potencialmente reversible de la velocidad de filtración glomerular y de las funciones tubulares, afectando de forma global la función renal. Comprende una serie de eventos que se inician con la presencia de factores de riesgo que conducen hacia las fases de progresión de la insuficiencia renal aguda (estrés, lesión e insuficiencia renal), que culmina con la necesidad de terapias de reemplazo renal o muerte. Actualmente, el uso de biomarcadores que diferencien entre un daño funcional temprano o daño estructural de inicio tardío del riñón, le permite al médico realizar un diagnóstico y manejo oportuno antes de que se establezcan las fases previas a la insuficiencia renal, mejorando así la sobrevida de estos pacientes. Esta revisión busca integrar evidencia científica disponible que describe las fases previas de la insuficiencia renal aguda, revisando sus posibles causas, clasificaciones y métodos actuales de diagnóstico, junto con las principales recomendaciones vigentes para su manejo.
Ideas clave
|
La historia natural de la insuficiencia renal aguda (AKI, del inglés Acute Kidney Injury) se define por un continuo de eventos que inician con la presencia de factores de riesgo y continúa con las fases de estrés, lesión renal e insuficiencia renal[1]. Esta última se caracteriza por una disminución brusca, sostenida y potencialmente reversible de la velocidad de filtración glomerular y de las funciones tubulares en menos de 30 días, afectando de forma global la función renal[2],[3]. De este modo, puede causar alteraciones en la homeostasis de la presión arterial, función plaquetaria, volemia, equilibrio hidroelectrolítico, equilibrio ácido-base, vida media de fármacos, entre otros. Estudios actuales muestran de forma precoz la presencia de daño renal mediante el uso de biomarcadores, introduciendo los conceptos de estrés y lesión renal como fases previas a la insuficiencia.
Dado lo aquí expuesto, la presente revisión tiene por objetivo el integrar la evidencia científica disponible que describe las fases previas de la insuficiencia renal aguda, revisando en detalle sus posibles causas, clasificaciones, métodos diagnósticos más actuales y generalidades de las principales recomendaciones vigentes sobre su manejo. Para ello, se efectuaron revisiones en PubMed, ScienceDirect y Google Scholar.
La insuficiencia renal aguda es un síndrome frecuente, con incidencia que varía entre 15 y 35% según la etiología desencadenante[4]. Estas incluyen el shock y/o sepsis (50%), cirugía mayor o trauma (entre 25 y 35%), hipertensión intraabdominal, nefrotóxicos (inferior a 14%), entre otros[5],[6],[7]. Un estudio prospectivo multicéntrico realizado en Chile mostró una frecuencia similar a la señalada en la literatura internacional, indicando como causas la sepsis (50,9%), isquemia (46,5%), cirugía (26,3%), toxicidad exógena (24,5%), toxicidad endógena (11,4%), daño glomerular agudo (6,1%) y la uropatía obstructiva (6,1%)[8].
La mortalidad por insuficiencia renal aguda varía entre un 35% a un 60% en pacientes que requieren de terapia de reemplazo renal[4]. En este sentido, pese a haber recuperado una función renal posterior a una fase de lesión, existe un mayor riesgo de mortalidad a dos años o de rehospitalización[9], siendo también un factor de riesgo para insuficiencia renal crónica. Según los criterios de clasificación AKIN (por su sigla en inglés Acute Kidney Injury Network), a mayor estadio y días de hospitalización la sobrevida disminuye significativamente. Tanto así que en pacientes sin diagnóstico de insuficiencia renal aguda la sobrevida será de 95%, con AKIN 1 de 80%, AKIN 2 de 65% y con AKIN 3 inferior a 60%[10]. De este modo, la insuficiencia renal aguda se considera un marcador de severidad y mortalidad que define el pronóstico de las enfermedades concomitantes a ella[11].
Actualmente, la clasificación etiológica clásica para el diagnóstico diferencial de insuficiencia renal aguda (Tabla 1)[12], basada en la localización y frecuencia de presentación, está siendo reemplazada por el uso de patrones observables de lesión renal[13] fundados en la presencia de biomarcadores y/o de fenómenos que se superponen a etiologías prerrenales y/o parenquimatosas[14]. Así, la evidencia que respalda el uso de la relación entre el nitrógeno ureico en sangre y la creatinina como indicador etiológico a partir del valor de corte de 20, ha sido cuestionada dado que no otorga certeza respecto a la ubicación estructural del daño[15], no recomendándose por ello su uso. Por lo tanto, la disponibilidad de biomarcadores ha permitido la detección de cambios sutiles en la función renal y evidencia de lesión, previo al aumento de la creatinina sérica[3].
Históricamente se han utilizado como biomarcadores de función renal el nitrógeno ureico en sangre y creatinina. Esta última se eleva una vez que la velocidad de filtración glomerular disminuye más del 50%, con una cinética que requiere de un período de 24 a 48 horas para evaluar cambios[16]. Esto indica la escasa correlación entre creatinina y los cambios anatómicos a nivel renal, convirtiéndola en un biomarcador tardío que subestima el grado de insuficiencia renal en su instalación y sobrestima su recuperación[16].
Por ello, se han investigado nuevos biomarcadores que pesquisen precozmente las alteraciones de la función renal. Entre estos destaca NAG (N-Acetilglucosamina), GST (Glutation-S-Transferasa), L-FABP (Proteína enlazadora de ácidos grasos hepáticos), IL-18 (Interleucina 18), KIM-1 (Molécula de injuria renal), NGAL (Lipocalina asociada a gelatinasa de neutrófilos, presente en el túbulo renal), C-C (Cistatina-C) y TIMP2-IGFBP7 (inhibidor tisular de metaloproteinasa-2 proteína de unión al factor de crecimiento similar a la insulina 7)[3],[17],[25]. Estos se clasifican como biomarcadores de función glomerular (C-C) o de daño tubular (NAG, GST, L-FABP, IL-18, KIM-1, NGAL), destacando TIMP2-IGFBP7 por su utilidad en la identificación de estrés renal (estado previo a la lesión renal y altamente susceptible al daño inminente)[25].
Si bien, la fisiopatología y los tiempos de aparición de estos biomarcadores sigue en estudio, se estima que IL-18 es liberada en la orina por las células tubulares proximales entre 4 y 6 horas después de una lesión tubular (reflejando actividad inflamatoria), KIM-1 se libera entre las 3 y 6 horas luego de iniciada la isquemia o nefrotoxicidad y, NGAL se libera 3 horas después de iniciado el daño (producida por neutrófilos y tejido epitelial tubular renal)[3].
Cabe destacar que mediante los biomarcadores de daño intrínseco es posible detectar lesiones del riñón previo a un cambio significativo en los biomarcadores funcionales (Figura 1). Sin embargo, aún no se ha logrado estandarizar su uso dado el escaso desarrollo de pautas de integración, uso y monitoreo[25]. Además, no existen estudios que determinen el grado de sensibilidad y especificidad para la detección de daño renal de estos biomarcadores.
Figura 1. Clasificación según biomarcadores.
El análisis bioquímico de orina aporta información para el diagnóstico etiológico subyacente de insuficiencia renal aguda (Tabla 1)[18], no obstante, su utilidad es controversial dado el cambio del paradigma prerrenal/renal[19] al uso de biomarcadores. Entre los hallazgos patológicos que destaca se incluyen la presencia de proteinuria y hematuria con cilindros hemáticos y/o dismorfia eritrocitaria (sugerente de glomerulonefritis), leucocituria y/o piuria aséptica (sugerente de nefritis intersticial), hemoglobinuria y cambios de color de orina de negro a rosado (sugerente de daño renal por pigmentos o de mioglobinuria) y, cilindros de células epiteliales tubulares (sugerente de necrosis tubular aguda).
Dentro del estudio imagenológico, la ecografía renal destaca por su fácil accesibilidad, bajo costo, ausencia de efectos adversos y nula exposición a radiación o medios de contraste. Las características a evaluar con ella son: tamaño renal (nueve a 12 centímetros de longitud), ancho de la corteza (habitualmente un centímetro), diferenciación corticomedular, ecogenicidad, compromiso pieloureteral y la vascularización[20]. Debido a que la insuficiencia renal de inicio reciente es potencialmente reversible, el propósito de la ecografía es identificar en quiénes se esperarían una reversión del cuadro o un mayor deterioro en la velocidad de filtración glomerular.
Respecto al tamaño renal, es usual observar un tamaño preservado en insuficiencia renal aguda. Sin embargo, puede presentar un aumento de sus dimensiones tanto en la necrosis tubular aguda como en edema intersticial. Si bien es usual encontrar un tamaño renal disminuido en una patología crónica, existen enfermedades crónicas en las que se observa un aumento bilateral renal (diabetes, linfomas, nefropatías por virus de inmunodeficiencia humana, mieloma múltiple y amiloidosis)[20].
La ecogenicidad renal es un hallazgo ecográfico subjetivo pero útil, sugerente de una enfermedad renal médica subyacente. La ecogenicidad normal del riñón derecho es equivalente o hipoecoica en comparación con el hígado, mientras que el riñón izquierdo es típicamente hipoecoico en comparación con el bazo. Cuando la ecogenicidad cortical es mayor que el hígado se considera un marcador confiable para la disfunción renal, no obstante, en insuficiencia renal aguda esta varía en apariencia dependiendo de la etiología. Esto quiere decir que en situaciones prerrenales la ecogenicidad cortical es normal, mientras que en la necrosis tubular aguda existe una mayor diferenciación corticomedular[20].
La evaluación del hilio renal puede revelar hidronefrosis, a menudo a consecuencia de una uropatía obstructiva (intrínseca o extrínseca) o no obstructiva (embarazo, necrosis papilar). Es relevante descartar toda causa obstructiva de la vía urinaria ante el hallazgo de una dilatación pélvica (Tabla 1).
Dependiendo de la clasificación, el diagnóstico se realizará según: etapificación AKIN-KDIGO (Acute Kidney Injury Network-Kidney Disease: Improving Global Outcomes), etiología, temporalidad o, presencia o ausencia de biomarcadores funcionales y de daño renal (Tabla 2) (Figura 1), los cuales permiten un diagnóstico precoz en relación a los demás. Es un proceso dinámico en el que el paciente puede oscilar entre una etapa u otra[3].
Tabla 2. Diagnóstico en insuficiencia renal aguda.
La implementación de medidas de manejo estandarizadas ha mostrado beneficios en la sobrevida y en los tiempos de hospitalización. Entre ellas se encuentran el tratamiento no dialítico y la terapia de reemplazo renal.
1. Tratamiento no dialítico
El tratamiento de las enfermedades de base y condiciones predisponentes es un pilar de vital relevancia en la prevención y manejo de insuficiencia renal aguda.
1.1. Expansión de volumen: se recomienda una reanimación controlada con cristaloides ante una depleción del volumen o como medida profiláctica para prevenir la insuficiencia renal aguda asociada al uso de fármacos (Tabla 1). Se debe procurar evitar la sobrecarga de volumen, vigilando los niveles de electrolitos y el estado ácido-base. Asimismo, si se somete a medios de contraste intravascular, se recomienda el uso de cristaloides isotónicos. Por otro lado, el uso de albúmina sérica queda reservado únicamente para situaciones de shock séptico, desaconsejando además el empleo de almidón o dextranos dado los efectos negativos que la evidencia ha demostrado[21].
1.2. Diuréticos: sólo se recomienda para controlar o evitar la sobrecarga de volumen en pacientes que responden a diuréticos[21].
1.3. Vasopresores: se recomienda titular los vasopresores para una presión arterial media de 65 a 70 milímetros de hidrógeno en shock séptico, salvo si tiene hipertensión crónica previa, donde el objetivo aumentará a presión arterial media (PAM) entre 80 y 85. En caso de hipotensión, preferir el uso de norepinefrina como primera elección o vasopresina en casos de vasoplejia[21].
1.4. Vasodilatadores: no se recomienda el uso de dopamina, levosimendan, fenoldopam o péptidos natriuréticos para protección renal en pacientes críticos, pues pueden causar hipotensión al contrarrestar la vasoconstricción compensatoria en una hipovolemia oculta[21].
1.5. Hormono-metabólico: se indica mantener glicemias entre 110 y 149 microgramos por decilitro para la prevención del daño renal hiperglucémico[22]. No se sugiere el uso de selenio-IV, eritropoyetina o esteroides para prevenir la insuficiencia renal aguda dado su ausencia de beneficio. Tampoco se recomienda el uso de N-acetilcisteína en la prevención de insuficiencia renal aguda asociada al contraste en pacientes críticos debido a resultados contradictorios y posibles efectos adversos. Sí se sugiere el uso a corto plazo de atorvastatina o rosuvastatina para prevenir la insuficiencia renal aguda asociada al contraste en pacientes de alto riesgo sometidos a angiografía coronaria, así como el uso perioperatorio de estatinas en dosis altas para prevenir la insuficiencia renal aguda postoperatoria en cirugía cardíaca[21].
1.6. Nutricional: no se recomienda suspender la nutrición en un paciente con insuficiencia renal aguda, manteniendo un soporte nutricional adecuado, preferiblemente a través de la vía enteral. Se sugiere el aporte de 20 a 30 kilocalorías por kilogramo al día y aporte proteico de 0,8 a un gramos por kilogramo al día(entre 1 y 1,5 en terapia de reemplazo renal, máximo 1,7 en hipercatabólicos). En casos de uremia la terapia de reemplazo renal podría ser una opción para restituir la nutrición cuanto antes, previniendo la exacerbación de esta[22].
2. Terapia de reemplazo renal
Incluye modalidades de diálisis intermitente, diálisis continua o terapias híbridas. Cada modalidad posee sus protocolos establecidos, sin embargo, aún persisten dudas respecto a cómo medir la calidad de la entrega de terapia de reemplazo renal, por lo cual no se privilegia el uso de una por sobre otra[23].
Los criterios de inicio de terapia de reemplazo renal en insuficiencia renal aguda son: oliguria (menos de 200 mililitros en 12 horas) o anuria (inferior a 50 mililitros en 12 horas), hiperkalemia (mayor a 6,5 miliequivalentes por litro), hipernatremia (mayor a 155 miliequivalentes por litro) e hiponatremia (inferior a 120 miliequivalentes por litro) refractaria a tratamiento; acidemia severa (pH inferior a 7), azoemia (nitrógeno ureico en sangre mayor a 73 microgramos por decilitro o urea mayor a 30 microgramos por decilitro), complicaciones urémicas (encefalopatía, neuropatía, miopatía, pericarditis urémica), hipertermia y sobredosis de drogas dializables[24].
En una revisión Cochrane, que incluyó cinco estudios aleatorios de baja calidad con 1084 pacientes, compararon el inicio estándar versus el inicio precoz de la terapia de reemplazo renal con el objetivo de evaluar la reducción del riesgo de muerte, aumento de la recuperación de la función renal o aumento del riesgo de eventos adversos en pacientes con insuficiencia renal aguda grave. Si bien, el inicio precoz de la terapia de reemplazo renal mostró reducir el riesgo de muerte y mejorar la recuperación de la función renal, también aumenta el riesgo de eventos adversos que empeoran estos resultados[25]. Respecto a la mortalidad, la evidencia no concluyó un patrón de comportamiento a corto ni a largo plazo, debido a que existen valores que muestran tanto un aumento como una disminución de esta, ambos de forma poco significativa. Por lo tanto, surge la necesidad de estudios adicionales con criterios apropiados que reduzcan la imprecisión de los resultados[26].
3. Control
El control con niveles creatinina seriada presenta la desventaja de mostrar la función renal de las 48 horas previas a su toma[16]. Sin embargo, una curva de creatinina en descenso podría evidenciar un patrón que justificara el alta médica, continuando con controles ambulatorios. En pacientes en diálisis crónica, la creatinina se controla al menos cada tres meses, mientras que el nitrógeno ureico se controla de forma mensual.
Conclusión
La definición de insuficiencia renal aguda aún intenta precisar conceptos que permitan un diagnóstico temprano por sobre un diagnóstico etiológico. Es así como se está introduciendo el uso de biomarcadores para establecer el grado de compromiso renal, en complemento con los actuales estadios indicados por - Acute Kidney Injury Network -Kidney Disease: Improving Global Outcomes.
A pesar de ello, se requiere de mayor evidencia para introducir su uso de forma global. En consecuencia, el manejo continúa centrándose en medidas preventivas y soporte básico, que permitan evitar el requerimiento de terapia de reemplazo renal que, si bien puede tener beneficio en reducir el riesgo de muerte y recuperación de la función renal, tiene un impacto negativo al aumentar el riesgo de eventos adversos y al no tener claridad respecto a si su uso aumenta o reduce la mortalidad.
Notas
Roles de contribución
BAR: investigación, conceptualización, escritura del artículo, revisión crítica de sus aspectos intelectuales y edición, supervisión general y aprobación final de la versión completa. MMR: investigación, escritura del artículo, revisión crítica de sus aspectos intelectuales. JWI, BLP, JVU: escritura del artículo y edición.
Conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.



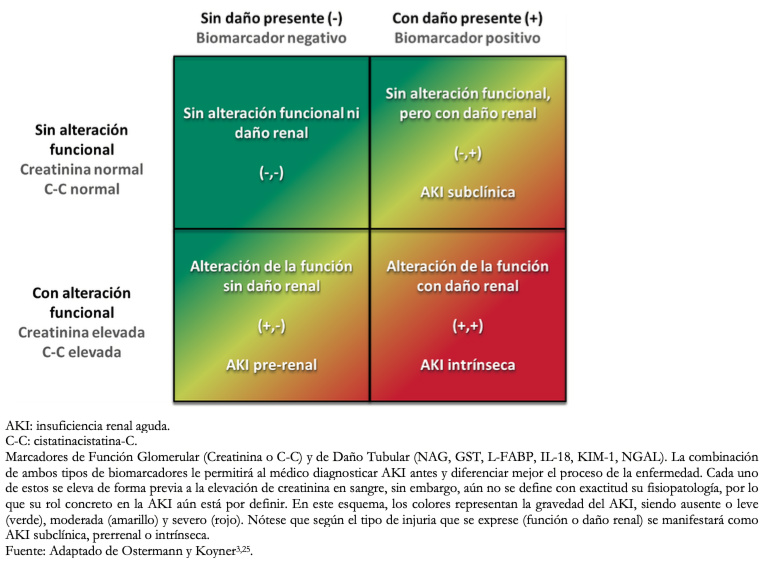 Figura 1. Clasificación según biomarcadores.
Figura 1. Clasificación según biomarcadores.

 Tabla 2. Diagnóstico en insuficiencia renal aguda.
Tabla 2. Diagnóstico en insuficiencia renal aguda.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Acute kidney injury is a syndrome characterized by a sudden, sustained, and potentially reversible decrease in glomerular filtration rate and tubular function, which globally impacts renal function. It comprises of a series of events starting with the presence of risk factors, then evolving towards acute kidney injury progression, characterized by stress, injury, and renal failure, culminating with either the use of renal replacement therapy or death. Currently, the use of biomarkers that differentiate between the initial functional deterioration and late-onset structural damage of the kidney enables the clinician to perform an early diagnosis and indicate treatment before the stages of acute kidney injury progression are established, thus increasing survival rates.
 Autores:
Bastian Abarca Rozas[1], Manuel Mestas Rodríguez[2], Jorge Widerström Isea[1], Beatriz Lobos Pareja [3], Jocelyn Vargas Urra [4]
Autores:
Bastian Abarca Rozas[1], Manuel Mestas Rodríguez[2], Jorge Widerström Isea[1], Beatriz Lobos Pareja [3], Jocelyn Vargas Urra [4]

Citación: Abarca Rozas B, Mestas Rodríguez M, Widerström Isea J, Lobos Pareja B, Vargas Urra J. A current view on the early diagnosis and treatment of acute kidney failure. Medwave 2020;20(5):e7928 doi: 10.5867/medwave.2020.05.7928
Fecha de envío: 30/10/2019
Fecha de aceptación: 18/5/2020
Fecha de publicación: 9/6/2020
Origen: No solicitado.
Tipo de revisión: Con revisión por pares externa, por dos árbitros a doble ciego.

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Aún no hay comentarios en este artículo.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 Murray PT, Devarajan P, Levey AS, Eckardt KU, Bonventre JV, Lombardi R,
et al. A framework and key research questions in AKI
diagnosis and staging in different environments. Clin J Am Soc Nephrol. 2008
May;3(3):864-8. | CrossRef | PubMed |
Murray PT, Devarajan P, Levey AS, Eckardt KU, Bonventre JV, Lombardi R,
et al. A framework and key research questions in AKI
diagnosis and staging in different environments. Clin J Am Soc Nephrol. 2008
May;3(3):864-8. | CrossRef | PubMed | Mehta RL, Chertow GM. Acute renal failure definitions and classification:
time for change? J Am Soc Nephrol. 2003 Aug;14(8):2178-87. | CrossRef | PubMed |
Mehta RL, Chertow GM. Acute renal failure definitions and classification:
time for change? J Am Soc Nephrol. 2003 Aug;14(8):2178-87. | CrossRef | PubMed | Ostermann M, Joannidis M. Acute kidney injury 2016: diagnosis and diagnostic
workup. Crit Care. 2016 Sep 27;20(1):299. | CrossRef | PubMed |
Ostermann M, Joannidis M. Acute kidney injury 2016: diagnosis and diagnostic
workup. Crit Care. 2016 Sep 27;20(1):299. | CrossRef | PubMed | Negi S, Koreeda D, Kobayashi S, Yano T, Tatsuta K, Mima T, et al. Acute kidney injury: Epidemiology, outcomes, complications, and therapeutic
strategies. Semin Dial. 2018 Sep;31(5):519-527. | CrossRef | PubMed |
Negi S, Koreeda D, Kobayashi S, Yano T, Tatsuta K, Mima T, et al. Acute kidney injury: Epidemiology, outcomes, complications, and therapeutic
strategies. Semin Dial. 2018 Sep;31(5):519-527. | CrossRef | PubMed | Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, et al. Acute renal
failure in critically ill patients: a multinational, multicenter study. JAMA.
2005 Aug 17;294(7):813-8. | CrossRef | PubMed |
Uchino S, Kellum JA, Bellomo R, Doig GS, Morimatsu H, Morgera S, et al. Acute renal
failure in critically ill patients: a multinational, multicenter study. JAMA.
2005 Aug 17;294(7):813-8. | CrossRef | PubMed | de Mendonça A, Vincent JL, Suter PM, Moreno R, Dearden NM, Antonelli M,
et al. Acute renal failure in the ICU: risk factors
and outcome evaluated by the SOFA score. Intensive Care Med. 2000
Jul;26(7):915-21. | CrossRef | PubMed |
de Mendonça A, Vincent JL, Suter PM, Moreno R, Dearden NM, Antonelli M,
et al. Acute renal failure in the ICU: risk factors
and outcome evaluated by the SOFA score. Intensive Care Med. 2000
Jul;26(7):915-21. | CrossRef | PubMed | Guerin C, Girard R, Selli JM, Perdrix JP, Ayzac L. Initial versus delayed
acute renal failure in the intensive care unit. A multicenter prospective
epidemiological study. Rhône-Alpes Area Study Group on Acute Renal Failure. Am J
Respir Crit Care Med. 2000 Mar;161(3 Pt 1):872-9. | CrossRef | PubMed |
Guerin C, Girard R, Selli JM, Perdrix JP, Ayzac L. Initial versus delayed
acute renal failure in the intensive care unit. A multicenter prospective
epidemiological study. Rhône-Alpes Area Study Group on Acute Renal Failure. Am J
Respir Crit Care Med. 2000 Mar;161(3 Pt 1):872-9. | CrossRef | PubMed | Vukusich A, Alvear F, Villanueva P, González C, Francisco O, Alvarado N,
et al. Epidemiología de la insuficiencia renal aguda grave. Un estudio
prospectivo multicéntrico en la Región Metropolitana [Epidemiology of severe
acute renal failure in Metropolitan Santiago]. Rev Med Chil. 2004
Nov;132(11):1355-61. | PubMed |
Vukusich A, Alvear F, Villanueva P, González C, Francisco O, Alvarado N,
et al. Epidemiología de la insuficiencia renal aguda grave. Un estudio
prospectivo multicéntrico en la Región Metropolitana [Epidemiology of severe
acute renal failure in Metropolitan Santiago]. Rev Med Chil. 2004
Nov;132(11):1355-61. | PubMed | Rydingsward JE, Horkan CM, Mogensen KM, Quraishi SA, Amrein K, Christopher
KB. Functional Status in ICU Survivors and Out of Hospital Outcomes: A Cohort
Study. Crit Care Med. 2016 May;44(5):869-79. | CrossRef | PubMed |
Rydingsward JE, Horkan CM, Mogensen KM, Quraishi SA, Amrein K, Christopher
KB. Functional Status in ICU Survivors and Out of Hospital Outcomes: A Cohort
Study. Crit Care Med. 2016 May;44(5):869-79. | CrossRef | PubMed | Wang HE, Jain G, Glassock RJ, Warnock DG. Comparison of absolute serum
creatinine changes versus Kidney Disease: Improving Global Outcomes consensus
definitions for characterizing stages of acute kidney injury. Nephrol Dial
Transplant. 2013 Jun;28(6):1447-54. | CrossRef | PubMed |
Wang HE, Jain G, Glassock RJ, Warnock DG. Comparison of absolute serum
creatinine changes versus Kidney Disease: Improving Global Outcomes consensus
definitions for characterizing stages of acute kidney injury. Nephrol Dial
Transplant. 2013 Jun;28(6):1447-54. | CrossRef | PubMed | Singbartl K, Joannidis M. Short-term Effects of Acute Kidney Injury. Crit
Care Clin. 2015 Oct;31(4):751-62. | CrossRef | PubMed |
Singbartl K, Joannidis M. Short-term Effects of Acute Kidney Injury. Crit
Care Clin. 2015 Oct;31(4):751-62. | CrossRef | PubMed | Makris K, Spanou L. Acute Kidney Injury: Definition, Pathophysiology and
Clinical Phenotypes. Clin Biochem Rev. 2016 May;37(2):85-98. | PubMed |
Makris K, Spanou L. Acute Kidney Injury: Definition, Pathophysiology and
Clinical Phenotypes. Clin Biochem Rev. 2016 May;37(2):85-98. | PubMed | Chen H, Busse LW. Novel Therapies for Acute Kidney Injury. Kidney Int Rep.
2017 Jun 28;2(5):785-799. | CrossRef | PubMed |
Chen H, Busse LW. Novel Therapies for Acute Kidney Injury. Kidney Int Rep.
2017 Jun 28;2(5):785-799. | CrossRef | PubMed | Endre ZH, Kellum JA, Di Somma S, Doi K, Goldstein SL, Koyner JL, et al. Differential diagnosis of AKI in clinical practice by
functional and damage biomarkers: workgroup statements from the tenth Acute
Dialysis Quality Initiative Consensus Conference. Contrib Nephrol.
2013;182:30-44. | CrossRef | PubMed |
Endre ZH, Kellum JA, Di Somma S, Doi K, Goldstein SL, Koyner JL, et al. Differential diagnosis of AKI in clinical practice by
functional and damage biomarkers: workgroup statements from the tenth Acute
Dialysis Quality Initiative Consensus Conference. Contrib Nephrol.
2013;182:30-44. | CrossRef | PubMed | Rachoin JS, Daher R, Moussallem C, Milcarek B, Hunter K, Schorr C, et al. The fallacy of the BUN:creatinine ratio in critically ill
patients. Nephrol Dial Transplant. 2012 Jun;27(6):2248-54. | CrossRef | PubMed |
Rachoin JS, Daher R, Moussallem C, Milcarek B, Hunter K, Schorr C, et al. The fallacy of the BUN:creatinine ratio in critically ill
patients. Nephrol Dial Transplant. 2012 Jun;27(6):2248-54. | CrossRef | PubMed | Huidobro E JP, Tagle R, Guzmán AM. Creatinina y su uso para la estimación de
la velocidad de filtración glomerular [Estimation of glomerular filtration rate
with creatinine]. Rev Med Chil. 2018 Mar;146(3):344-350. | CrossRef | PubMed |
Huidobro E JP, Tagle R, Guzmán AM. Creatinina y su uso para la estimación de
la velocidad de filtración glomerular [Estimation of glomerular filtration rate
with creatinine]. Rev Med Chil. 2018 Mar;146(3):344-350. | CrossRef | PubMed | Devarajan P. Neutrophil gelatinase-associated lipocalin: a promising
biomarker for human acute kidney injury. Biomark Med. 2010 Apr;4(2):265-80. | CrossRef | PubMed |
Devarajan P. Neutrophil gelatinase-associated lipocalin: a promising
biomarker for human acute kidney injury. Biomark Med. 2010 Apr;4(2):265-80. | CrossRef | PubMed | Schrier RW, Wang W, Poole B, Mitra A. Acute renal failure: definitions,
diagnosis, pathogenesis, and therapy. J Clin Invest. 2004 Jul;114(1):5-14. | CrossRef | PubMed |
Schrier RW, Wang W, Poole B, Mitra A. Acute renal failure: definitions,
diagnosis, pathogenesis, and therapy. J Clin Invest. 2004 Jul;114(1):5-14. | CrossRef | PubMed | Maciel AT, Vitorio D. Urine biochemistry assessment in critically ill
patients: controversies and future perspectives. J Clin Monit Comput. 2017
Jun;31(3):539-546. | CrossRef | PubMed |
Maciel AT, Vitorio D. Urine biochemistry assessment in critically ill
patients: controversies and future perspectives. J Clin Monit Comput. 2017
Jun;31(3):539-546. | CrossRef | PubMed | Kelahan LC, Desser TS, Troxell ML, Kamaya A. Ultrasound Assessment of Acute
Kidney Injury. Ultrasound Q. 2019 Jun;35(2):173-180. | CrossRef | PubMed |
Kelahan LC, Desser TS, Troxell ML, Kamaya A. Ultrasound Assessment of Acute
Kidney Injury. Ultrasound Q. 2019 Jun;35(2):173-180. | CrossRef | PubMed | Joannidis M, Druml W, Forni LG, Groeneveld ABJ, Honore PM, Hoste E,
et al. Prevention of acute kidney
injury and protection of renal function in the intensive care unit: update 2017
: Expert opinion of the Working Group on Prevention, AKI section, European
Society of Intensive Care Medicine. Intensive Care Med. 2017 Jun;43(6):730-749. | CrossRef | PubMed |
Joannidis M, Druml W, Forni LG, Groeneveld ABJ, Honore PM, Hoste E,
et al. Prevention of acute kidney
injury and protection of renal function in the intensive care unit: update 2017
: Expert opinion of the Working Group on Prevention, AKI section, European
Society of Intensive Care Medicine. Intensive Care Med. 2017 Jun;43(6):730-749. | CrossRef | PubMed | Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney inter. 2012;2:1–138. [Internet] | Link |
Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney inter. 2012;2:1–138. [Internet] | Link | Rewa O, Mottes T, Bagshaw SM. Quality measures for acute kidney injury and
continuous renal replacement therapy. Curr Opin Crit Care. 2015 Dec;21(6):490-9. | CrossRef | PubMed |
Rewa O, Mottes T, Bagshaw SM. Quality measures for acute kidney injury and
continuous renal replacement therapy. Curr Opin Crit Care. 2015 Dec;21(6):490-9. | CrossRef | PubMed | Lameire N, Van Biesen W, Vanholder R. Acute renal failure. Lancet. 2005 Jan
29-Feb 4;365(9457):417-30. | CrossRef | PubMed |
Lameire N, Van Biesen W, Vanholder R. Acute renal failure. Lancet. 2005 Jan
29-Feb 4;365(9457):417-30. | CrossRef | PubMed |