Key Words: Anemia, Biosimilar, Chronic kidney disease, Erythropoietin stimulating agents
Ideas clave
|
Introducción
La anemia es una complicación habitual en los pacientes con enfermedad renal crónica. En general, obedece a una etiología múltiple y aumenta a medida que se deteriora el filtrado glomerular [1]. Las causas de anemia en la enfermedad renal crónica incluyen la ferropenia, la deficiencia de vitamina B12, de ácido fólico, las toxinas urémicas, las alteraciones del metabolismo mineral, la inflamación o el uso de determinados fármacos con capacidad mielotóxica y, sobre todo, la disminución de la capacidad para la producción de eritropoyetina a nivel renal [2]. Para paliar esta situación, en el momento actual disponemos de fármacos biológicos como los agentes estimulantes de la eritropoyesis. Desde su aparición, los agentes estimulantes de la eritropoyesis no solo han sido capaces de mejorar la calidad de vida de los pacientes y reducir el número de transfusiones, si no que han demostrado su capacidad para reducir la mortalidad y las hospitalizaciones de los pacientes con enfermedad renal crónica y anemia [3],[4]. Sin embargo, estos agentes no están exentos de efectos adversos. Además, su uso indiscriminado impacta de manera notable en la incidencia de eventos cardiovasculares, hipertensión o trombosis [5].
Los fármacos biológicos presentan un elevado costo, derivado de su intenso desarrollo y evaluación, lo que puede generar falta de equidad en su acceso para determinados grupos de pacientes. En el año 2008 se comercializó en España el primer fármaco biosimilar de epoetina α. Los fármacos biosimilares son productos similares a la molécula original, pero con un desarrollo específico e independiente, no idéntico, que deben ser capaces de demostrar su no inferioridad respecto al fármaco de referencia [6]. La regulación en la aprobación de fármacos biosimilares corre a cargo de la Agencia Europea del Medicamento desde el año 2005, e incluye la realización de ensayos clínicos fase 1 y 3 previo a su lanzamiento [7]. Hasta el momento de redacción de este trabajo, existen en Europa más de 60 fármacos biosimilares comercializados.
En el caso de los biosimilares de epoetina α, se han llevado a cabo algunos ensayos clínicos demostrando su perfil de seguridad en los estudios de fase 1 y su efectividad en los de fase 3 [8],[9]. Además, a la fecha de elaboración del presente estudio se están llevando a cabo estudios post autorización que tienen como objetivo reevaluar la efectividad y seguridad a largo plazo de dichos fármacos. Sin embargo, los estudios observacionales en vida real publicados hasta la fecha presentan algunas limitaciones. En términos generales, son heterogéneos en la inclusión de pacientes con y sin enfermedad renal crónica. Además, analizan la efectividad de los biosimilares en su conjunto sin que dispongamos hasta ahora de evidencia sobre agentes concretos en poblaciones determinadas. En el caso concreto de la epoetina α, los estudios disponibles en vida real son muy escasos, tanto de inicio del biosimilar como de cambio desde otros agentes estimulantes de la eritropoyesis.
El objetivo del presente estudio es evaluar el uso de un fármaco biosimilar de epoetina α en vida real en pacientes con enfermedad renal crónica. Para ello se analizó su efectividad y eficiencia tanto en pacientes que no recibían agentes estimulantes de la eritropoyesis como en pacientes que estaban siendo tratados.
Método
Diseño del estudio
Realizamos un estudio observacional retrospectivo. En él se incluyó a pacientes consecutivos de las consultas externas de nefrología, en los que se había iniciado un fármaco biosimilar de epoetina α en nuestro centro (Hospital Universitario de La Princesa) en el año 2018.
Participantes
Como criterios de inclusión se estableció que fueran pacientes mayores de 18 años, con enfermedad renal crónica estadio 3 o superior, con criterios de inicio de agentes estimulantes de la eritropoyesis o que ya estuvieran en tratamiento con ellos y mantuvieran dichos criterios. Para definir los criterios nos basamos en las guías Kidney Disease: Improving Global Outcomes (KDIGO) de anemia y las National Institute for Health and Care Excellence (NICE) publicadas en 2012 y 2015, respectivamente [10],[11]. De esta manera, iniciamos los agentes estimulantes de la eritropoyesis con cifras de hemoglobina inferiores a 10,5 gramos por decilitro para mantener un rango entre 10,5 y 11,5 gramos por decilitro y evitando aumentos superiores a 2 gramos por decilitro en un mes. Excluimos del estudio a pacientes con ferropenia o déficit de ácido fólico y vitamina B12, que hubieran tenido un ingreso hospitalario durante el estudio o en los dos meses antes del inicio del fármaco o que tuvieran alguna contraindicación para el uso de este. No se incluyó a los pacientes que no disponían de datos clínicos completos.
Variables
Haciendo uso de las mismas guías, definimos ferropenia absoluta como índice de saturación de transferrina inferior a 20% y ferritina inferior a 100 microgramos por decilitro, y déficit funcional de hierro como índice de saturación de transferrina inferior a 30% y ferritina inferior a 500 microgramos por decilitro.
En el momento basal se recogieron datos demográficos, de función renal (creatinina y filtrado glomerular estimado por la Chronic Kidney Disease Epidemiology Collaboration, CKD-EPI), hemoglobina, índice de saturación de transferrina, ferritina y uso previo de hierro [12]. Clasificamos a los pacientes en los estadios de enfermedad renal crónica en función del filtrado glomerular estimado [13].
En los pacientes que estaban en tratamiento con agentes estimulantes de la eritropoyesis, recogimos el agente que utilizaban y la dosis. Utilizamos un factor de conversión para realizar el cambio de agentes estimulantes de la eritropoyesis al biosimilar que consistió en mantener la dosis en el caso de epoetina β, multiplicar por 200 la dosis semanal en microgramos de darbepoetina α y multiplicar por 800 la dosis de metoxi-polietilenglicol epoetina β (también en microgramos) [14].
Se estableció una comparación de las variables recogidas en dos grupos, comparándose aquellos que recibían agentes estimulantes de la eritropoyesis frente a los que no.
Fuentes
Se utilizó como fuente la historia clínica electrónica.
Sesgos
Los potenciales sesgos de diseño (observacional), confusión y selección se intentaron paliar con la inclusión de una población homogénea y completa.
Tamaño muestral
Se determinó haciendo uso del registro clínico incluyendo a todos los pacientes con necesidad de agentes estimulantes de la eritropoyesis y que hubieran recibido un biosimilar.
Variables cualitativas (de resultado)
Teniendo en cuenta las guías clínicas, ficha clínica y protocolo de práctica clínica en nuestro medio, se evaluó a los pacientes a los dos meses del inicio del tratamiento con el biosimilar para analizar los cambios en la hemoglobina y en la función renal.
Métodos estadísticos
Las variables se expresan como media ± desviación estándar si siguen una distribución normal (según el test de Kolmogorov-Smirnov) o como mediana (rango intercuartílico) en caso contrario. Para la inferencia estadística utilizamos los tests Chi-cuadrado o test de Fisher y t de student o de Mann-Whitney en función de los resultados de la normalidad, tanto para comparar las características basales entre los grupos con y sin agentes estimulantes de la eritropoyesis como en el análisis a los dos meses de seguimiento. Para el análisis de costo, realizamos una evaluación económica completa, teniendo en cuenta los resultados clínicos y los costos, mediante un análisis de costo efectividad-incremental [15].
Todos los análisis estadísticos se realizaron con el programa SPSS (SPSS Inc., Chicago, IL) versión 21.0. Se consideró estadísticamente significativo un valor p < 0,05.
Resultados
Se incluyó a 111 pacientes procedentes de las consultas externas de nefrología, con una edad media de 83 ± 8 años y de los que 60 (54%) eran varones. La distribución por estadios de la enfermedad renal crónica demostró que la mayoría de los pacientes presentaban un estadio 3b (42,38%) o 4 (54,48%). La creatinina media se situó en 1,8 ± 0,8 miligramos por decilitro y el filtrado glomerular estimado por CKD-EPI en 29 ± 12 mililitro por minuto por 1,73 metros cuadrados. En cuanto a los parámetros hematológicos, la hemoglobina media fue de 10,2 ± 1,2 gramos por decilitro. El resto de las características basales se muestran en la Tabla 1.
Tabla 1. Características basales de la población en los diferentes grupos de estudio.
Setenta y un pacientes (64%) no recibían ningún tratamiento con agentes estimulantes de la eritropoyesis en el momento del inicio del estudio. De los 40 (36%) pacientes que sí recibían algún tipo de agentes estimulantes de la eritropoyesis, la mayoría se administraban metoxi-polietilenglicol epoetina β (72,5%), seguido de darbepoetina α (25%) y sólo una paciente epoetina β (2,5%). En la Tabla 2 se especifican las dosis basales medias de cada uno de ellos.
Tabla 2. Pacientes tratados con agentes estimulantes de eritropoyesis previo y dosis recibida.
Realizamos una comparación entre los pacientes que recibían agentes estimulantes de la eritropoyesis y los que no. Encontramos que había diferencias significativas en la edad, la creatinina y el filtrado glomerular basal y la hemoglobina basal.
Tras el inicio del tratamiento con el fármaco biosimilar, analizamos la variación en los parámetros analíticos hematológicos y de función renal a los dos meses. Los pacientes naïve de agentes estimulantes de la eritropoyesis aumentaron significativamente las cifras de hemoglobina tras el inicio del biosimilar (diferencia entre las cifras basales y a los dos meses: 2,2 ± 1,4 gramos por decilitro, p < 0,001). Como era de esperar, en los pacientes a los que se realizó el cambio desde otros agentes estimulantes de la eritropoyesis, no se encontraron diferencias tras el inicio del biosimilar (0,6 ± 1,8 gramos por decilitro, con un valor de p no significativo). No hubo diferencias en la variación del filtrado glomerular estimado por CKD-EPI entre los pacientes naïve y los que recibían agentes estimulantes de la eritropoyesis (+1,7 ± 6,2 versus -0,1 ± 5,7, p = 0,23) (Figura1).
Figura 1. Variación de la hemoglobina en los pacientes tratados con el biosimilar de epoetina α
El cambio al biosimilar supuso una reducción de costos de una media de 83 ± 11% frente al precio inicial (costo previo 81 ± 41 versus 10 ± 7 euros por semana, p < 0,001) (Figura 2). En la Tabla 3, se muestra la evaluación económica completa en ambos grupos del estudio, demostrándose un ahorro de 131 euros por unidad de hemoglobina y paciente con el uso del biosimilar.
Figura 2. Reducción de costos con el uso de biosimilares (p < 0,001).
Tabla 3. Evaluación económica completa.
No se registró ningún efecto adverso con el uso del biosimilar de epoetina α.
Discusión
Los resultados de nuestro estudio, por primera vez en vida real, confirman que los pacientes con anemia y enfermedad renal crónica sin tratamiento con agentes estimulantes de la eritropoyesis alcanzan un beneficio en términos de hemoglobina al recibir un biosimilar con un excelente perfil de seguridad. Además, aquellos que ya recibían tratamiento con agentes estimulantes de la eritropoyesis mantienen las cifras de hemoglobina tras el cambio al biosimilar, pero alcanzando una importante eficiencia. Este relevante ahorro en costos ha demostrado permitir un mayor acceso a tratamientos biológicos a más población, lo que supone un impacto clínico significativo. Concretamente, nuestros datos en vida real reflejan una reducción de más del 80% en los pacientes a los que se les realiza el cambio. Esta mejor eficiencia se había demostrado ya en un artículo publicado sobre un modelo de costos usando teóricamente un paciente con anemia inducida por cáncer en diferentes regiones del mundo, aunque no con tanta contundencia como reflejan nuestros datos [16].
El uso de biosimilares de epoetina α en la enfermedad renal crónica ha sido reportado en diferentes estudios con resultados similares a los nuestros. En cuanto al aumento en las cifras de hemoglobina en los pacientes que no recibían agentes estimulantes de la eritropoyesis, nuestros datos reflejan una media de 2,2 ± 1,4 gramos por decilitro a los dos meses de seguimiento. Uno de los pocos estudios que revela datos cuantitativos de la efectividad de los biosimilares fue el derivado del registro italiano de Treviso publicado por Ingrasciotta y colaboradores [17]. En dicho estudio se incorporó a todos los pacientes que habían recibido cualquier biosimilar de epoetina incluyendo a aquellos con enfermedad renal crónica y cáncer. El aumento en la hemoglobina fue significativo en el subgrupo de pacientes con enfermedad renal crónica (1,5 ± 1,1 gramos por decilitro) a los tres meses de tratamiento, sin diferencias frente a los pacientes que recibían el fármaco de referencia (1,6 ± 1,1 gramos por decilitro). Cabe destacar que la respuesta a los agentes estimulantes de la eritropoyesis tiene múltiples factores implicados como la inflamación, la uremia, la presencia de neoplasias, la nutrición o la interacción farmacológica. Aunque en nuestro estudio, los pacientes responden de manera homogénea a los biosimilares, la resistencia al uso de agentes estimulantes de la eritropoyesis debe ser evaluada y tratada con el fin de evitar riesgos relacionados con la excesiva dosificación de los mismos [18].
En el subgrupo de pacientes que ya recibían agentes estimulantes de la eritropoyesis analizamos la variación de la hemoglobina tras el cambio (switch) al biosimilar. Tras dos meses de seguimiento, no encontramos diferencias en las cifras de hemoglobina antes y después del cambio. En un estudio analizado por pareamiento por puntaje de propensión publicado por Belleudi y colaboradores, se analiza la efectividad y seguridad en el cambio de un agente estimulante de la eritropoyesis por un biosimilar. Basándose en una red de estudio de fármacos biosimilares (ItaBioNet), los autores obtienen información de 14 400 pacientes incidentes en el uso de agentes estimulantes de la eritropoyesis para anemia, de los cuales 1866 cambian a un biosimilar [19]. Los resultados en términos de efectividad concluyeron con la no inferioridad del fármaco biosimilar con similares efectos adversos a los publicados en pacientes con agentes estimulantes de la eritropoyesis [5].
A pesar de que la edad se considera un predictor de falta de respuesta a los agentes estimulantes de la eritropoyesis, la edad media de los pacientes de nuestro estudio se situó en 83 ± 8 años superando a la de los estudios publicados con anterioridad y demostrando la efectividad del fármaco incluso en poblaciones envejecidas [20]. Además, en nuestra serie encontramos diferencias en la edad media de ambos grupos (naïve y aquellos que ya recibían agentes estimulantes de la eritropoyesis), sin que eso supusiera un cambio en la respuesta esperable a uso del biosimilar.
En cuanto a los efectos adversos, no detectamos ninguno relevante tras los dos meses de seguimiento. El estudio post-autorización realizado con el mismo agente que nuestro estudio (EPO-PASS) reveló reacciones adversas con frecuencias similares a la esperadas. En dicho estudio, ningún paciente desarrolló anticuerpos frente a epoetina, ni anemia pura de células rojas [21].
Nuestro estudio no está exento de limitaciones. Por un lado, posee las propias de un estudio retrospectivo y observacional tales como la pérdida de datos en el seguimiento o el uso de la historia clínica como fuente. Sin embargo, en este estudio se siguieron las recomendaciones de las guías clínicas por lo que los pacientes presentaban determinaciones seriadas de hemoglobina. Además, aquellos pacientes en los que no disponíamos de información clínica en términos de efectividad fueron excluidos del estudio para que fuera más homogéneo. Por otro lado, el tamaño muestral y la falta de seguimiento también constituyen limitaciones. Sin embargo, a pesar de ello, los resultados obtenidos son concluyentes para el análisis tanto de efectividad como de eficiencia, ambos objetivos de la serie presentada, siendo esta la mayor publicada hasta la fecha. La decisión de marcar un punto de evaluación de dos meses radica en las guías clínicas y la ficha técnica del fármaco, que además coincide con nuestra práctica clínica habitual [10],[11]. Esta evaluación nos permite determinar los resultados que produce el biosimilar en pacientes estables y a corto plazo. En cualquier caso, debemos ser cautos con la extrapolación de datos de estudios observacionales atendiendo a las limitaciones inherentes de los mismos.
Además, los resultados de seguridad en nuestro caso solo se refieren a los dos primeros meses tras el inicio del fármaco, por lo que hacen falta estudios a más largo plazo para comprobar dicha situación en vida real. Finalmente, encontramos diferencias esperables entre los dos grupos de estudio en sus características basales (edad, hemoglobina y función renal) que no creemos que interfieran en los resultados del estudio. Además, estas diferencias son lógicas atendiendo a que unos se encontraban en tratamiento previo con agentes estimulantes de la eritropoyesis (los que tenían más disfunción renal y mejores cifras de hemoglobina).
Conclusión
El uso de un fármaco biosimilar de epoetina α es efectivo para aumentar los niveles de hemoglobina en pacientes sin tratamiento con agentes estimulantes de la eritropoyesis. Además, supone una importante reducción de costos frente al uso de los fármacos de referencia.
Sin duda, nuestros resultados abren nuevas evidencias en el uso de biosimilares que tendrán que ser refrendados en posteriores estudios a más largo plazo, también en vida real y abordando la importancia de la eficiencia. Por otro lado, el campo de los fármacos biosimilares aún permanece con muy poco desarrollo, por lo que es deseable que la investigación clínica avance y su uso se pueda universalizar.
Notas
Roles de autoría
PMR: diseño del estudio, adquisición de datos, revisión y aprobación de la versión final. YGG: adquisición de datos, revisión y aprobación de la versión final. VAC: diseño del estudio, redacción del artículo. BQ: diseño del estudio, adquisición de datos, análisis e interpretación, redacción del artículo.
Conflictos de intereses
BQ y VA han participado en ponencias remuneradas por parte de Sandoz con el contenido de la presente investigación.
Financiamiento
Los autores declaran que no han recibido financiamiento para la realización del presente trabajo.
Consideraciones éticas
Aprobado por el Comité Ético de Investigación Clínica de Cantabria obteniendo la adecuación del Hospital Universitario de la Princesa el 9 de octubre de 2017.
Disponibilidad de datos
Disponibilidad de entrega de datos a solicitud.

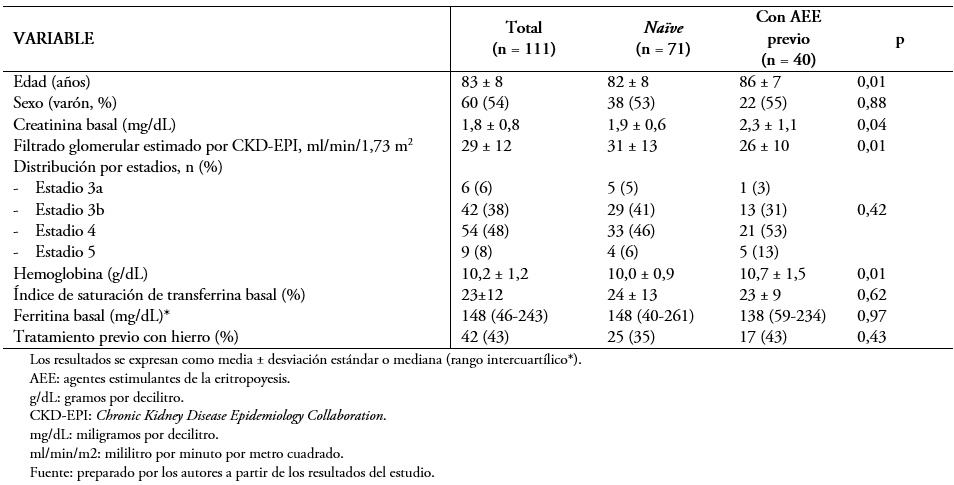 Tabla 1. Características basales de la población en los diferentes grupos de estudio.
Tabla 1. Características basales de la población en los diferentes grupos de estudio.

 Tabla 2. Pacientes tratados con agentes estimulantes de eritropoyesis previo y dosis recibida.
Tabla 2. Pacientes tratados con agentes estimulantes de eritropoyesis previo y dosis recibida.

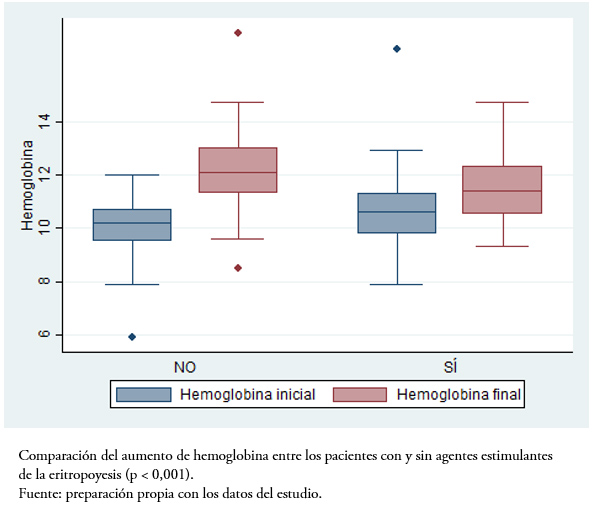 Figura 1. Variación de la hemoglobina en los pacientes tratados con el biosimilar de epoetina α
Figura 1. Variación de la hemoglobina en los pacientes tratados con el biosimilar de epoetina α

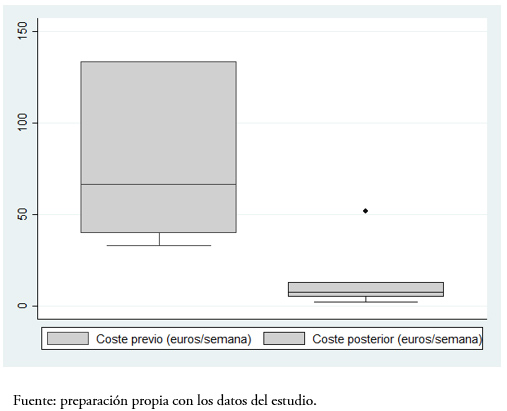 Figura 2. Reducción de costos con el uso de biosimilares (p < 0,001).
Figura 2. Reducción de costos con el uso de biosimilares (p < 0,001).

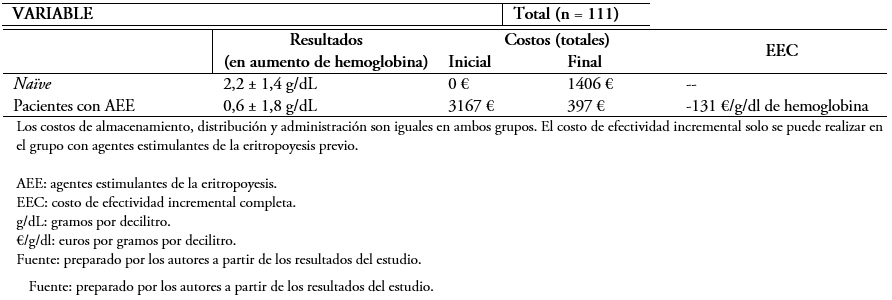 Tabla 3. Evaluación económica completa.
Tabla 3. Evaluación económica completa.

Introduction
Patients with chronic kidney disease usually have anemia secondary to an erythropoietin deficit. The emergence of biosimilar drugs of erythropoiesis-stimulating agents ensures broader access to these treatments.
Objective
This study analyzes the effectiveness of an epoetin α biosimilar drug in chronic kidney disease patients with anemia.
Methods
This observational retrospective study enrolled 111 consecutive outpatients with chronic kidney disease and anemia and criteria for using erythropoiesis-stimulating agents. We collected baseline epidemiological and comorbidity data, as well as hematological and renal function infor-mation. We analyzed the effectiveness of the biosimilar agent in naïve patients and those who already had other erythropoiesis-stimulating agents.
Results
The 111 included patients had a mean age of 83 ± 8 years, and 54% were males. We found that patients who previously received erythropoiesis-stimulating agents, maintained hemoglobin values at two months of treatment with the biosimilar, while the naïve group significantly raised their hemoglobin values (P < 0.001). Renal function remained stable within the whole sample. The cost of using erythropoiesis-stimulating agents was reduced by a mean of 82 ± 17% with the biosimilar drug.
Conclusion
Using a biosimilar of epoetin α is effective in patients with chronic kidney disease and anemia and significantly reduces costs.
 Authors:
Patricia Muñoz Ramos[1], Yohana Gil Giraldo[1], Vicente Álvarez Chiva[1], Borja Quiroga[1]
Authors:
Patricia Muñoz Ramos[1], Yohana Gil Giraldo[1], Vicente Álvarez Chiva[1], Borja Quiroga[1]
Affiliation:
[1] Servicio de Nefrología, Hospital Universitario de La Princesa, Madrid, España
E-mail: borjaqg@gmail.com

Citation: Muñoz Ramos P, Gil Giraldo Y, Álvarez Chiva V, Quiroga B. Effectiveness of biosimilar drugs in the treatment of renal anemia: A case series. Medwave 2021;21(9):e8474 doi: 10.5867/medwave.2021.09.8474
Submission date: 26/3/2021
Acceptance date: 23/9/2021
Publication date: 20/10/2021
Origin: Not commissioned
Type of review: Externally peer-reviewed by three reviewers, double-blind in the first round of review, and single-blind in the subsequent rounds

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Stauffer ME, Fan T. Prevalence of anemia in chronic kidney disease in the United States. PLoS One. 2014 Jan 2;9(1):e84943 | CrossRef | PubMed |
- Cases A, Puchades MJ, de Sequera P, Quiroga B, Martin-Rodriguez L, Gorriz JL, Portolés J; en representación del Grupo de Anemia de la S.E.N.. Iron replacement therapy in the management of anaemia in non-dialysis chronic renal failure patients: Perspective of the Spanish Nephrology Society Anaemia Group. Nefrologia. 2021 Mar-Apr;41(2):123-136 | CrossRef | PubMed |
- Bahlmann J, Schöter KH, Scigalla P, Gurland HJ, Hilfenhaus M, Koch KM,, et al. Morbidity and mortality in hemodialysis patients with and without erythropoietin treatment: a controlled study. Contrib Nephrol. 1991;88:90-106 | CrossRef | PubMed |
- Association between recombinant human erythropoietin and quality of life and exercise capacity of patients receiving haemodialysis. Canadian Erythropoietin Study Group. BMJ. 1990 March 3;300(6724):573-8 | CrossRef | PubMed |
- Palmer SC, Navaneethan SD, Craig JC, Johnson DW, Tonelli M, Garg AX, et al. Meta-analysis: erythropoiesis-stimulating agents in patients with chronic kidney disease. Ann Intern Med. 2010 Jul 6;153(1):23-33 | CrossRef | PubMed |
- Goldsmith D, Dellanna F, Schiestl M, Krendyukov A, Combe C. Epoetin Biosimilars in the Treatment of Renal Anemia: What Have We Learned from a Decade of European Experience? Clin Drug Investig. 2018 Jun;38(6):481-490. | CrossRef | PubMed |
- European Medicines Agency. Guideline on Non-Clinical and Clinical Development of Similar Biological Medicinal Products Containing Recombinant Erythropoietins (Revision) London: EMA; 2010. [on line]. | Link |
- Wizemann V, Rutkowski B, Baldamus C, Scigalla P, Koytchev R; Epoetin Zeta Study Group. Comparison of the therapeutic effects of epoetin zeta to epoetin alfa in the maintenance phase of renal anaemia treatment. Curr Med Res Opin. 2008 Mar;24(3):625-37. | CrossRef | PubMed |
- Krivoshiev S, Todorov VV, Manitius J, Czekalski S, Scigalla P, Koytchev R. Comparison of the therapeutic effects of epoetin zeta and epoetin alpha in the correction of renal anaemia. Curr Med Res Opin. 2008 May;24(5):1407-15 | CrossRef | PubMed |
- Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney inter. Suppl 2012; 2: 279-335. | CrossRef |
- NICE guideline [NG8]: Chronic kidney disease: managing anaemia. Published date: June 2015 [on line]. | Link |
- Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF 3rd, Feldman HI, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009 May 5;150(9):604-12. | CrossRef |
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter. Suppl 2013; 3: 1-150 | CrossRef |
- Aranesp (darbepoetin alfa) [product monograph]. Mississauga (ON): Amgen Canada Inc; 2011 Sep. Accessed through Health Canada Drug Product Database [on line] | Link |
- Logan AG, Milne BJ, Achber C, Campbell WP, Haynes RB. Cost-effectiveness of a worksite hypertension treatment program. Hypertension. 1981 Mar-Apr;3(2):211-8. | CrossRef | PubMed |
- Aapro M, Cornes P, Sun D, Abraham I. Comparative cost efficiency across the European G5 countries of originators and a biosimilar erythropoiesis-stimulating agent to manage chemotherapy-induced anemia in patients with cancer. Ther Adv Med Oncol. 2012 May;4(3):95-105. | CrossRef | PubMed |
- Ingrasciotta Y, Giorgianni F, Marcianò I, Bolcato J, Pirolo R, Chinellato A, et al. Comparative Effectiveness of Biosimilar, Reference Product and Other Erythropoiesis-Stimulating Agents (ESAs) Still Covered by Patent in Chronic Kidney Disease and Cancer Patients: An Italian Population-Based Study. PLoS One. 2016 May 17;11(5):e0155805. | CrossRef | PubMed |
- Anemia en el enfermo renal. López Gómez JM, Abad S. En: Lorenzo V, López Gómez JM (Eds). Nefrología al día. [on line]. | Link |
- Belleudi V, Trotta F, Addis A, Ingrasciotta Y, Ientile V, Tari M, et al. Effectiveness and Safety of Switching Originator and Biosimilar Epoetins in Patients with Chronic Kidney Disease in a Large-Scale Italian Cohort Study. Drug Saf. 2019 Dec;42(12):1437-1447. | CrossRef | PubMed |
- Kalantar-Zadeh K, Lee GH, Miller JE, Streja E, Jing J, Robertson JA, et al Predictors of hyporesponsiveness to erythropoiesis-stimulating agents in hemodialysis patients. Am J Kidney Dis. 2009 May;53(5):823-34. | CrossRef | PubMed |
- Hörl WH, Locatelli F, Haag-Weber M, Ode M, Roth K; Epo-PASS study group. Prospective multicenter study of HX575 (biosimilar epoetin-α) in patients with chronic kidney disease applying a target hemoglobin of 10--12 g/dl. Clin Nephrol. 2012 Jul;78(1):24-32. | CrossRef | PubMed |
 Stauffer ME, Fan T. Prevalence of anemia in chronic kidney disease in the United States. PLoS One. 2014 Jan 2;9(1):e84943 | CrossRef | PubMed |
Stauffer ME, Fan T. Prevalence of anemia in chronic kidney disease in the United States. PLoS One. 2014 Jan 2;9(1):e84943 | CrossRef | PubMed | Cases A, Puchades MJ, de Sequera P, Quiroga B, Martin-Rodriguez L, Gorriz JL, Portolés J; en representación del Grupo de Anemia de la S.E.N.. Iron replacement therapy in the management of anaemia in non-dialysis chronic renal failure patients: Perspective of the Spanish Nephrology Society Anaemia Group. Nefrologia. 2021 Mar-Apr;41(2):123-136 | CrossRef | PubMed |
Cases A, Puchades MJ, de Sequera P, Quiroga B, Martin-Rodriguez L, Gorriz JL, Portolés J; en representación del Grupo de Anemia de la S.E.N.. Iron replacement therapy in the management of anaemia in non-dialysis chronic renal failure patients: Perspective of the Spanish Nephrology Society Anaemia Group. Nefrologia. 2021 Mar-Apr;41(2):123-136 | CrossRef | PubMed | Bahlmann J, Schöter KH, Scigalla P, Gurland HJ, Hilfenhaus M, Koch KM,, et al. Morbidity and mortality in hemodialysis patients with and without erythropoietin treatment: a controlled study. Contrib Nephrol. 1991;88:90-106 | CrossRef | PubMed |
Bahlmann J, Schöter KH, Scigalla P, Gurland HJ, Hilfenhaus M, Koch KM,, et al. Morbidity and mortality in hemodialysis patients with and without erythropoietin treatment: a controlled study. Contrib Nephrol. 1991;88:90-106 | CrossRef | PubMed | Association between recombinant human erythropoietin and quality of life and exercise capacity of patients receiving haemodialysis. Canadian Erythropoietin Study Group. BMJ. 1990 March 3;300(6724):573-8 | CrossRef | PubMed |
Association between recombinant human erythropoietin and quality of life and exercise capacity of patients receiving haemodialysis. Canadian Erythropoietin Study Group. BMJ. 1990 March 3;300(6724):573-8 | CrossRef | PubMed | Palmer SC, Navaneethan SD, Craig JC, Johnson DW, Tonelli M, Garg AX, et al. Meta-analysis: erythropoiesis-stimulating agents in patients with chronic kidney disease. Ann Intern Med. 2010 Jul 6;153(1):23-33 | CrossRef | PubMed |
Palmer SC, Navaneethan SD, Craig JC, Johnson DW, Tonelli M, Garg AX, et al. Meta-analysis: erythropoiesis-stimulating agents in patients with chronic kidney disease. Ann Intern Med. 2010 Jul 6;153(1):23-33 | CrossRef | PubMed | Goldsmith D, Dellanna F, Schiestl M, Krendyukov A, Combe C. Epoetin Biosimilars in the Treatment of Renal Anemia: What Have We Learned from a Decade of European Experience? Clin Drug Investig. 2018 Jun;38(6):481-490. | CrossRef | PubMed |
Goldsmith D, Dellanna F, Schiestl M, Krendyukov A, Combe C. Epoetin Biosimilars in the Treatment of Renal Anemia: What Have We Learned from a Decade of European Experience? Clin Drug Investig. 2018 Jun;38(6):481-490. | CrossRef | PubMed | European Medicines Agency. Guideline on Non-Clinical and Clinical Development of Similar Biological Medicinal Products Containing Recombinant Erythropoietins (Revision) London: EMA; 2010. [on line]. | Link |
European Medicines Agency. Guideline on Non-Clinical and Clinical Development of Similar Biological Medicinal Products Containing Recombinant Erythropoietins (Revision) London: EMA; 2010. [on line]. | Link | Wizemann V, Rutkowski B, Baldamus C, Scigalla P, Koytchev R; Epoetin Zeta Study Group. Comparison of the therapeutic effects of epoetin zeta to epoetin alfa in the maintenance phase of renal anaemia treatment. Curr Med Res Opin. 2008 Mar;24(3):625-37. | CrossRef | PubMed |
Wizemann V, Rutkowski B, Baldamus C, Scigalla P, Koytchev R; Epoetin Zeta Study Group. Comparison of the therapeutic effects of epoetin zeta to epoetin alfa in the maintenance phase of renal anaemia treatment. Curr Med Res Opin. 2008 Mar;24(3):625-37. | CrossRef | PubMed | Krivoshiev S, Todorov VV, Manitius J, Czekalski S, Scigalla P, Koytchev R. Comparison of the therapeutic effects of epoetin zeta and epoetin alpha in the correction of renal anaemia. Curr Med Res Opin. 2008 May;24(5):1407-15 | CrossRef | PubMed |
Krivoshiev S, Todorov VV, Manitius J, Czekalski S, Scigalla P, Koytchev R. Comparison of the therapeutic effects of epoetin zeta and epoetin alpha in the correction of renal anaemia. Curr Med Res Opin. 2008 May;24(5):1407-15 | CrossRef | PubMed | Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney inter. Suppl 2012; 2: 279-335. | CrossRef |
Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney inter. Suppl 2012; 2: 279-335. | CrossRef | NICE guideline [NG8]: Chronic kidney disease: managing anaemia. Published date: June 2015 [on line]. | Link |
NICE guideline [NG8]: Chronic kidney disease: managing anaemia. Published date: June 2015 [on line]. | Link | Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF 3rd, Feldman HI, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009 May 5;150(9):604-12. | CrossRef |
Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF 3rd, Feldman HI, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009 May 5;150(9):604-12. | CrossRef | Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter. Suppl 2013; 3: 1-150 | CrossRef |
Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney inter. Suppl 2013; 3: 1-150 | CrossRef | Aranesp (darbepoetin alfa) [product monograph]. Mississauga (ON): Amgen Canada Inc; 2011 Sep. Accessed through Health Canada Drug Product Database [on line] | Link |
Aranesp (darbepoetin alfa) [product monograph]. Mississauga (ON): Amgen Canada Inc; 2011 Sep. Accessed through Health Canada Drug Product Database [on line] | Link | Logan AG, Milne BJ, Achber C, Campbell WP, Haynes RB. Cost-effectiveness of a worksite hypertension treatment program. Hypertension. 1981 Mar-Apr;3(2):211-8. | CrossRef | PubMed |
Logan AG, Milne BJ, Achber C, Campbell WP, Haynes RB. Cost-effectiveness of a worksite hypertension treatment program. Hypertension. 1981 Mar-Apr;3(2):211-8. | CrossRef | PubMed | Aapro M, Cornes P, Sun D, Abraham I. Comparative cost efficiency across the European G5 countries of originators and a biosimilar erythropoiesis-stimulating agent to manage chemotherapy-induced anemia in patients with cancer. Ther Adv Med Oncol. 2012 May;4(3):95-105. | CrossRef | PubMed |
Aapro M, Cornes P, Sun D, Abraham I. Comparative cost efficiency across the European G5 countries of originators and a biosimilar erythropoiesis-stimulating agent to manage chemotherapy-induced anemia in patients with cancer. Ther Adv Med Oncol. 2012 May;4(3):95-105. | CrossRef | PubMed | Ingrasciotta Y, Giorgianni F, Marcianò I, Bolcato J, Pirolo R, Chinellato A, et al. Comparative Effectiveness of Biosimilar, Reference Product and Other Erythropoiesis-Stimulating Agents (ESAs) Still Covered by Patent in Chronic Kidney Disease and Cancer Patients: An Italian Population-Based Study. PLoS One. 2016 May 17;11(5):e0155805. | CrossRef | PubMed |
Ingrasciotta Y, Giorgianni F, Marcianò I, Bolcato J, Pirolo R, Chinellato A, et al. Comparative Effectiveness of Biosimilar, Reference Product and Other Erythropoiesis-Stimulating Agents (ESAs) Still Covered by Patent in Chronic Kidney Disease and Cancer Patients: An Italian Population-Based Study. PLoS One. 2016 May 17;11(5):e0155805. | CrossRef | PubMed | Anemia en el enfermo renal. López Gómez JM, Abad S. En: Lorenzo V, López Gómez JM (Eds). Nefrología al día. [on line]. | Link |
Anemia en el enfermo renal. López Gómez JM, Abad S. En: Lorenzo V, López Gómez JM (Eds). Nefrología al día. [on line]. | Link | Belleudi V, Trotta F, Addis A, Ingrasciotta Y, Ientile V, Tari M, et al. Effectiveness and Safety of Switching Originator and Biosimilar Epoetins in Patients with Chronic Kidney Disease in a Large-Scale Italian Cohort Study. Drug Saf. 2019 Dec;42(12):1437-1447. | CrossRef | PubMed |
Belleudi V, Trotta F, Addis A, Ingrasciotta Y, Ientile V, Tari M, et al. Effectiveness and Safety of Switching Originator and Biosimilar Epoetins in Patients with Chronic Kidney Disease in a Large-Scale Italian Cohort Study. Drug Saf. 2019 Dec;42(12):1437-1447. | CrossRef | PubMed |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis









