Key Words: coronavirus, COVID-19, SARS-CoV-2, mortality, hospitalization, risk factors, Peru
Resumen
Objetivos
Describir las características clínicas y evaluar los factores asociados con la mortalidad de los pacientes adultos con la nueva enfermedad causada por coronavirus 2019 (COVID-19) ingresados a un hospital de referencia nacional de Perú.
Métodos
Se realizó un estudio de cohorte prospectivo. Se incluyó a pacientes mayores de 18 años hospitalizados con el diagnóstico de infección por coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2). Se excluyó a quienes ingresaron con prueba rápida serológica positiva al ingreso, sin clínica sugestiva ni imágenes compatibles. Los datos se recolectaron a partir de la historia clínica.
Resultados
Se incluyó un total de 813 adultos, 544 (66,9%) tuvieron COVID-19 confirmado. La media de la edad fue de 61,2 años (desviación estándar: 15) y 575 (70,5%) fueron de sexo masculino. Las comorbilidades más frecuentes fueron hipertensión arterial (34,1%) y obesidad (25,9%). Los síntomas más frecuentes al ingreso fueron disnea (82,2%) y tos (53,9%). Un total de 114 (14%) pacientes recibieron ventilación mecánica, 38 (4,7%) ingresaron a unidad de cuidados intensivos y 377 (46,4%) fallecieron. Se asociaron a la mortalidad el requerimiento de soporte ventilatorio, el mayor compromiso pulmonar y los marcadores inflamatorios. Encontramos que por cada 10 años que aumentó la edad, el riesgo de morir se incrementó en 32% (riesgo relativo: 1,32; intervalo de confianza 95%: 1,25 a 1,38). Aquellos pacientes que requirieron ingreso a unidad de cuidados intensivos y ventilación mecánica tuvieron 1,39 (intervalo de confianza 95%: 1,13 a 1,69) y 1,97 (intervalo de confianza 95%: 1,69 a 2,29) veces el riesgo de morir, respectivamente.
Conclusión
La mortalidad encontrada en nuestro estudio fue alta y estuvo asociada a la edad, marcadores inflamatorios y compromiso respiratorio.
|
Ideas clave
|
Introducción
Hacia finales del año 2020, la nueva enfermedad por el coronavirus 2019 (COVID-19) había cobrado casi 2 millones de muertes a nivel mundial según los reportes oficiales de la Organización Mundial de la Salud[1]. Perú es uno de los países más afectados por la actual pandemia, con un registro en abril de 2021 de más de mil muertos en exceso por millón de habitantes[2].
La mortalidad hospitalaria asociada a COVID-19, ha sido estudiada en diversas cohortes internacionales[3],[4],[5],[6]. Se ha determinado que factores como la edad y comorbilidades como las enfermedades cardiovasculares, diabetes y obesidad están asociados a mayor mortalidad en pacientes con COVID-19[7],[8]. Sin embargo, existe poca literatura de estudios en países sudamericanos donde las condiciones de su sistema sanitario, económico y social han jugado un rol importante en la mortalidad hospitalaria por COVID-19[9],[10],[11].
Este estudio se realizó con el objetivo principal de determinar los factores asociados a mortalidad de los pacientes adultos con COVID-19 ingresados a un hospital de referencia nacional de Perú. También busca describir sus características clínicas, manejo y evolución para determinar diferencias con otros países y detectar los grupos de pacientes con mayor riesgo de mortalidad.
Métodos
Diseño y población
Se realizó un estudio de cohorte prospectivo en el Hospital Nacional Edgardo Rebagliati Martins perteneciente al Seguro Social de Salud de Perú, EsSalud, el cual adaptó la mayor parte de su capacidad hospitalaria a la atención de pacientes con COVID-19. Este hospital es un centro de referencia nacional.
La población de estudio fue pacientes mayores de 18 años hospitalizados que ingresaron por el servicio de emergencia durante el periodo de un mes (del 22 de mayo al 21 de junio de 2020) con el diagnóstico de infección por coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) sospechosa o confirmada. No se realizó una estimación del tamaño de muestra debido a que se efectuó una selección no probabilística, incluyendo a todo el universo de pacientes en el estudio.
Se consideró como caso sospechoso a los pacientes que presentaban síntomas o imágenes (radiografía o tomografía) sugestivas de infección de COVID-19. Se consideró caso confirmado a los pacientes con una prueba diagnóstica positiva por el test de reacción en cadena de la polimerasa con transcriptasa inversa de hisopado nasofaríngeo (RT-PCR) o prueba serológica rápida (inmunoglobulinas M o G)[12]. Se excluyeron a los pacientes que ingresaron con prueba rápida serológica positiva con RT-PCR negativo o ausente y sin reporte de sintomatología sugestiva ni imágenes compatibles, debido a que se consideraron como posibles casos falsos positivos. Los autores extrajeron la información de la historia clínica (física o electrónica) de los pacientes enrolados desde el ingreso hasta el alta o fallecimiento. La revisión periódica de las historias clínicas facilitó la identificación de participantes y disminuyó las potenciales pérdidas en el estudio.
Variables
Se registraron datos demográficos (edad y sexo), clínicos, de imagen y laboratorio. Se consideraron los antecedentes patológicos más prevalentes: hipertensión arterial, diabetes mellitus, obesidad, enfermedad renal crónica, cardiopatía isquémica, asma, cáncer, enfermedad vascular cerebral, hipotiroidismo, enfermedad pulmonar intersticial difusa, cirrosis hepática, enfermedad pulmonar obstructiva crónica. La obtención del antecedente de obesidad se realizó según dos criterios:
- El índice de masa corporal obtenido mediante el registro disponible en la historia clínica del peso y talla del paciente.
- El diagnóstico de obesidad consignado en la historia clínica por el médico tratante.
Se incluyeron los resultados de las pruebas RT-PCR y rápida serológica (inmunoglobulina M, inmunoglobulina G o ambas). Asimismo, se describió la medicación previa a la hospitalización como tratamiento para COVID-19, los síntomas y las funciones vitales de ingreso.
Dentro de los exámenes auxiliares se consignaron los laboratorios del ingreso (hemograma, análisis bioquímico, hepático, coagulación, marcadores inflamatorios y gases arteriales) y estudios de imágenes. Se clasificó el grado de compromiso pulmonar mediante el porcentaje de afectación y la escala de COVID-19 Reporting and Data System (CORADS)[13].
Respecto a las variables de atención hospitalaria se contemplaron el manejo terapéutico, tipo de oxigenoterapia y complicaciones intrahospitalarias. En el seguimiento se consignó la necesidad de cuidados intensivos, uso de ventilación mecánica y el desenlace (alta o fallecimiento) indicando la fecha del evento.
Consideraciones éticas
El presente estudio representó un riesgo mínimo para los pacientes ya que no se tuvo contacto directo con ellos y no se recolectó información que permitiera identificarlos. Asimismo, solo los investigadores tuvieron acceso a los datos recolectados. El protocolo de investigación fue aprobado por el Comité de Ética en Investigación para COVID-19 del Seguro Social de Salud. Este protocolo se realizó en concordancia con la declaración de Helsinki y con el reporte de Belmont, en los cuales los autores se comprometen a respetar el anonimato del paciente en estudio.
Análisis estadístico
Se registró y almacenó la información en una base de datos en el programa Excel Microsoft 2016, para luego exportarla al programa STATA v14. Para resumir las variables categóricas se utilizaron frecuencias y porcentajes, mientras que para las variables cuantitativas se usaron medidas de tendencia central y dispersión, dependiendo de la distribución de los datos.
Se reportan el porcentaje de datos faltantes para cada variable. Debido a que la proporción de datos perdidos para la mayoría de las variables fue pequeña y a que se consideró que estos fueron al azar, se optó por no realizar argucias estadísticas para tratar los datos perdidos[14].
Para evaluar las asociaciones entre la mortalidad y las variables sociodemográficas, clínicas y de laboratorio, se realizaron pruebas de hipótesis de acuerdo con la naturaleza de las variables independientes. Para variables categóricas se utilizó Chi-cuadrado o prueba exacta de Fisher, mientras que para las variables cuantitativas se utilizó t de Student o U de Mann-Whitney.
Finalmente, se estimó el tamaño de efecto (riesgo relativo e intervalos de confianza al 95%) mediante la creación de modelos de regresión de Poisson con varianza robusta[15]. Creamos modelos crudos y ajustados por edad y sexo. Además, las variables sociodemográficas y clínicas se ajustaron por presión arterial de oxígeno/fracción inspirada de oxígeno al ingreso. Estas variables se incluyeron en los modelos ajustados ya que son potenciales variables confusoras[16]. Al crear los modelos se evaluó el supuesto de linealidad y para los modelos ajustados se evaluó la colinealidad, no hallándose problemas de multicolinealidad. Para todas las pruebas estadísticas se utilizó un nivel de significancia estadística de 0,05.
Resultados
Características al ingreso
Durante el periodo de estudio se hospitalizó a un total de 843 adultos con el diagnóstico de COVID-19 (confirmado o sospecha), de los cuales 30 no cumplieron con los criterios de inclusión y fueron retirados del estudio. Así, en el presente análisis se incluyeron un total de 813 pacientes. De estos, a 711 (87,5%) pacientes se les realizaron pruebas diagnósticas y 544 (66,9%) tuvieron COVID-19 confirmado. De los pacientes con casos confirmados, 192 fueron diagnosticados mediante RT-PCR y 352 por prueba rápida serológica (Figura 1).
Figura 1. Diagrama de flujo de participantes del estudio.
La media de la edad fue de 61,2 años (desviación estándar: 15,0) y 573 (70,5%) fueron de sexo masculino. La comorbilidad más frecuente de los pacientes hospitalizados fue la hipertensión arterial con 34,1% (n = 277). En la Tabla 1 es posible apreciar otros resultados destacados de cada área.
Tabla 1. Características de pacientes con COVID-19 (n = 813).
Independientemente del motivo de ingreso, la mayoría de los pacientes arribó a la emergencia con sintomatología respiratoria (90,3%). La mediana de tiempo de enfermedad al ingreso fue de siete días antes del ingreso (rango intercuartílico: 5 a 10). Los síntomas más frecuentes fueron disnea (82,2%), tos (53,9%) y fiebre (51,2%) (Tabla 2).
Tabla 2. Síntomas de pacientes con COVID-19 (n = 813).
Al momento del ingreso 374 (46,0%) de los pacientes había recibido alguna medicación previa como tratamiento para COVID-19. Así, 286 (35,2%) tomaron azitromicina, 148 (18,2%) ivermectina, 23 (2,8%) hidroxicloroquina y 119 (14,6%) tomaron combinaciones de estos, por una mediana de 4 días (rango intercuartílico: 2 a 5). Con respecto a antiagregantes plaquetarios y anticoagulantes, 24 (3,0%) tomaron aspirina, 38 (4,7%) utilizaron enoxaparina, 6 (0,7%) warfarina y 26 (3,2%) recibieron combinaciones de anticoagulantes, por una mediana de 3 días (rango intercuartílico: 2 a 5). Sobre el consumo de corticoides, 78 (9,6%) consumieron prednisona, 35 (4,3%) dexametasona y 53 (6,5%) alguna combinación durante una mediana fue de 4 días (rango intercuartílico: 3 a 5).
Al evaluar las funciones vitales, se registró que la mediana de frecuencia respiratoria fue de 24 respiraciones por minuto (rango intercuartílico: 22 a 28), la de frecuencia cardíaca fue 92 latidos por minuto (rango intercuartílico: 82 a 104), y la de presión arterial sistólica fue 100 milímetros de mercurio (rango intercuartílico: 100 a 120). La mayoría de los pacientes arribó con requerimiento de máscara de reservorio (43,1%) o cánula nasal (29,5%). La mediana de saturación de oxígeno al ingreso fue 89% (rango intercuartílico: 85 a 92%).
A todos los pacientes hospitalizados se les realizó alguna prueba de imágenes, siendo la tomografía la prueba realizada en 93,7% de los pacientes. Al evaluar el compromiso pulmonar utilizando la clasificación de CORADS se reportó que: 10 (2%) tuvieron imágenes no sugestivas (escala de CORADS 1 y 2), 17 (2,1%) indeterminado (escala de CORADS 3) y 779 (96,0%) un patrón sugestivo (escala de CORADS 4, 5 y 6). La media de porcentaje de parénquima pulmonar comprometido en la tomografía fue de 55,4% (desviación estándar: 18,7). En la Tabla 3 se presentan los exámenes de laboratorio al ingreso.
Tabla 3. Estudios de laboratorio en pacientes con COVID-19 (n = 813).
Manejo y evolución durante la hospitalización
Durante la hospitalización 462 (56,8%) pacientes recibieron azitromicina, 97 (11,9%) hidroxicloroquina, 168 (20,7%) ivermectina, 498 (61,3%) recibieron enoxaparina profiláctica, 172 (21,2%) enoxaparina terapéutica, 18 (2,2%) heparina no fraccionada, 200 (24,6%) recibieron dexametasona, 243 (29,9%) metilprednisolona en esquema de pulso (125 a 500 miligramos) y 233 (28,7%) a dosis inferiores. La mediana de días de tratamiento con corticoides fue de 3 (rango intercuartílico: 2 a 5).
A 143 (17,6%) de los pacientes se les realizó un electrocardiograma y se registró que 116 tuvieron un hallazgo normal o que se correlacionaba con sus antecedentes y 27 tuvieron un hallazgo nuevo, reportando en 18 pacientes una prolongación del intervalo QT. No se encontró asociación entre la administración de azitromicina e hidroxicloroquina hospitalaria y la prolongación del intervalo QT (valor p = 0,928 Chi-cuadrado y valor p = 0,121 prueba exacta de Fisher, respectivamente).
La mayoría de los pacientes (782 equivalente a 96,2%) recibió antibióticos durante la hospitalización. La frecuencia de antibióticos fue: 486 (59,8%) de los pacientes recibieron ceftriaxona, 118 (14,5%) piperacilina tazobactam, 64 (7,9%) meropenem, 64 (7,9%) vancomicina y 114 (14,0%) recibieron otro esquema antibiótico.
Durante la hospitalización, 215 (26,5%) pacientes en estudio presentaron neumonía intrahospitalaria, 151 (18,6%) tuvieron lesión renal aguda, 79 (9,7%) desarrollaron delirio, 17 (2,1%) tuvieron un proceso trombótico venoso y 20 pacientes presentaron otras complicaciones. La mediana del tiempo de enfermedad en el cual los pacientes aumentaban el requerimiento de oxígeno se presentó al día 10 (rango intercuartílico: 7 a 14).
Con respecto a los desenlaces de interés, 114 (14,0%) de los pacientes hospitalizados recibieron ventilación mecánica, 38 (4,7%) ingresaron a unidad de cuidados intensivos y 377 (46,4%) fallecieron. La mediana del tiempo de estancia en unidad de cuidados intensivos fue de 6 días (rango intercuartílico: 4 a 11) y la mediana del tiempo de estancia en el hospital fue de 10 días (rango intercuartílico: 6 a 17).
Factores asociados a mortalidad por COVID-19
En el análisis bivariado se encontró que la proporción del sexo masculino fue mayor en el grupo que falleció. Además, el grupo que falleció tuvo una mayor media de edad. Con respecto a las características al ingreso, se asociaron a mayor mortalidad el requerir soporte ventilatorio y el mayor compromiso pulmonar en la tomografía. No existió asociación entre el tiempo de enfermedad al ingreso y la mortalidad (valor p = 0,9087 Wilcoxon).
Asimismo, ciertas comorbilidades se asociaron a mortalidad como hipertensión arterial, cáncer, cardiopatía isquémica, enfermedad vascular cerebral e hipotiroidismo. Luego de ajustar por edad, sexo y presión arterial de oxígeno/fracción inspirada de oxígeno, esta asociación se pierde en todas las comorbilidades.
Diversos marcadores inflamatorios como proteína C reactiva, lactato deshidrogenasa, dímero D, ferritina, lactato, entre otros, se asociaron directamente con mortalidad (Tabla 4).
Al evaluar la asociación mediante modelos de regresión de Poisson, se detectó que por cada 10 años que aumentaba la edad, el riesgo de morir se incrementó en 32% (riesgo relativo: 1,32; intervalo de confianza 95%: 1,25 a 1,38). Esta asociación se mantuvo al ajustar por sexo y presión arterial de oxígeno/fracción inspirada de oxígeno al ingreso (riesgo relativo: 1,21; intervalo de confianza 95%: 1,15 a 1,28).
Además, aquellos que ingresaron a unidad de cuidados intensivos y ventilación mecánica, tuvieron 1,39 (intervalo de confianza 95%: 1,13 a 1,69) y 1,97 (intervalo de confianza 95%: 1,69 a 2,29) veces el riesgo de morir en comparación a los que no recibieron ese soporte, luego de ajustar por edad, sexo y presión arterial de oxígeno/fracción inspirada de oxígeno al ingreso (Tabla 4).
Tabla 4. Factores asociados a mortalidad en pacientes con COVID-19 (n = 813).
Discusión
Este estudio de cohorte prospectivo se realizó con el objetivo de determinar los factores asociados a mortalidad de los pacientes adultos hospitalizados con el diagnostico de COVID-19 en un hospital de Perú. También buscó describir sus características clínicas, manejo y evolución. El número de pacientes enrolados en nuestro estudio a la fecha de redacción de este reporte es el más grande publicado a nivel nacional[17],[18]. Entre otros factores, esto se debe a la capacidad hospitalaria y a que el estudio se ejecutó durante el periodo de aumento de casos en la curva epidemiológica de pacientes diagnosticados con COVID-19, según lo reportado en la sala situacional del Ministerio de Salud[19].
En nuestro estudio se reportan características demográficas similares a las ya evidenciadas en las otras cohortes realizadas en Perú y el mundo[3],[17],[18], donde el sexo masculino presenta mayor porcentaje de hospitalizados y la media de tiempo de enfermedad es de 7 días al ingreso.
Respecto a las comorbilidades encontradas, la hipertensión arterial es la comorbilidad más frecuente seguida por diabetes y obesidad. Sin embargo, el porcentaje de obesidad descrito es bajo (25,9%) respecto a lo reportado en otros estudios (superiores al 40%) y no se encontró asociación con mayor mortalidad[17],[20]. Una explicación es el subregistro de medición del índice de masa corporal existente en las historias clínicas. La falta de personal y alta demanda de atención durante la pandemia dificultó la toma de las medidas antropométricas habituales en los pacientes hospitalizados. Esto podría explicar por qué, a diferencia de otros estudios, no encontramos una asociación entre obesidad y mortalidad.
En cuanto a los síntomas que se describieron con mayor frecuencia al ingreso fueron disnea, tos y fiebre, en contraste a lo descrito en un estudio de pacientes hospitalizados de China[21] y Reino Unido[5] donde se identificó a la fiebre como el síntoma más prevalente seguido por tos y disnea. La disnea como síntoma al ingreso más frecuente refleja que los pacientes acudieron al hospital de forma más tardía que en otros países.
La tomografía de tórax fue un método rápido de apoyo al diagnóstico en nuestro hospital debido a la falta de disponibilidad de pruebas diagnósticas[22]. Respecto a los resultados de laboratorio se evidenció leucocitosis en 62,12% de los pacientes, de los cuales 76,47% tenían linfopenia relativa con un valor por encima de lo encontrado en un estudio en China (40%)[4]. Por otro lado, en una cohorte en Estados Unidos describieron una media de proteína C reactiva de 8,35 miligramos por decilitro, asociado al resto de marcadores inflamatorios con un valor por debajo al presentado en nuestra población (17,1 miligramos por decilitro)[23]. Estos datos evidencian que la mayoría de nuestros pacientes acuden con una respuesta sistémica mayor.
En el periodo de estudio se observó que la hidroxicloroquina fue menos prescrita (11,9%) respecto a los estudios nacionales publicados. Además, existió un mayor uso de ivermectina (20,7%), esto debido a que desde el inicio de la pandemia el esquema terapéutico ha ido modificándose en las guías de manejo del Ministerio de Salud[24].
Respecto al uso de corticoterapia, más de la mitad de nuestros pacientes recibieron metilprednisolona, sin un esquema único de dosis y días de administración. La dexametasona se utilizó en la cuarta parte de nuestros pacientes. La prescripción de este corticoide se explica debido a que coincidió con el reporte preliminar de un estudio, donde se observó un beneficio en la reducción de la mortalidad a los 28 días en pacientes hospitalizados con requerimiento de ventilación mecánica o que requerían oxígeno[25]. El uso de corticoterapia en estos pacientes se debe a la respuesta inflamatoria sistémica observada en los pacientes con COVID-19. Sin embargo, datos actuales mencionan que el nivel de citoquinas circulantes es mucho menor que la observada en otras entidades como shock séptico, trauma múltiple o arresto cardiaco[26].
El uso de anticoagulación en esta enfermedad se ha justificado en múltiples reportes de eventos tromboembólicos en los pacientes hospitalizados con COVID-19, y a su potencial beneficio en el aumento de la sobrevida en los pacientes críticos. No obstante, también se reporta un número alto de eventos de sangrado mayor, por lo que la indicación debería de ser individualizada[27]. Más de la mitad de nuestros pacientes recibió algún tipo de esquema de anticoagulación y no se reportó ningún evento de sangrado mayor asociado a anticoagulación.
Con relación a las reacciones adversas a medicamentos, el perfil de seguridad de los medicamentos utilizados en nuestra cohorte (como la hidroxicloroquina sola o en combinación con azitromicina), describe el riesgo cardiológico de la prolongación del intervalo QT[28] que se incrementa con el uso concomitante de antibióticos, antiarrítmicos, anestésicos, relajantes musculares, entre otros. Además, se han reportado otros efectos adversos como toxicidad hepática, dolor abdominal, diarreas, náuseas y/o vómitos[29]. La evaluación de las reacciones adversas en el contexto de enfermedades nuevas como COVID-19 requiere de farmacovigilancia intensiva que no fue realizada en el presente estudio. Sin embargo, esta se está realizando por el Centro de Referencia Institucional de Farmacovigilancia y Tecnovigilancia del Seguro Social de Salud[30].
Respecto a las complicaciones intrahospitalarias, se observó que la reportada con más frecuencia fue la neumonía bacteriana en un 26,5%. Este dato contrasta con el porcentaje de pacientes que recibieron algún esquema antibiótico por sospecha de infección intrahospitalaria, que en la mayoría no se logró identificar un germen (36,4%). Una revisión sistemática consignó una baja prevalencia de coinfección bacteriana en pacientes hospitalizados con COVID-19, identificándose en 3,5 % al ingreso y en 15,5% durante hospitalización. Dicho estudio concluyó que el uso de tratamiento antibiótico empírico no está justificado en la mayoría de pacientes hospitalizados con COVID-19[31].Este es un aspecto que debemos tener presente, ya que la resistencia bacteriana podría ser uno de los principales problemas en el futuro cercano.
En nuestro estudio se reporta que solo 4,7% de nuestros pacientes ingresaron a unidad de cuidados intensivos y 14% recibieron soporte ventilatorio. Esto podría explicarse por la disponibilidad de ventilador mecánico en áreas que no corresponden a unidad de cuidados intensivos dentro del área de emergencia del hospital de estudio. Aun así, sólo el 14 % de nuestros pacientes recibió soporte de ventilación mecánica. Este reporte es similar a lo reportado en estudios nacionales (10,18% y 16,1%)[17],[18] e inferior a lo reportado en los estudios internacionales realizados en países de altos ingresos[3],[4],[5],[6]. La explicación a esto es que, debido al colapso de nuestro sistema sanitario, no todos los pacientes que requirieron ingreso a unidad de cuidados intensivos pudieron acceder a soporte ventilatorio.
La mortalidad encontrada es alta (46,4%) y muy superior a la reportado en las cohortes de New York (39%), Wuhan (28%) y Londres (29%)[3],[4],[5]. Este fenómeno puede atribuirse al estado crítico de ingreso, la falta de acceso a ventiladores, insuficientes camas de unidad de cuidados intensivos y por otros potenciales factores asociados a mortalidad que se han tratado de identificar en estudios previos[17],[18],[32].
Entre los factores asociados a mortalidad, se describe que hubo mayor proporción de fallecidos del sexo masculino (72,4%). Lo descrito coincide con una revisión sistemática que mostró un riesgo de mortalidad significativo para el sexo masculino respecto al femenino (riesgo relativo: 1,86)[16]. Un estudio de cohorte en China reportó un riesgo menor de muerte en el sexo femenino (Odds ratio: 0,44; intervalo de confianza 95%: 0,34 a 0,58) después de ajustar por edad y comorbilidades[33]. Sin embargo, al realizar el análisis ajustado no se encontró asociación. Una posible explicación es que la proporción entre ambos sexos es disímil entre los distintos grupos etarios, tal como lo planteado en el estudio de Bhopal SS y Bhopal R[34].
La edad se asoció a mayor mortalidad. En nuestra serie la mayor proporción de fallecidos correspondieron a los grupos etarios mayores de 60 años. Por cada 10 años que aumentaba la edad, el riesgo de morir se incrementó en 32%. Esto también fue descrito en una serie grande de datos poblacionales chinos en la cual los grupos etarios de 60 a 69, de 70 a 79 y mayores de 80 años tuvieron 3,6, 8 y 14,8% de mortalidad respectivamente[35].
El presente estudio encontró asociación entre la mortalidad y distintos marcados proinflamatorios (proteína C reactiva, ferritina, lactato deshidrogenasa, leucocitosis), los que pueden servir como biomarcadores tempranos de severidad en COVID-19[36]. Además, hallamos una asociación entre mortalidad y la hipoxemia al ingreso y con el requerimiento de oxigenoterapia, sobre todo en aquellos pacientes que necesitaron máscara de reservorio o ventilación mecánica. Esto se evidencia en una cohorte retrospectiva en la que 68% de pacientes con valores de saturación periférica de oxígeno de 90% o menos, no sobrevivieron después de la suplementación con oxígeno. En tanto, 98% de aquellos pacientes con valores de saturación parcial de oxígeno superiores al 90% sí sobrevivieron (log-rank P < 0,001)[37].
La saturación parcial de oxígeno al ingreso también fue un predictor de mortalidad. En nuestra serie aquellos pacientes que ingresaron con saturación parcial de oxígeno inferior a 80% tuvieron mayor mortalidad que aquellos que entraron con mayor a 90%. En otros estudios no se describen saturaciones parciales de oxígeno tan bajas al ingreso, lo cual podría ser explicado por el retraso de los pacientes en acudir al servicio de emergencia y el colapso de este servicio con altas demoras en la atención[38].
Es importante realizar estudios adicionales en nuestra región que concentren mayor cantidad de pacientes y analicen los factores asociados a mortalidad en COVID-19. Con esos resultados es posible realizar una reorganización del sistema de atención de salud, direccionando un manejo diferenciado en los pacientes con mayores factores de riesgo de mortalidad. El establecimiento de estas medidas es fundamental en las regiones de Latinoamérica donde aún hay baja cobertura de los programas de vacunación, producto de la escasez de este medio de prevención.
Nuestro estudio tiene diversas fortalezas. Este se realizó en el hospital referencial de atención de pacientes con COVID-19 que cuenta con la mayor capacidad hospitalaria de la seguridad social de Perú. Asimismo, se efectuó un registro sistemático con los datos de los pacientes desde su ingreso a emergencia hasta su destino final, mediante el sistema electrónico de historia clínica. Dicho sistema contiene el registro de los datos clínicos, exámenes de laboratorio e imagenológicos realizados. Sin embargo, tiene ciertas limitaciones ya que al ser un estudio en que los datos se obtuvieron del sistema electrónico, existió un registro incompleto de algunas variables (reacciones adversas a medicamentos, hábitos nocivos e índice de masa corporal) que podrían afectar la validez externa de los resultados obtenidos respecto de ellas.
Conclusión
Se reporta la serie más grande de pacientes hospitalizados con COVID-19 en Perú. La población evaluada presentó una alta mortalidad (46,4%), lo que difiere a lo reportado previamente en países desarrollados.
La mortalidad se asoció a la edad (mayores de 60 años), a marcadores inflamatorios y al compromiso respiratorio.
Por último, es necesaria una reorganización del sistema de atención hospitalario direccionando un manejo diferenciado en los pacientes con mayores factores de riesgo de mortalidad.
Notas
Contribuciones de autores
MAV, PO, LEVE, MV, JML, EMR, JO, CM, LJSL, AT, RMD, RC: concepción, recolección de datos, diseño, análisis e interpretación de datos, revisión del artículo y aprobación de la versión final. JJPR: concepción y diseño del artículo, análisis e interpretación de datos, revisión crítica del artículo y aprobación de la versión final. JHZT: análisis e interpretación de datos, revisión crítica del artículo y aprobación de la versión final.
Agradecimientos
A todo el personal que labora en el Hospital Nacional Edgardo Rebagliati Martins, quienes se mantienen firmes en la primera línea de atención durante esta pandemia. Además, al departamento de emergencia por todo el apoyo brindado desde el inicio de este proyecto y al servicio de imagenología y laboratorio clínico por su importante labor en el apoyo al diagnóstico de los pacientes con COVID-19.
Conflicto de intereses
Los autores completaron la declaración de conflictos de interés de ICMJE y declararon la ausencia de cualquier relación comercial y de financiamiento que pueda originar un posible conflicto de interés. Los formularios se pueden solicitar contactando al autor corresponsal o al Comité Editorial de la Revista.
Fuentes de financiamiento
El presente trabajo ha sido autofinanciado.
Consideraciones éticas
El presente estudio se realizó en concordancia con las Pautas éticas internacionales para la investigación relacionada con la salud con seres humanos, Cuarta Edición. Ginebra. Los autores declaran tener la aprobación por el Comité de Ética en Investigación para COVID-19 de EsSalud. El protocolo fue registrado en la plataforma PRISA (Proyectos de Investigación en Salud) del Instituto Nacional de Salud de Perú, de acuerdo al DS 014-2020-SA el cual establece el registro obligatorio de las investigaciones científicas de la enfermedad COVID-19.
Disponibilidad de los datos
Los datos utilizados para el estudio se encuentran disponibles previa solicitud al autor corresponsal.
Idioma del envío original
Español.

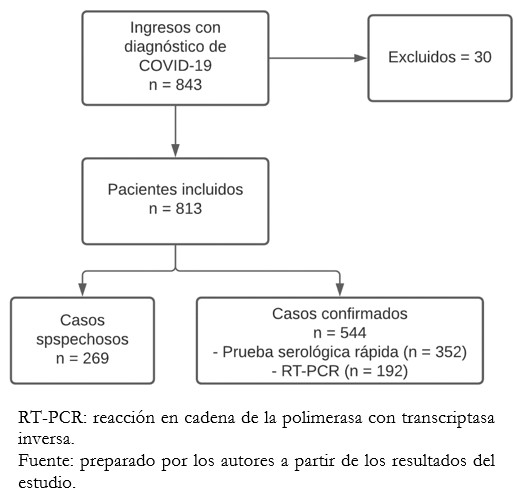 Figura 1. Diagrama de flujo de participantes del estudio.
Figura 1. Diagrama de flujo de participantes del estudio.

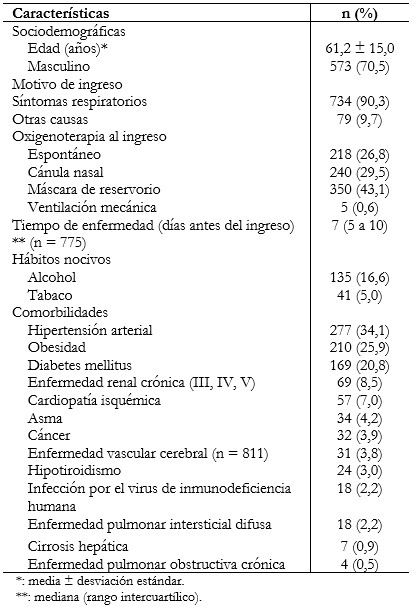 Tabla 1. Características de pacientes con COVID-19 (n = 813).
Tabla 1. Características de pacientes con COVID-19 (n = 813).

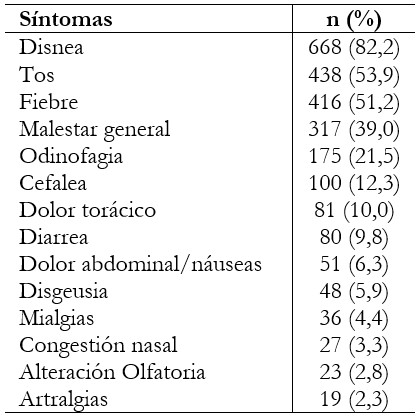 Tabla 2. Síntomas de pacientes con COVID-19 (n = 813).
Tabla 2. Síntomas de pacientes con COVID-19 (n = 813).

 Tabla 3. Estudios de laboratorio en pacientes con COVID-19 (n = 813).
Tabla 3. Estudios de laboratorio en pacientes con COVID-19 (n = 813).

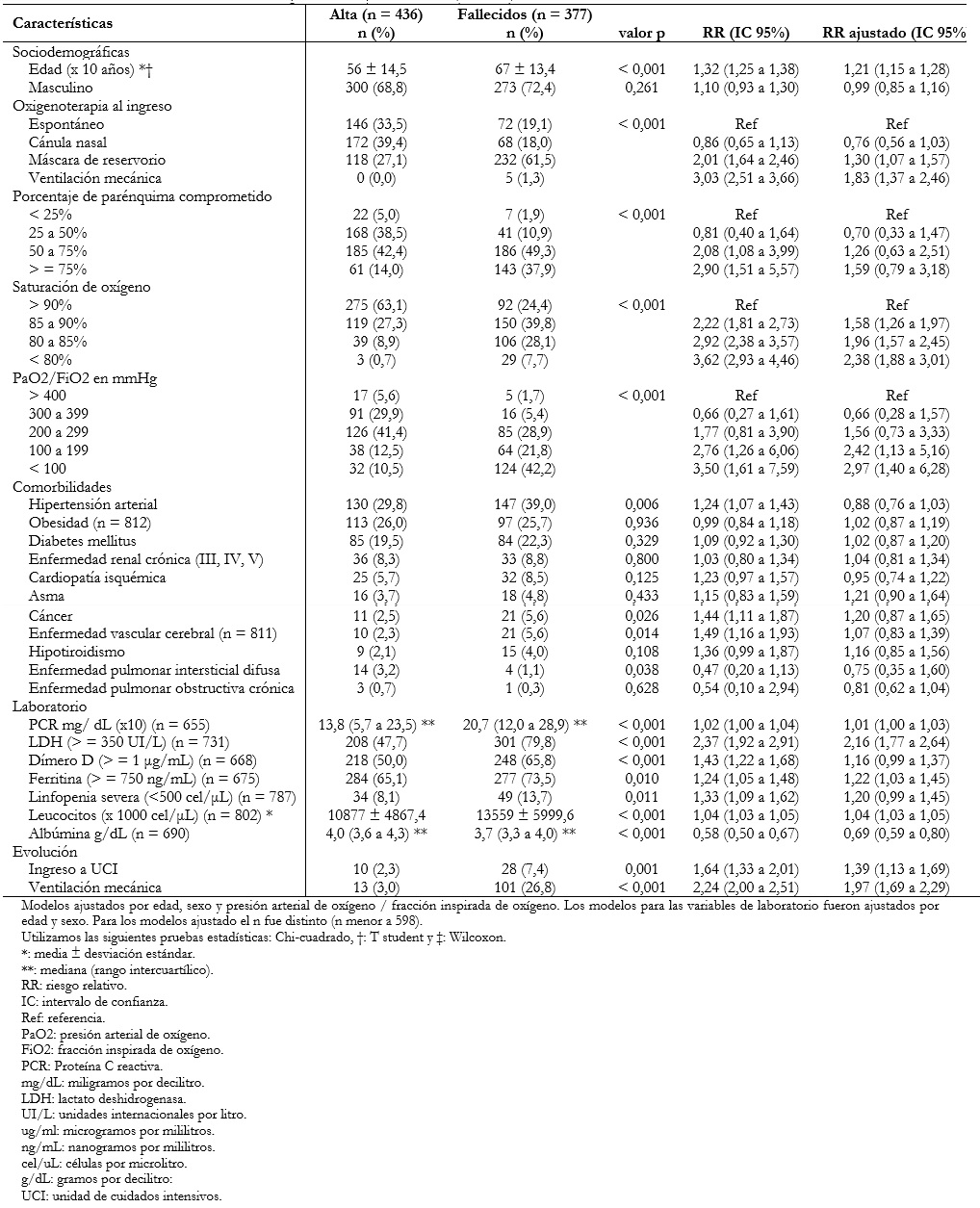 Tabla 4. Factores asociados a mortalidad en pacientes con COVID-19 (n = 813).
Tabla 4. Factores asociados a mortalidad en pacientes con COVID-19 (n = 813).

Objetivos
Describir las características clínicas y evaluar los factores asociados con la mortalidad de los pacientes adultos con la nueva enfermedad causada por coronavirus 2019 (COVID-19) ingresados a un hospital de referencia nacional de Perú.
Métodos
Se realizó un estudio de cohorte prospectivo. Se incluyó a pacientes mayores de 18 años hospitalizados con el diagnóstico de infección por coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2). Se excluyó a quienes ingresaron con prueba rápida serológica positiva al ingreso, sin clínica sugestiva ni imágenes compatibles. Los datos se recolectaron a partir de la historia clínica.
Resultados
Se incluyó un total de 813 adultos, 544 (66,9%) tuvieron COVID-19 confirmado. La media de la edad fue de 61,2 años (desviación estándar: 15) y 575 (70,5%) fueron de sexo masculino. Las comorbilidades más frecuentes fueron hipertensión arterial (34,1%) y obesidad (25,9%). Los síntomas más frecuentes al ingreso fueron disnea (82,2%) y tos (53,9%). Un total de 114 (14%) pacientes recibieron ventilación mecánica, 38 (4,7%) ingresaron a unidad de cuidados intensivos y 377 (46,4%) fallecieron. Se asociaron a la mortalidad el requerimiento de soporte ventilatorio, el mayor compromiso pulmonar y los marcadores inflamatorios. Encontramos que por cada 10 años que aumentó la edad, el riesgo de morir se incrementó en 32% (riesgo relativo: 1,32; intervalo de confianza 95%: 1,25 a 1,38). Aquellos pacientes que requirieron ingreso a unidad de cuidados intensivos y ventilación mecánica tuvieron 1,39 (intervalo de confianza 95%: 1,13 a 1,69) y 1,97 (intervalo de confianza 95%: 1,69 a 2,29) veces el riesgo de morir, respectivamente.
Conclusión
La mortalidad encontrada en nuestro estudio fue alta y estuvo asociada a la edad, marcadores inflamatorios y compromiso respiratorio.
 Authors:
Miguel A Vences[1], Juan J Pareja-Ramos[2], Paula Otero[2], Liz E Veramendi-Espinoza[3], Melissa Vega-Villafana[2], Julissa Mogollón-Lavi[2], Eduardo Morales-Romero[4], Josseline Olivera-Vera[2], Carol Meza[5], Lucía J Salas-Lazo[5], Andy Triveño[6], Renzo Marín-Dávalos[7], Ricardo Carpio Rodriguez[2], Jessica H Zafra-Tanaka[8]
Authors:
Miguel A Vences[1], Juan J Pareja-Ramos[2], Paula Otero[2], Liz E Veramendi-Espinoza[3], Melissa Vega-Villafana[2], Julissa Mogollón-Lavi[2], Eduardo Morales-Romero[4], Josseline Olivera-Vera[2], Carol Meza[5], Lucía J Salas-Lazo[5], Andy Triveño[6], Renzo Marín-Dávalos[7], Ricardo Carpio Rodriguez[2], Jessica H Zafra-Tanaka[8]
Affiliation:
[1] Departamento de Neurología, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
[2] Departamento de Medicina Interna, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
[3] Departamento de Especialidades Clínicas, Hospital Nacional Edgardo Rebagliati Martins, Essalud, Lima, Perú
[4] Departamento de Cirugía General y Aparato Digestivo, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
[5] Servicio de Cirugía de Cabeza, Cuello y Maxilofacial, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
[6] Servicio de Cirugía de Otorrinolaringología, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
[7] Departamento de Emergencia, Hospital Nacional Edgardo Rebagliati Martins, EsSalud, Lima, Perú
[8] Escuela de Medicina, Universidad Científica del Sur, Lima, Perú
E-mail: vens1793@hotmail.com
Author address:
[1] Avenida Rebagliati 490 Jesús María Lima, Perú

Citation: Vences MA, Pareja-Ramos JJ, Otero P, Veramendi-Espinoza LE, Vega-Villafana M, Mogollón-Lavi J, et al. Factors associated with mortality in patients hospitalized with COVID-19: A prospective cohort in a Peruvian national referral hospital. Medwave 2021;21(6):e8231 doi: 10.5867/medwave.2021.06.8231
Submission date: 2/1/2021
Acceptance date: 11/5/2021
Publication date: 5/7/2021
Origin: Not commissioned
Type of review: Externally peer-reviewed by three reviewers, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- World Health Organization. Weekly epidemiological update - 29 December 2020. Geneve: World Health Organization; 2020. [On line]. | Link |
- Bernard S, Blood D, Burn-Murdoch J, Elliot O, Harlow M, Kao JS, et al. Coronavirus tracker: the latest figures as countries fight the Covid-19 resurgence. FT. 2021. [On line]. | Link |
- Cummings MJ, Baldwin MR, Abrams D, Jacobson SD, Meyer BJ, Balough EM, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet. 2020 Jun 6;395(10239):1763-1770. | CrossRef | PubMed |
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062. | CrossRef | PubMed |
- Perez-Guzman PN, Daunt A, Mukherjee S, Crook P, Forlano R, Kont MD, et al. Report 17: Clinical Characteristics and Predictors of Outcomes of Hospitalized Patients With Coronavirus Disease 2019 in a Multiethnic London National Health Service Trust: A Retrospective Cohort Study. Imperial College London COVID-19. | CrossRef |
- Grasselli G, Greco M, Zanella A, Albano G, Antonelli M, Bellani G, et al. Risk Factors Associated With Mortality Among Patients With COVID-19 in Intensive Care Units in Lombardy, Italy. JAMA Intern Med. 2020 Oct 1;180(10):1345-1355. | CrossRef | PubMed |
- Silverio A, Di Maio M, Citro R, Esposito L, Iuliano G, Bellino M, et al. Cardiovascular risk factors and mortality in hospitalized patients with COVID-19: systematic review and meta-analysis of 45 studies and 18,300 patients. BMC Cardiovasc Disord. 2021 Jan 7;21(1):23. | CrossRef | PubMed |
- Li J, Huang DQ, Zou B, Yang H, Hui WZ, Rui F, et al. Epidemiology of COVID-19: A systematic review and meta-analysis of clinical characteristics, risk factors, and outcomes. J Med Virol. 2021 Mar;93(3):1449-1458. | CrossRef | PubMed |
- Araujo M, Ossandón P, Abarca AM, Menjiba AM, Muñoz AM. Pronóstico de pacientes hospitalizados por COVID-19 en un centro terciario en Chile: estudio de cohorte [Prognosis of patients with COVID-19 admitted to a tertiary center in Chile: A cohort study]. Medwave. 2020 Nov 17;20(10):e8066. | CrossRef | PubMed |
- Ortiz-Prado E, Simbaña-Rivera K, Barreno LG, Diaz AM, Barreto A, Moyano C, et al. Epidemiological, socio-demographic and clinical features of the early phase of the COVID-19 epidemic in Ecuador. PLoS Negl Trop Dis. 2021 Jan 4;15(1):e0008958. | CrossRef | PubMed |
- Schönfeld D, Arias S, Bossio JC, Fernández H, Gozal D, Pérez-Chada D. Clinical presentation and outcomes of the first patients with COVID-19 in Argentina: Results of 207079 cases from a national database. PLoS One. 2021 Feb 11;16(2):e0246793. | CrossRef | PubMed |
- Ministerio de Salud de Perú, Centro Nacional de Epidemiología, Prevención y Control de Enfermedades. Alerta Epidemiológica N°19. MINSA; 2020. [On line]. | Link |
- Prokop M, van Everdingen W, van Rees Vellinga T, Quarles van Ufford H, Stöger L, Beenen L, et al. CO-RADS: A Categorical CT Assessment Scheme for Patients Suspected of Having COVID-19-Definition and Evaluation. Radiology. 2020 Aug;296(2):E97-E104. | CrossRef | PubMed |
- Howell DC. The treatment of missing data. En: The Sage handbook of social science methodology. London: Sage; 2008:208-224.
- Barros AJ, Hirakata VN. Alternatives for logistic regression in cross-sectional studies: an empirical comparison of models that directly estimate the prevalence ratio. BMC Med Res Methodol. 2003 Oct 20;3:21. | CrossRef | PubMed |
- Biswas M, Rahaman S, Biswas TK, Haque Z, Ibrahim B. Association of Sex, Age, and Comorbidities with Mortality in COVID-19 Patients: A Systematic Review and Meta-Analysis. INT. 2021;64(1):36-47. | CrossRef |
- Mejía F, Medina C, Cornejo E, Morello E, Vásquez S, Alave J, et al. Oxygen saturation as a predictor of mortality in hospitalized adult patients with COVID-19 in a public hospital in Lima, Peru. PLoS One. 2020 Dec 28;15(12):e0244171. | CrossRef | PubMed |
- Rodriguez-Zuniga MJM, Quintana-Aquehua A, Díaz-Lajo VH, Charaja-Coata KS, Becerra-Bonilla WS, Cueva-Tovar K, et al. Risk factors for in-hospital mortality in SARS-CoV-2 pneumonia adult patients from Lima, Peru. Acta Med Peru. 2020;37(4). | CrossRef |
- Ministerio de Salud de Perú, Instituto Nacional de Salud y Centro Nacional de Epidemiología, Prevención y Control de Enfermedades. Sala Situacional COVID-19 Perú. 2021. [On line]. | Link |
- Lighter J, Phillips M, Hochman S, Sterling S, Johnson D, Francois F, et al. Obesity in Patients Younger Than 60 Years Is a Risk Factor for COVID-19 Hospital Admission. Clin Infect Dis. 2020 Jul 28;71(15):896-897. | CrossRef | PubMed |
- Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020 May;8(5):475-481. | CrossRef | PubMed |
- Pareja-Ramos JJ, Anicama SE, Perez-Urrutia P, Pecho-Silva S, Amado J. Importance of the implementation of the chest tomography to contribute to the early diagnosis and timely triage of patients with COVID-19 in Peruvian hospitals. Acta Med Peru. 2020;37(2). | CrossRef |
- Palaiodimos L, Kokkinidis DG, Li W, Karamanis D, Ognibene J, Arora S, et al. Severe obesity, increasing age and male sex are independently associated with worse in-hospital outcomes, and higher in-hospital mortality, in a cohort of patients with COVID-19 in the Bronx, New York. Metabolism. 2020 Jul;108:154262. | CrossRef | PubMed |
- Ministerio de Salud de Perú. Documento Técnico: Prevención y atención de personas afectadas por COVID-19 en el Perú. 2020. [On line]. | Link |
- RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021 Feb 25;384(8):693-704. | CrossRef | PubMed |
- Kox M, Waalders NJB, Kooistra EJ, Gerretsen J, Pickkers P. Cytokine Levels in Critically Ill Patients With COVID-19 and Other Conditions. JAMA. 2020 Sep 3;324(15):1565–7. | CrossRef | PubMed |
- Paranjpe I, Fuster V, Lala A, Russak AJ, Glicksberg BS, Levin MA, et al. Association of Treatment Dose Anticoagulation With In-Hospital Survival Among Hospitalized Patients With COVID-19. J Am Coll Cardiol. 2020 Jul 7;76(1):122-124. | CrossRef | PubMed |
- Chorin E, Wadhwani L, Magnani S, Dai M, Shulman E, Nadeau-Routhier C, et al. QT interval prolongation and torsade de pointes in patients with COVID-19 treated with hydroxychloroquine/azithromycin. Heart Rhythm. 2020 Sep;17(9):1425-1433. | CrossRef | PubMed |
- Mercuro NJ, Yen CF, Shim DJ, Maher TR, McCoy CM, Zimetbaum PJ, et al. Risk of QT Interval Prolongation Associated With Use of Hydroxychloroquine With or Without Concomitant Azithromycin Among Hospitalized Patients Testing Positive for Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020 Sep 1;5(9):1036-1041. | CrossRef | PubMed |
- Rodríguez Tanta LY, Fernández Rojas P, Solis Yucra T. Protocolo de Farmacovigilancia Intensiva N°03 "Cloroquina, Hidroxicloroquina y Azitromicina como tratamiento para casos de COVID-19 moderado y severo". Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI), Centro de Referencia Institucional de Farmacovigilancia y Tecnovigilancia EsSalud: 2020. [On line]. | Link |
- Langford BJ, So M, Raybardhan S, Leung V, Westwood D, MacFadden DR, et al. Bacterial co-infection and secondary infection in patients with COVID-19: a living rapid review and meta-analysis. Clin Microbiol Infect. 2020 Dec;26(12):1622-1629. | CrossRef | PubMed |
- Acosta G, Escobar G, Bernaola G, Alfaro J, Taype W, Marcos C, et al. Description of patients with severe COVID-19 treated in a national referral hospital in Peru. Rev Peru Med Exp Salud Publica. 2020 Apr-Jun;37(2):253-258. | CrossRef | PubMed |
- Chen J, Bai H, Liu J, Chen G, Liao Q, Yang J, et al. Distinct Clinical Characteristics and Risk Factors for Mortality in Female Inpatients With Coronavirus Disease 2019 (COVID-19): A Sex-stratified, Large-scale Cohort Study in Wuhan, China. Clin Infect Dis. 2020 Dec 15;71(12):3188-3195. | CrossRef | PubMed |
- Bhopal SS, Bhopal R. Sex differential in COVID-19 mortality varies markedly by age. Lancet. 2020 Aug 22;396(10250):532-533. | CrossRef | PubMed |
- Epidemiology Working Group for NCIP Epidemic Response, Chinese Center for Disease Control and Prevention. [The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China]. Zhonghua Liu Xing Bing Xue Za Zhi. 2020 Feb 10;41(2):145-151. | CrossRef | PubMed |
- Malik P, Patel U, Mehta D, Patel N, Kelkar R, Akrmah M, et al. Biomarkers and outcomes of COVID-19 hospitalisations: systematic review and meta-analysis. BMJ Evid Based Med. 2021 Jun;26(3):107-108. | CrossRef | PubMed |
- Petrilli CM, Jones SA, Yang J, Rajagopalan H, O'Donnell L, Chernyak Y, et al. Factors associated with hospital admission and critical illness among 5279 people with coronavirus disease 2019 in New York City: prospective cohort study. BMJ. 2020 May 22;369:m1966. | CrossRef | PubMed |
- Kangelaris KN, Ware LB, Wang CY, Janz DR, Zhuo H, Matthay MA, et al. Timing of Intubation and Clinical Outcomes in Adults With Acute Respiratory Distress Syndrome. Crit Care Med. 2016 Jan;44(1):120-9. | CrossRef | PubMed |
 World Health Organization. Weekly epidemiological update - 29 December 2020. Geneve: World Health Organization; 2020. [On line]. | Link |
World Health Organization. Weekly epidemiological update - 29 December 2020. Geneve: World Health Organization; 2020. [On line]. | Link | Bernard S, Blood D, Burn-Murdoch J, Elliot O, Harlow M, Kao JS, et al. Coronavirus tracker: the latest figures as countries fight the Covid-19 resurgence. FT. 2021. [On line]. | Link |
Bernard S, Blood D, Burn-Murdoch J, Elliot O, Harlow M, Kao JS, et al. Coronavirus tracker: the latest figures as countries fight the Covid-19 resurgence. FT. 2021. [On line]. | Link | Cummings MJ, Baldwin MR, Abrams D, Jacobson SD, Meyer BJ, Balough EM, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet. 2020 Jun 6;395(10239):1763-1770. | CrossRef | PubMed |
Cummings MJ, Baldwin MR, Abrams D, Jacobson SD, Meyer BJ, Balough EM, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet. 2020 Jun 6;395(10239):1763-1770. | CrossRef | PubMed | Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062. | CrossRef | PubMed |
Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062. | CrossRef | PubMed | Perez-Guzman PN, Daunt A, Mukherjee S, Crook P, Forlano R, Kont MD, et al. Report 17: Clinical Characteristics and Predictors of Outcomes of Hospitalized Patients With Coronavirus Disease 2019 in a Multiethnic London National Health Service Trust: A Retrospective Cohort Study. Imperial College London COVID-19. | CrossRef |
Perez-Guzman PN, Daunt A, Mukherjee S, Crook P, Forlano R, Kont MD, et al. Report 17: Clinical Characteristics and Predictors of Outcomes of Hospitalized Patients With Coronavirus Disease 2019 in a Multiethnic London National Health Service Trust: A Retrospective Cohort Study. Imperial College London COVID-19. | CrossRef | Grasselli G, Greco M, Zanella A, Albano G, Antonelli M, Bellani G, et al. Risk Factors Associated With Mortality Among Patients With COVID-19 in Intensive Care Units in Lombardy, Italy. JAMA Intern Med. 2020 Oct 1;180(10):1345-1355. | CrossRef | PubMed |
Grasselli G, Greco M, Zanella A, Albano G, Antonelli M, Bellani G, et al. Risk Factors Associated With Mortality Among Patients With COVID-19 in Intensive Care Units in Lombardy, Italy. JAMA Intern Med. 2020 Oct 1;180(10):1345-1355. | CrossRef | PubMed | Silverio A, Di Maio M, Citro R, Esposito L, Iuliano G, Bellino M, et al. Cardiovascular risk factors and mortality in hospitalized patients with COVID-19: systematic review and meta-analysis of 45 studies and 18,300 patients. BMC Cardiovasc Disord. 2021 Jan 7;21(1):23. | CrossRef | PubMed |
Silverio A, Di Maio M, Citro R, Esposito L, Iuliano G, Bellino M, et al. Cardiovascular risk factors and mortality in hospitalized patients with COVID-19: systematic review and meta-analysis of 45 studies and 18,300 patients. BMC Cardiovasc Disord. 2021 Jan 7;21(1):23. | CrossRef | PubMed | Li J, Huang DQ, Zou B, Yang H, Hui WZ, Rui F, et al. Epidemiology of COVID-19: A systematic review and meta-analysis of clinical characteristics, risk factors, and outcomes. J Med Virol. 2021 Mar;93(3):1449-1458. | CrossRef | PubMed |
Li J, Huang DQ, Zou B, Yang H, Hui WZ, Rui F, et al. Epidemiology of COVID-19: A systematic review and meta-analysis of clinical characteristics, risk factors, and outcomes. J Med Virol. 2021 Mar;93(3):1449-1458. | CrossRef | PubMed | Araujo M, Ossandón P, Abarca AM, Menjiba AM, Muñoz AM. Pronóstico de pacientes hospitalizados por COVID-19 en un centro terciario en Chile: estudio de cohorte [Prognosis of patients with COVID-19 admitted to a tertiary center in Chile: A cohort study]. Medwave. 2020 Nov 17;20(10):e8066. | CrossRef | PubMed |
Araujo M, Ossandón P, Abarca AM, Menjiba AM, Muñoz AM. Pronóstico de pacientes hospitalizados por COVID-19 en un centro terciario en Chile: estudio de cohorte [Prognosis of patients with COVID-19 admitted to a tertiary center in Chile: A cohort study]. Medwave. 2020 Nov 17;20(10):e8066. | CrossRef | PubMed | Ortiz-Prado E, Simbaña-Rivera K, Barreno LG, Diaz AM, Barreto A, Moyano C, et al. Epidemiological, socio-demographic and clinical features of the early phase of the COVID-19 epidemic in Ecuador. PLoS Negl Trop Dis. 2021 Jan 4;15(1):e0008958. | CrossRef | PubMed |
Ortiz-Prado E, Simbaña-Rivera K, Barreno LG, Diaz AM, Barreto A, Moyano C, et al. Epidemiological, socio-demographic and clinical features of the early phase of the COVID-19 epidemic in Ecuador. PLoS Negl Trop Dis. 2021 Jan 4;15(1):e0008958. | CrossRef | PubMed | Schönfeld D, Arias S, Bossio JC, Fernández H, Gozal D, Pérez-Chada D. Clinical presentation and outcomes of the first patients with COVID-19 in Argentina: Results of 207079 cases from a national database. PLoS One. 2021 Feb 11;16(2):e0246793. | CrossRef | PubMed |
Schönfeld D, Arias S, Bossio JC, Fernández H, Gozal D, Pérez-Chada D. Clinical presentation and outcomes of the first patients with COVID-19 in Argentina: Results of 207079 cases from a national database. PLoS One. 2021 Feb 11;16(2):e0246793. | CrossRef | PubMed | Ministerio de Salud de Perú, Centro Nacional de Epidemiología, Prevención y Control de Enfermedades. Alerta Epidemiológica N°19. MINSA; 2020. [On line]. | Link |
Ministerio de Salud de Perú, Centro Nacional de Epidemiología, Prevención y Control de Enfermedades. Alerta Epidemiológica N°19. MINSA; 2020. [On line]. | Link | Prokop M, van Everdingen W, van Rees Vellinga T, Quarles van Ufford H, Stöger L, Beenen L, et al. CO-RADS: A Categorical CT Assessment Scheme for Patients Suspected of Having COVID-19-Definition and Evaluation. Radiology. 2020 Aug;296(2):E97-E104. | CrossRef | PubMed |
Prokop M, van Everdingen W, van Rees Vellinga T, Quarles van Ufford H, Stöger L, Beenen L, et al. CO-RADS: A Categorical CT Assessment Scheme for Patients Suspected of Having COVID-19-Definition and Evaluation. Radiology. 2020 Aug;296(2):E97-E104. | CrossRef | PubMed | Howell DC. The treatment of missing data. En: The Sage handbook of social science methodology. London: Sage; 2008:208-224.
Howell DC. The treatment of missing data. En: The Sage handbook of social science methodology. London: Sage; 2008:208-224.  Barros AJ, Hirakata VN. Alternatives for logistic regression in cross-sectional studies: an empirical comparison of models that directly estimate the prevalence ratio. BMC Med Res Methodol. 2003 Oct 20;3:21. | CrossRef | PubMed |
Barros AJ, Hirakata VN. Alternatives for logistic regression in cross-sectional studies: an empirical comparison of models that directly estimate the prevalence ratio. BMC Med Res Methodol. 2003 Oct 20;3:21. | CrossRef | PubMed | Biswas M, Rahaman S, Biswas TK, Haque Z, Ibrahim B. Association of Sex, Age, and Comorbidities with Mortality in COVID-19 Patients: A Systematic Review and Meta-Analysis. INT. 2021;64(1):36-47. | CrossRef |
Biswas M, Rahaman S, Biswas TK, Haque Z, Ibrahim B. Association of Sex, Age, and Comorbidities with Mortality in COVID-19 Patients: A Systematic Review and Meta-Analysis. INT. 2021;64(1):36-47. | CrossRef | Mejía F, Medina C, Cornejo E, Morello E, Vásquez S, Alave J, et al. Oxygen saturation as a predictor of mortality in hospitalized adult patients with COVID-19 in a public hospital in Lima, Peru. PLoS One. 2020 Dec 28;15(12):e0244171. | CrossRef | PubMed |
Mejía F, Medina C, Cornejo E, Morello E, Vásquez S, Alave J, et al. Oxygen saturation as a predictor of mortality in hospitalized adult patients with COVID-19 in a public hospital in Lima, Peru. PLoS One. 2020 Dec 28;15(12):e0244171. | CrossRef | PubMed | Rodriguez-Zuniga MJM, Quintana-Aquehua A, Díaz-Lajo VH, Charaja-Coata KS, Becerra-Bonilla WS, Cueva-Tovar K, et al. Risk factors for in-hospital mortality in SARS-CoV-2 pneumonia adult patients from Lima, Peru. Acta Med Peru. 2020;37(4). | CrossRef |
Rodriguez-Zuniga MJM, Quintana-Aquehua A, Díaz-Lajo VH, Charaja-Coata KS, Becerra-Bonilla WS, Cueva-Tovar K, et al. Risk factors for in-hospital mortality in SARS-CoV-2 pneumonia adult patients from Lima, Peru. Acta Med Peru. 2020;37(4). | CrossRef | Ministerio de Salud de Perú, Instituto Nacional de Salud y Centro Nacional de Epidemiología, Prevención y Control de Enfermedades. Sala Situacional COVID-19 Perú. 2021. [On line]. | Link |
Ministerio de Salud de Perú, Instituto Nacional de Salud y Centro Nacional de Epidemiología, Prevención y Control de Enfermedades. Sala Situacional COVID-19 Perú. 2021. [On line]. | Link | Lighter J, Phillips M, Hochman S, Sterling S, Johnson D, Francois F, et al. Obesity in Patients Younger Than 60 Years Is a Risk Factor for COVID-19 Hospital Admission. Clin Infect Dis. 2020 Jul 28;71(15):896-897. | CrossRef | PubMed |
Lighter J, Phillips M, Hochman S, Sterling S, Johnson D, Francois F, et al. Obesity in Patients Younger Than 60 Years Is a Risk Factor for COVID-19 Hospital Admission. Clin Infect Dis. 2020 Jul 28;71(15):896-897. | CrossRef | PubMed | Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020 May;8(5):475-481. | CrossRef | PubMed |
Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020 May;8(5):475-481. | CrossRef | PubMed | Pareja-Ramos JJ, Anicama SE, Perez-Urrutia P, Pecho-Silva S, Amado J. Importance of the implementation of the chest tomography to contribute to the early diagnosis and timely triage of patients with COVID-19 in Peruvian hospitals. Acta Med Peru. 2020;37(2). | CrossRef |
Pareja-Ramos JJ, Anicama SE, Perez-Urrutia P, Pecho-Silva S, Amado J. Importance of the implementation of the chest tomography to contribute to the early diagnosis and timely triage of patients with COVID-19 in Peruvian hospitals. Acta Med Peru. 2020;37(2). | CrossRef | Palaiodimos L, Kokkinidis DG, Li W, Karamanis D, Ognibene J, Arora S, et al. Severe obesity, increasing age and male sex are independently associated with worse in-hospital outcomes, and higher in-hospital mortality, in a cohort of patients with COVID-19 in the Bronx, New York. Metabolism. 2020 Jul;108:154262. | CrossRef | PubMed |
Palaiodimos L, Kokkinidis DG, Li W, Karamanis D, Ognibene J, Arora S, et al. Severe obesity, increasing age and male sex are independently associated with worse in-hospital outcomes, and higher in-hospital mortality, in a cohort of patients with COVID-19 in the Bronx, New York. Metabolism. 2020 Jul;108:154262. | CrossRef | PubMed | Ministerio de Salud de Perú. Documento Técnico: Prevención y atención de personas afectadas por COVID-19 en el Perú. 2020. [On line]. | Link |
Ministerio de Salud de Perú. Documento Técnico: Prevención y atención de personas afectadas por COVID-19 en el Perú. 2020. [On line]. | Link | RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021 Feb 25;384(8):693-704. | CrossRef | PubMed |
RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, Mafham M, Bell JL, et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med. 2021 Feb 25;384(8):693-704. | CrossRef | PubMed | Kox M, Waalders NJB, Kooistra EJ, Gerretsen J, Pickkers P. Cytokine Levels in Critically Ill Patients With COVID-19 and Other Conditions. JAMA. 2020 Sep 3;324(15):1565–7. | CrossRef | PubMed |
Kox M, Waalders NJB, Kooistra EJ, Gerretsen J, Pickkers P. Cytokine Levels in Critically Ill Patients With COVID-19 and Other Conditions. JAMA. 2020 Sep 3;324(15):1565–7. | CrossRef | PubMed | Paranjpe I, Fuster V, Lala A, Russak AJ, Glicksberg BS, Levin MA, et al. Association of Treatment Dose Anticoagulation With In-Hospital Survival Among Hospitalized Patients With COVID-19. J Am Coll Cardiol. 2020 Jul 7;76(1):122-124. | CrossRef | PubMed |
Paranjpe I, Fuster V, Lala A, Russak AJ, Glicksberg BS, Levin MA, et al. Association of Treatment Dose Anticoagulation With In-Hospital Survival Among Hospitalized Patients With COVID-19. J Am Coll Cardiol. 2020 Jul 7;76(1):122-124. | CrossRef | PubMed | Chorin E, Wadhwani L, Magnani S, Dai M, Shulman E, Nadeau-Routhier C, et al. QT interval prolongation and torsade de pointes in patients with COVID-19 treated with hydroxychloroquine/azithromycin. Heart Rhythm. 2020 Sep;17(9):1425-1433. | CrossRef | PubMed |
Chorin E, Wadhwani L, Magnani S, Dai M, Shulman E, Nadeau-Routhier C, et al. QT interval prolongation and torsade de pointes in patients with COVID-19 treated with hydroxychloroquine/azithromycin. Heart Rhythm. 2020 Sep;17(9):1425-1433. | CrossRef | PubMed | Mercuro NJ, Yen CF, Shim DJ, Maher TR, McCoy CM, Zimetbaum PJ, et al. Risk of QT Interval Prolongation Associated With Use of Hydroxychloroquine With or Without Concomitant Azithromycin Among Hospitalized Patients Testing Positive for Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020 Sep 1;5(9):1036-1041. | CrossRef | PubMed |
Mercuro NJ, Yen CF, Shim DJ, Maher TR, McCoy CM, Zimetbaum PJ, et al. Risk of QT Interval Prolongation Associated With Use of Hydroxychloroquine With or Without Concomitant Azithromycin Among Hospitalized Patients Testing Positive for Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020 Sep 1;5(9):1036-1041. | CrossRef | PubMed | Rodríguez Tanta LY, Fernández Rojas P, Solis Yucra T. Protocolo de Farmacovigilancia Intensiva N°03 "Cloroquina, Hidroxicloroquina y Azitromicina como tratamiento para casos de COVID-19 moderado y severo". Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI), Centro de Referencia Institucional de Farmacovigilancia y Tecnovigilancia EsSalud: 2020. [On line]. | Link |
Rodríguez Tanta LY, Fernández Rojas P, Solis Yucra T. Protocolo de Farmacovigilancia Intensiva N°03 "Cloroquina, Hidroxicloroquina y Azitromicina como tratamiento para casos de COVID-19 moderado y severo". Instituto de Evaluación de Tecnologías en Salud e Investigación (IETSI), Centro de Referencia Institucional de Farmacovigilancia y Tecnovigilancia EsSalud: 2020. [On line]. | Link | Langford BJ, So M, Raybardhan S, Leung V, Westwood D, MacFadden DR, et al. Bacterial co-infection and secondary infection in patients with COVID-19: a living rapid review and meta-analysis. Clin Microbiol Infect. 2020 Dec;26(12):1622-1629. | CrossRef | PubMed |
Langford BJ, So M, Raybardhan S, Leung V, Westwood D, MacFadden DR, et al. Bacterial co-infection and secondary infection in patients with COVID-19: a living rapid review and meta-analysis. Clin Microbiol Infect. 2020 Dec;26(12):1622-1629. | CrossRef | PubMed | Acosta G, Escobar G, Bernaola G, Alfaro J, Taype W, Marcos C, et al. Description of patients with severe COVID-19 treated in a national referral hospital in Peru. Rev Peru Med Exp Salud Publica. 2020 Apr-Jun;37(2):253-258. | CrossRef | PubMed |
Acosta G, Escobar G, Bernaola G, Alfaro J, Taype W, Marcos C, et al. Description of patients with severe COVID-19 treated in a national referral hospital in Peru. Rev Peru Med Exp Salud Publica. 2020 Apr-Jun;37(2):253-258. | CrossRef | PubMed | Chen J, Bai H, Liu J, Chen G, Liao Q, Yang J, et al. Distinct Clinical Characteristics and Risk Factors for Mortality in Female Inpatients With Coronavirus Disease 2019 (COVID-19): A Sex-stratified, Large-scale Cohort Study in Wuhan, China. Clin Infect Dis. 2020 Dec 15;71(12):3188-3195. | CrossRef | PubMed |
Chen J, Bai H, Liu J, Chen G, Liao Q, Yang J, et al. Distinct Clinical Characteristics and Risk Factors for Mortality in Female Inpatients With Coronavirus Disease 2019 (COVID-19): A Sex-stratified, Large-scale Cohort Study in Wuhan, China. Clin Infect Dis. 2020 Dec 15;71(12):3188-3195. | CrossRef | PubMed | Bhopal SS, Bhopal R. Sex differential in COVID-19 mortality varies markedly by age. Lancet. 2020 Aug 22;396(10250):532-533. | CrossRef | PubMed |
Bhopal SS, Bhopal R. Sex differential in COVID-19 mortality varies markedly by age. Lancet. 2020 Aug 22;396(10250):532-533. | CrossRef | PubMed | Epidemiology Working Group for NCIP Epidemic Response, Chinese Center for Disease Control and Prevention. [The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China]. Zhonghua Liu Xing Bing Xue Za Zhi. 2020 Feb 10;41(2):145-151. | CrossRef | PubMed |
Epidemiology Working Group for NCIP Epidemic Response, Chinese Center for Disease Control and Prevention. [The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) in China]. Zhonghua Liu Xing Bing Xue Za Zhi. 2020 Feb 10;41(2):145-151. | CrossRef | PubMed | Malik P, Patel U, Mehta D, Patel N, Kelkar R, Akrmah M, et al. Biomarkers and outcomes of COVID-19 hospitalisations: systematic review and meta-analysis. BMJ Evid Based Med. 2021 Jun;26(3):107-108. | CrossRef | PubMed |
Malik P, Patel U, Mehta D, Patel N, Kelkar R, Akrmah M, et al. Biomarkers and outcomes of COVID-19 hospitalisations: systematic review and meta-analysis. BMJ Evid Based Med. 2021 Jun;26(3):107-108. | CrossRef | PubMed |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis









