Key Words: methadone, morphine, postoperative pain, intravenous anesthesia, aparoscopic cholecystectomy
Resumen
Introducción
El manejo del dolor postoperatorio contribuye a reducir la morbilidad postoperatoria y los reingresos no programados. Pocos ensayos clínicos aleatorizados han evaluado la eficacia de la administración intraoperatoria de metadona en comparación con otros opioides como morfina, para el tratamiento del dolor postoperatorio, como para proporcionar evidencia de su uso regular o incluirse en guías clínicas.
Métodos
Realizamos un ensayo clínico aleatorizado comparando el uso de metadona intraoperatoria para evaluar su impacto sobre el dolor postoperatorio. Ochenta y seis pacientes sometidos a colecistectomía laparoscópica electiva fueron asignados para recibir metadona (0,08 mg/kg) o morfina (0,08 mg/kg).
Resultados
El grupo de pacientes que recibió metadona requirió menos morfina de rescate en la unidad de cuidados post-anestésicos para el manejo del dolor posoperatorio, en comparación con el grupo morfina (p = 0,0078). Los pacientes del grupo metadona reportaron menos dolor a los 5 y 15 minutos, y a las 12 y 24 horas postoperatorias, además de presentar menos episodios de náuseas. El tiempo de despertar entre ambos grupos fue equivalente.
Conclusión
El uso intraoperatorio de metadona es superior a morfina en el manejo del dolor postoperatorio, apoyando su uso como parte de la estrategia de manejo multimodal del dolor para colecistectomía laparoscópica bajo anestesia total endovenosa con remifentanilo.
|
Ideas clave
|
Introducción
El manejo del dolor postoperatorio es una parte esencial del plan anestésico para abordar el daño tisular luego de la cirugía y contribuye a reducir la morbilidad postoperatoria, mejorando la calidad percibida de la atención. Para la colecistectomía laparoscópica no complicada, el dolor es la causa principal de estadía hospitalaria prolongada y, en el contexto de la cirugía ambulatoria, es la principal causa de reingreso no programado[1],[2],[3].
El remifentanilo es actualmente el opiáceo de elección para el tratamiento del dolor intraoperatorio en cirugía laparoscópica, ya que permite una titulación rápida y da como resultado un tiempo de despertar predecible, independientemente de la dosis y la duración de la infusión[4],[5]. Sin embargo, no cubre de manera adecuada el dolor postoperatorio y puede causar tolerancia e hiperalgesia[6],[7],[8],[9]. Aunque todo el proceso no está completamente claro, se propone como mecanismo la activación de los receptores de N-metil-D-aspartato[10],[11].
El uso de antagonistas del receptor de N-metil-D-aspartato durante la cirugía, pretende contrarrestar los efectos no deseados de los opiáceos[9],[10],[11],[12]. Además, el uso de agentes como la ketamina en dosis subanestésicas ha resultado en una disminución del dolor posoperatorio agudo y menos uso de opiáceos de rescate[13],[14], incluso en el contexto de anestesia basada en remifentanilo[15]. El uso intraoperatorio de metadona es una opción atractiva para abordar el dolor posoperatorio, debido a su doble efecto como agonista en los receptores opiáceos y como antagonista no competitivo de los receptores de N-metil-D-aspartato[16]. Esta estrategia puede reducir la necesidad de morfina de rescate y sus efectos adversos asociados[12]. De hecho, varios grupos de investigación informan resultados positivos y seguros con metadona en este contexto, incluidos estudios de farmacocinética/farmacodinámica en adultos y niños[17],[18],[19], ensayos aleatorizados en cirugías mayores en adultos y niños[20],[21],[22],[23],[24],[25], y cirugía laparoscópica[26], aunque el riesgo de sesgo de estos estudios no se ha evaluado formalmente.
Un reciente ensayo clínico controlado aleatorizado evaluó el rendimiento de la metadona (0,1 miligramos por kilo) en comparación con la morfina (0,1 miligramos por kilo) en la colecistectomía laparoscópica y no encontró diferencias en la calidad de recuperación, evaluada por el cuestionario de calidad de recuperación (QoR-40)[27].
A pesar de esto, pocos ensayos aleatorizados han probado la eficacia de la metadona administrada intraoperatoriamente, en comparación con los opiáceos, para el tratamiento del dolor posoperatorio, con el fin de proporcionar evidencia para su uso regular o incluirse en las guías clínicas. Por lo tanto, realizamos un ensayo clínico controlado aleatorizado, comparando metadona intraoperatoria (0,08 miligramos por kilo) con morfina (0,08 miligramos por kilo), evaluando su impacto en la dosis total de morfina de rescate utilizada en la unidad de cuidados post anestésico y sobre el dolor postoperatorio.
Métodos
El presente estudio fue aprobado por Comité de Ética Institucional del Hospital Naval Almirante Nef, en Viña del Mar, Chile (PO3/13), y fue registrado en ClinicalTrials.gov (NCT01833715).
El estudio se realizó en el mismo hospital desde marzo a septiembre de 2013. El diseño es un ensayo clínico aleatorizado de grupos paralelos. Se incluyó a personas de 18 a 70 años, admitidas para someterse a colecistectomía laparoscópica electiva y con una puntuación I o II para la clasificación de estado físico de la Sociedad Americana de Anestesiología (ASA). Se excluyeron los pacientes con las siguientes características: (i) insuficiencia renal (creatininemia superior a 2 miligramos por decilitro), (ii) antecedentes de insuficiencia hepática, (iii) índice de masa corporal superior a 35 kilogramos por metro cuadrado, (iv) uso crónico de opiáceos, (v) registro de hipersensibilidad a los fármacos a utilizar, (vi) haber requerido conversión a cirugía abierta.
El consentimiento informado y los datos demográficos fueron recopilados antes de la cirugía por un miembro del equipo de investigación. Los evaluadores de resultados fueron miembros del personal de enfermería, que fueron capacitados por los investigadores para la aplicación de la escala de valoración numérica para el dolor[28],[29],[30] y en el registro de datos. Los datos registrados durante el procedimiento incluyeron dosis de anestésicos administrados (remifentanilo y propofol), tiempo de despertar, duración de la cirugía, eventos hipotensores y requerimiento de efedrina. La escala de valoración numérica se evaluó y registró a los 5, 10, 15, 30, 60 y 120 minutos en la unidad de cuidados post anestésico y a las 4, 8, 12 y 24 horas en la sala de hospitalización. Registramos las dosis totales de medicación de rescate administradas (morfina en unidad de cuidados post anestésico y ketorolaco en la sala). También se registraron los siguientes efectos adversos y tratamientos: náuseas, vómitos, prurito, retención urinaria, depresión respiratoria y administración de antiemético (ondansetrón 4 miligramos, IV). Al momento del alta, se pidió a los pacientes que calificaran la calidad de su manejo del dolor en una escala Likert de cuatro puntos (muy insatisfecho a muy satisfecho).
Los pacientes fueron aleatorizados mediante una secuencia automatizada computarizada, con una proporción de asignación de 1:1, para recibir metadona o morfina. La secuencia fue preparada y oculta por el investigador principal, quién además preparó las jeringas de acuerdo con el tratamiento asignado y las entregó al anestesiólogo a cargo del procedimiento. El anestesiólogo, los cirujanos, el personal de enfermería y los pacientes desconocían el tratamiento asignado.
La anestesia de inducción y mantenimiento se basó en remifentanilo y propofol, titulados para alcanzar un valor de índice biespectral entre 40 y 60. Después de la inducción, todos los pacientes recibieron dexametasona 8 miligramos, ketoprofeno 100 miligramos y metamizol 2 gramos. Se administró una dosis en bolo de metadona 0,08 miligramos por kilo o morfina 0,08 miligramos por kilo al inicio de la cirugía, calculada utilizando la masa corporal magra y basada en estudios previos[20],[22]. Se proporcionó analgesia posoperatoria mediante una infusión continua de ketoprofeno 100 miligramos y metamizol 3 miligramos. Las enfermeras administraron analgesia de rescate después de evaluar la escala de valoración numérica en los momentos predefinidos; se administró morfina 1 miligramos para puntuaciones mayor o igual a 4 en la unidad de cuidados post anestésico (hasta 120 minutos) y 30 miligramos de ketorolaco en sala de hospitalizados.
Nuestro protocolo y registro de ensayo establecieron nuestro resultado primario como la cantidad total de morfina de rescate utilizada durante las primeras 24 horas del posoperatorio. Sin embargo, debido a la política del hospital, no se administra morfina fuera de la unidad de cuidados post anestésico y las permanencias en recuperación suelen ser de dos horas. Por lo tanto, nos referimos a la cantidad total de morfina de rescate y destacamos que esta se suministró en las dos horas siguientes a la cirugía. La medida de resultado secundario fue el dolor, determinado mediante escala de valoración numérica a los 5, 15, 30, 60 y 120 minutos en la unidad de cuidados post anestésico, y también a las 4, 8, 12 y 24 horas del posoperatorio. Esperábamos que la dosis total promedio de morfina de rescate fuera de 4 miligramos en pacientes que habían recibido 0,08 miligramos por kilo de morfina durante la cirugía. Se calculó un tamaño de muestra de 37 pacientes por grupo para detectar al menos una reducción del dolor del 25% en el grupo de intervención, anticipando una desviación estándar de 1,5 miligramos en la dosis total de rescate de morfina, con un nivel de significación del 0,05% y una potencia del 80%. Se aleatorizó a 86 pacientes anticipando un 15% por posibles pérdidas (por ejemplo, retiros o conversión a cirugía abierta).
Las variables de resultado secundarias fueron: i) puntuación de dolor posoperatorio en la unidad de cuidados post anestésico, o en la sala, en momentos específicos, ii) número total de dosis de ketorolaco en la sala por paciente, iii) tiempo de despertar, iv) eventos adversos y tratamiento, v) calificación de la calidad de la analgesia proporcionada por los pacientes al alta.
Los datos continuos se presentan en medias y desviaciones estándar. Los datos categóricos se presentan en frecuencias absolutas y relativas. Las medias ± desviaciones estándar se compararon mediante la prueba de T de Student y el número de pacientes (%) se comparó mediante la prueba exacta de Fisher, considerando p ≤ 0,05 como significativo. Todos los análisis se realizaron con Stata 12.0 (StataCorp).
Resultados
Fueron evaluados para ser incluidos en el estudio 146 pacientes, y 60 no cumplían los criterios de inclusión por presentar más de 70 años, índice de masa corporal superior a 35 kilogramos por metro cuadrado o creatininemia superior a 2,0miligramos por decilitro. Fueron sometidos a aleatorización 86 pacientes, 43 asignados al grupo intervención (metadona) y 43 asignados al grupo control (morfina). Tres pacientes no recibieron la intervención porque recibieron anestesia inhalatoria (uno en el grupo metadona y dos en el grupo morfina). Tres pacientes en el grupo metadona y dos en el grupo morfina fueron excluidos por pérdida de seguimiento, cambio a laparotomía o complicaciones quirúrgicas (Figura 1).
Figura 1. Diagrama de flujo CONSORT.
Se incluyó a 39 pacientes por grupo en el análisis por protocolo. Los grupos fueron similares en edad, índice de masa corporal, sexo y estado físico (Tabla 1). Las características quirúrgicas fueron igualmente similares entre ambos grupos (Tabla 2).
Tabla 1. Características basales de los pacientes aleatorizados.
Tabla 2. Características de los pacientes que recibieron la intervención.
El uso de analgesia posoperatoria y los puntajes de dolor se presentan en la Tabla 3. Los individuos que recibieron metadona requirieron menos morfina de rescate en el posoperatorio (0,74 miligramos ± 0,82 miligramos versus 1,33 miligramos ± 1,24 miligramos; p = 0,0078), sin diferencias significativas en las dosis de ketorolaco de rescate en las siguientes 22 horas (0,18 ± 0,39 versus 0,15 ± 0,37; p = 0,6175). El tiempo de despertar fue equivalente en ambos grupos. Los puntajes de dolor registrados fueron generalmente bajos y difirieron en ambos grupos a los 5 y 15 minutos postoperatorios, y a las 12 y 24 horas durante la sala de hospitalización, siendo menor en los pacientes tratados con metadona. Algunos pacientes en el grupo metadona presentaron náuseas (2,6 versus 20,5%; p = 0,014), aunque globalmente las náuseas y vómitos fueron similares entre ambos grupos (Tabla 4).
Tabla 3. Analgesia post operatoria y puntuación de dolor.
Tabla 4. Eventos adversos en el período posoperatorio (24 horas).
Discusión
Encontramos que los pacientes que recibieron 0,8 miligramos por kilo de metadona durante el intraoperatorio, requirieron menos morfina de rescate para el manejo del dolor posoperatorio en las primeras dos horas posteriores a la colecistectomía laparoscópica comparado con el grupo que recibió 0,8 miligramos por kilo de morfina. Ese grupo de paciente reportó menos dolor a los 5 y 15 minutos, y a las 12 y 24 horas en sala de hospitalizados, presentado menos episodios de náuseas. El uso de metadona no prolongó el tiempo de despertar post anestesia.
Nuestros resultados son similares a una reciente publicación de un ensayo clínico aleatorizado en donde los mismos agentes fueron comparados en colecistectomía laparoscópica[27]. El resultado principal, calidad de la recuperación a las 24 horas evaluado por el cuestionario de calidad de recuperación (QoR-40), fue similar entre los grupos metadona y morfina. Moro y colaboradores, discutieron varios aspectos respecto a sus hallazgos incluyendo puntajes generales altos en comparación con trabajos previos realizados en cirugías más complejas y con enfoque multimodal de analgesia. En nuestro trabajo se preguntó la satisfacción del manejo del dolor en sala de hospitalización sin encontrar diferencias entre ambos grupos. Respecto al dolor evaluado por escala de valoración numérica cada 15 minutos en unidad de cuidados post anestésico, no se encontró diferencias entre los grupos metadona y morfina. Sin embargo, los autores presentaron los resultados como dolor en reposo en un punto de tiempo no especificado y a la hora[27]. Al igual que nuestro estudio, el uso de opiáceos postoperatorios en unidades de cuidados post anestésico fue significativamente diferente entre metadona y morfina, aunque Moro y colaboradores, presentaron las dosis utilizadas en mililitros (1 miligramos por kilo en 10 mililitros), continuando con la asignación de tratamiento para un paciente determinado. Si bien el enfoque de analgesia posoperatoria fue diferente, ya que todos los pacientes en nuestro trabajo recibieron 1 miligramos de morfina por dosis, los hallazgos probablemente representan requisitos de dolor bastante similares, ya que la indicación para administrar las dosis fue similar (manteniendo escala de valoración numérica por debajo de 3 en Moro y colaboradores, y por debajo de 4 en nuestro trabajo), a pesar de haber usado dosis intraoperatorias más bajas en nuestro trabajo (0,08 miligramos por kilo de metadona y morfina, frente a 0,1 miligramos por kilo). Asimismo, encontramos la presentación de náuseas y vómitos entre ambos grupos por igual. Sin embargo, cuando analizamos específicamente las náuseas, encontramos una mayor incidencia de estas entre los individuos tratados con morfina. Finalmente, Moro y colaboradores, informaron más individuos tratados con morfina con puntuaciones de sedación de Ramsey superior a 4, el cual fue un resultado relevante que no evaluamos.
Una explicación de la diferencia entre metadona y morfina es el perfil farmacocinético/farmacodinámico menos favorable de esta última, que conduce a efectos tardíos en relación con las concentraciones plasmáticas. El inicio tardío de la acción de la morfina se ha evidenciado por un mayor requerimiento de narcóticos de rescate en individuos que recibieron morfina de forma tardía o al final de la cirugía, en comparación con aquellos que recibieron morfina 40 minutos antes del final del procedimiento, en el contexto de anestesia total endovenosa[31]. En un estudio que se evaluó los niveles plasmáticos y el efecto máximo de varios opiáceos (diámetro pupilar), la metadona mostró una asociación más clara en comparación con la morfina, donde se observó un retraso de hasta dos horas entre el nivel plasmático máximo y el efecto máximo[16]. Otra posibilidad es la propiedad farmacodinámica de la metadona como agonista en los receptores opiáceos y como antagonista no competitivo en los receptores de N-metil-D-aspartato. Los antagonistas del receptor de N-metil-D-aspartato mejoran la eficacia de los opiáceos, retrasando el desarrollo de tolerancia y disminuyendo la hiperalgesia[32]. La mayoría de los estudios que han comparado morfina y metadona fueron en contexto del manejo del dolor crónico con formulaciones orales y subcutáneas, en proporciones de 5 a 7: 1 y 2 a 14: 1 respectivamente[33],[34]. Sin embargo, para el tratamiento del dolor posoperatorio en cirugías abdominales, administrando una única dosis intravenosa, algunos estudios utilizaron una relación 1:1[20],[21],[22].
Gourlay y colaboradores, introdujeron el uso de metadona intraoperatoriamente[17],[18],[20],[25],[26],[27], y muchos grupos de investigación han demostrado eficacia y seguridad adecuadas en una gran variedad de contextos quirúrgicos[19],[21],[22],[23],[24]. Un bolo endovenoso de 20 miligramos de metadona no causa inestabilidad hemodinámica en pacientes sometidos a cirugías de mayor envergadura[35]. Otra ventaja de la metadona es que no se producen metabolitos activos como la morfina, un importante problema en pacientes con insuficiencia renal[36],[37],[38].
Una de las limitaciones de este trabajo es la administración de morfina de rescate por parte del personal de enfermería en lugar de los pacientes, siendo probablemente la analgesia controlada por el paciente una representación más precisa de la necesidad de analgesia. Apreciamos que la diferencia estadísticamente significativa que informamos en términos de dosis de morfina de rescate y disminución del dolor postoperatorio en pacientes tratados con metadona representa una moderada utilidad clínica. Esto probablemente se deba a la menor carga nociceptiva en la cirugía laparoscópica, así como también a un enfoque multimodal para el manejo del dolor en ambos grupos. Es probable que la metadona represente una mayor utilidad en cirugías que se asocian con un dolor postoperatorio más intenso[24],[25]. Es conveniente realizar futuros ensayos para evaluar la eficacia de la metadona en cirugías con exposición prolongada a remifentanilo, y sería aconsejable incorporar pruebas somatosensoriales estandarizadas para evaluar la hiperalgesia posoperatoria[39],[40].
Considerando el dolor como una variable subjetiva, la evaluación de este está ampliamente aceptada por la escala de valoración numérica[41]. Es deseable que los estudios que evalúan el dolor, como el nuestro, utilicen esta escala para permitir comparaciones entre estudios y facilitar los esfuerzos futuros de síntesis de evidencia, como la inclusión en revisiones sistemáticas y metanálisis.
Nuestros resultados sugieren ventajas de la metadona intraoperatoria en comparación con la morfina para el tratamiento del dolor postoperatorio en colecistectomía laparoscópica, lo que resulta en menor uso de morfina de rescate en unidad de cuidados post anestésico y puntajes de la escala de valoración numérica más bajos en períodos específicos. Además, el hecho que los pacientes tratados con metadona presentaron menos náuseas, es una consideración importante al momento de la elección del opiáceo dentro de la estrategia de tratamiento multimodal en cirugías como colecistectomía.
Notas
Roles de contribución
NA: conceptualización, metodología, validación, análisis de datos, investigación, visualización, investigación, gestión de proyecto, revisor y edición. CP: análisis formal, investigación, revisión de borrador original. MK, MM: análisis de datos, investigación, escritura de borrador original, revisor y edición. FA: conceptualización, validación, investigación, recolección de datos, revisor y edición. JS: escritura borrador original, revisor y edición. EM: conceptualización, metodología, análisis de datos, redacción proyecto preliminar, revisor y edición.
Consideraciones éticas
El presente estudio fue aprobado por Comité de Ética Institucional del Hospital Naval Almirante Nef en Viña del Mar, Chile (PO3/13), y fue registrado en ClinicalTrials.gov (NCT01833715).
Agradecimientos
Agradecemos al personal del servicio de anestesiología del Hospital Naval Almirante Nef su colaboración en la realización del ensayo clínico.
Financiamiento
Este trabajo fue apoyado por la Dirección de Investigaciones de la Universidad de Valparaíso respaldado por CIDI8 Centro Interdisciplinario de Estudios en Salud.
Declaración de conflictos de intereses
Los autores declaran no tener ningún conflicto de intereses con la divulgación.

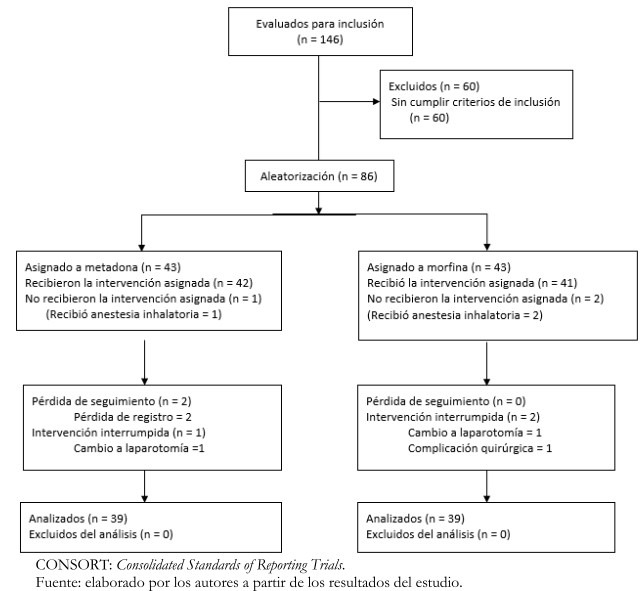 Figura 1. Diagrama de flujo CONSORT.
Figura 1. Diagrama de flujo CONSORT.

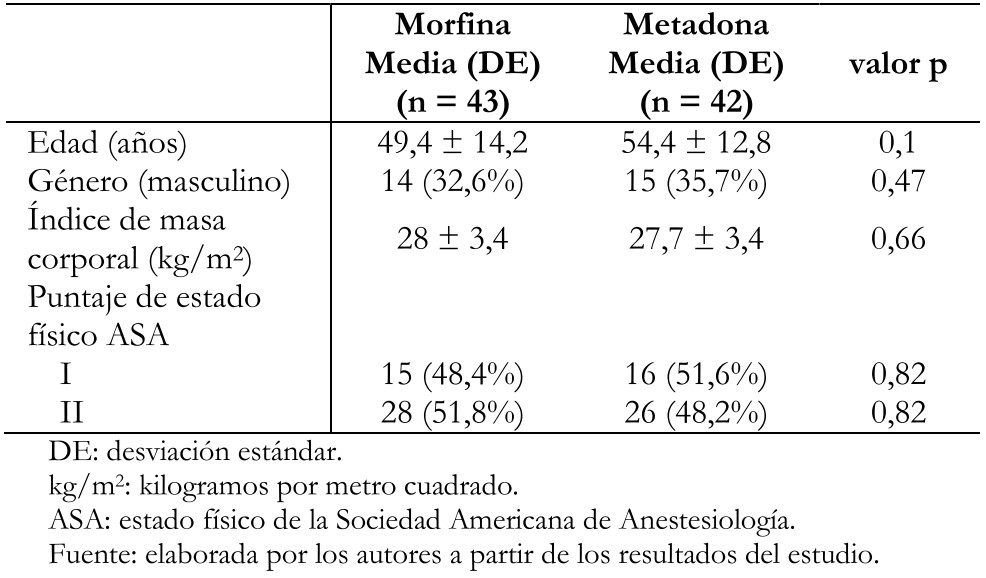 Tabla 1. Características basales de los pacientes aleatorizados.
Tabla 1. Características basales de los pacientes aleatorizados.

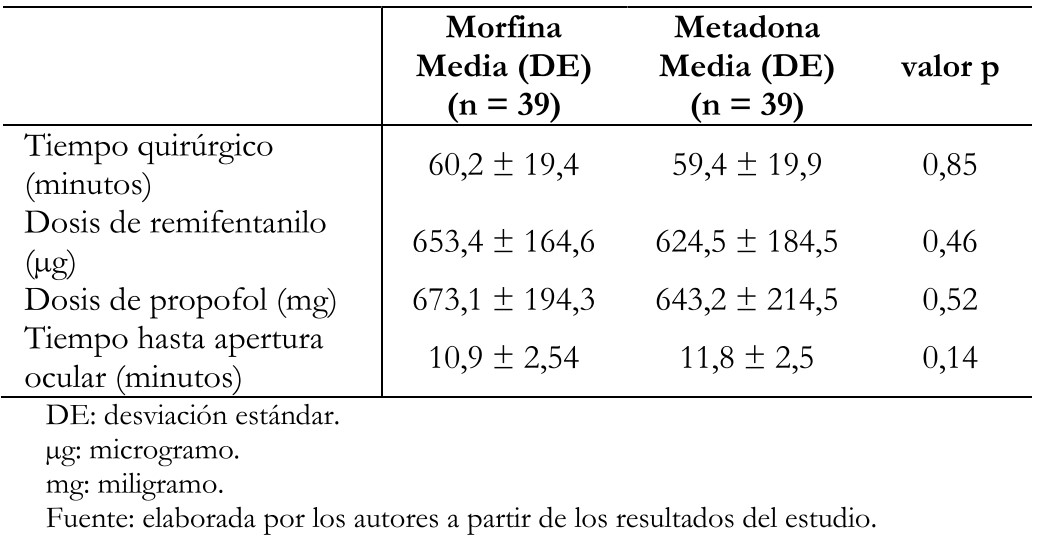 Tabla 2. Características de los pacientes que recibieron la intervención.
Tabla 2. Características de los pacientes que recibieron la intervención.

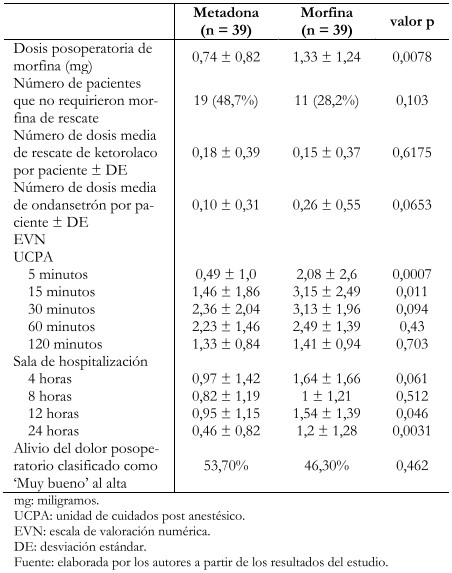 Tabla 3. Analgesia post operatoria y puntuación de dolor.
Tabla 3. Analgesia post operatoria y puntuación de dolor.

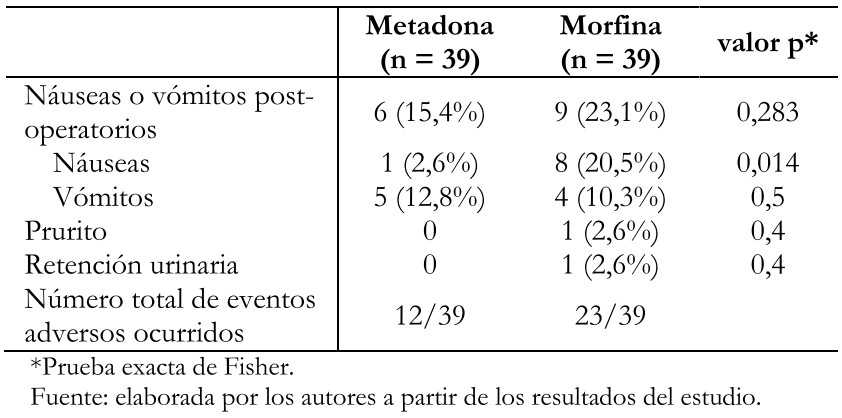 Tabla 4. Eventos adversos en el período posoperatorio (24 horas).
Tabla 4. Eventos adversos en el período posoperatorio (24 horas).
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Introducción
El manejo del dolor postoperatorio contribuye a reducir la morbilidad postoperatoria y los reingresos no programados. Pocos ensayos clínicos aleatorizados han evaluado la eficacia de la administración intraoperatoria de metadona en comparación con otros opioides como morfina, para el tratamiento del dolor postoperatorio, como para proporcionar evidencia de su uso regular o incluirse en guías clínicas.
Métodos
Realizamos un ensayo clínico aleatorizado comparando el uso de metadona intraoperatoria para evaluar su impacto sobre el dolor postoperatorio. Ochenta y seis pacientes sometidos a colecistectomía laparoscópica electiva fueron asignados para recibir metadona (0,08 mg/kg) o morfina (0,08 mg/kg).
Resultados
El grupo de pacientes que recibió metadona requirió menos morfina de rescate en la unidad de cuidados post-anestésicos para el manejo del dolor posoperatorio, en comparación con el grupo morfina (p = 0,0078). Los pacientes del grupo metadona reportaron menos dolor a los 5 y 15 minutos, y a las 12 y 24 horas postoperatorias, además de presentar menos episodios de náuseas. El tiempo de despertar entre ambos grupos fue equivalente.
Conclusión
El uso intraoperatorio de metadona es superior a morfina en el manejo del dolor postoperatorio, apoyando su uso como parte de la estrategia de manejo multimodal del dolor para colecistectomía laparoscópica bajo anestesia total endovenosa con remifentanilo.
 Authors:
Nicolás Arriaza[1,2], Cristian Papuzinski[3,4], Matías Kirmayr[4], Marcelo Matta[4], Fernando Aranda[1], Jana Stojanova[3], Eva Madrid[3,4]
Authors:
Nicolás Arriaza[1,2], Cristian Papuzinski[3,4], Matías Kirmayr[4], Marcelo Matta[4], Fernando Aranda[1], Jana Stojanova[3], Eva Madrid[3,4]
Affiliation:
[1] Department of Anesthesiology and Reanimation, School of Medicine, Universidad de Valparaíso, Valparaíso, Chile
[2] Department of Anesthesiology, Hospital Naval Almirante Nef, Viña del Mar, Chile
[3] Interdisciplinary Centre for Health Studies (CIESAL), Universidad de Valparaíso, Valparaíso, Chile
[4] Medical School, Universidad de Valparaíso, Valparaíso, Chile
E-mail: eva.madrid@uv.cl
Author address:
[1] Angamos 655 Reñaca Viña del Mar, Chile

Citation: Arriaza N, Papuzinski C, Kirmayr M, Matta M, Aranda F, Stojanova J, et al. Efficacy of methadone for the management of postoperative pain in laparoscopic cholecystectomy: A randomized clinical trial. Medwave 2021;21(2):e8134 doi: 10.5867/medwave.2021.02.8134
Submission date: 17/10/2020
Acceptance date: 28/1/2021
Publication date: 23/3/2021
Origin: Not commissioned
Type of review: Externally peer-reviewed by two reviewers, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Bisgaard T, Kehlet H, Rosenberg J. Pain and convalescence after laparoscopic cholecystectomy. Eur J Surg. 2001 Feb;167(2):84-96. | CrossRef | PubMed |
- Lau H, Brooks DC. Predictive factors for unanticipated admissions after ambulatory laparoscopic cholecystectomy. Arch Surg. 2001 Oct;136(10):1150-3. | CrossRef | PubMed |
- Bisgaard T. Analgesic treatment after laparoscopic cholecystectomy: a critical assessment of the evidence. Anesthesiology. 2006 Apr;104(4):835-46. | CrossRef | PubMed |
- Egan TD. Remifentanil pharmacokinetics and pharmacodynamics. A preliminary appraisal. Clin Pharmacokinet. 1995 Aug;29(2):80-94. | CrossRef | PubMed |
- Michelsen LG, Hug CC Jr. The pharmacokinetics of remifentanil. J Clin Anesth. 1996 Dec;8(8):679-82. | CrossRef | PubMed |
- Guignard B, Bossard AE, Coste C, Sessler DI, Lebrault C, Alfonsi P, et al. Acute opioid tolerance: intraoperative remifentanil increases postoperative pain and morphine requirement. Anesthesiology. 2000 Aug;93(2):409-17. | CrossRef | PubMed |
- Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006 Mar;104(3):570-87. | CrossRef | PubMed |
- Chang G, Chen L, Mao J. Opioid tolerance and hyperalgesia. Med Clin North Am. 2007 Mar;91(2):199-211. | CrossRef | PubMed |
- Koppert W, Schmelz M. The impact of opioid-induced hyperalgesia for postoperative pain. Best Pract Res Clin Anaesthesiol. 2007 Mar;21(1):65-83. | CrossRef | PubMed |
- Woolf CJ, Thompson SWN. The induction and maintenance of central sensitization is dependent on N-methyl-D-aspartic acid receptor activation; implications for the treatment of post-injury pain hypersensitivity states. Pain. 1991 Mar;44(3):293-299. | CrossRef | PubMed |
- Woolf CJ, Salter MW. Neuronal plasticity: increasing the gain in pain. Science. 2000 Jun 9;288(5472):1765-9. | CrossRef | PubMed |
- Wheeler M, Oderda GM, Ashburn MA, Lipman AG. Adverse events associated with postoperative opioid analgesia: a systematic review. J Pain. 2002 Jun;3(3):159-80. | CrossRef | PubMed |
- De Kock M, Lavand'homme P, Waterloos H. 'Balanced analgesia' in the perioperative period: is there a place for ketamine? Pain. 2001 Jun;92(3):373-380. | CrossRef | PubMed |
- Bell RF, Dahl JB, Moore RA, Kalso E. Perioperative ketamine for acute postoperative pain. Cochrane Database Syst Rev. 2006 Jan 25;(1):CD004603. | CrossRef | PubMed |
- Joly V, Richebe P, Guignard B, Fletcher D, Maurette P, Sessler DI, et al. Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamine. Anesthesiology. 2005 Jul;103(1):147-55. | CrossRef | PubMed |
- Kharasch ED. Intraoperative methadone: rediscovery, reappraisal, and reinvigoration? Anesth Analg. 2011 Jan;112(1):13-6. | CrossRef | PubMed |
- Gourlay GK, Wilson PR, Glynn CJ. Pharmacodynamics and pharmacokinetics of methadone during the perioperative period. Anesthesiology. 1982 Dec;57(6):458-67. | CrossRef | PubMed |
- Gourlay GK, Willis RJ, Wilson PR. Postoperative pain control with methadone: influence of supplementary methadone doses and blood concentration--response relationships. Anesthesiology. 1984 Jul;61(1):19-26. | PubMed |
- Sharma A, Tallchief D, Blood J, Kim T, London A, Kharasch ED. Perioperative pharmacokinetics of methadone in adolescents. Anesthesiology. 2011 Dec;115(6):1153-61. | CrossRef | PubMed |
- Gourlay GK, Willis RJ, Lamberty J. A double-blind comparison of the efficacy of methadone and morphine in postoperative pain control. Anesthesiology. 1986 Mar;64(3):322-7. | CrossRef | PubMed |
- Berde CB, Beyer JE, Bournaki MC, Levin CR, Sethna NF. Comparison of morphine and methadone for prevention of postoperative pain in 3- to 7-year-old children. J Pediatr. 1991 Jul;119(1 Pt 1):136-41. | CrossRef | PubMed |
- Chui PT, Gin T. A double-blind randomised trial comparing postoperative analgesia after perioperative loading doses of methadone or morphine. Anaesth Intensive Care. 1992 Feb;20(1):46-51. | CrossRef | PubMed |
- Gottschalk A, Durieux ME, Nemergut EC. Intraoperative methadone improves postoperative pain control in patients undergoing complex spine surgery. Anesth Analg. 2011 Jan;112(1):218-23. | CrossRef | PubMed |
- Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Marymont JH, Shear T, et al. Intraoperative Methadone for the Prevention of Postoperative Pain: A Randomized, Double-blinded Clinical Trial in Cardiac Surgical Patients. Anesthesiology. 2015 May;122(5):1112-22. | CrossRef | PubMed |
- Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Shear TD, Deshur MA, et al. Clinical Effectiveness and Safety of Intraoperative Methadone in Patients Undergoing Posterior Spinal Fusion Surgery: A Randomized, Double-blinded, Controlled Trial. Anesthesiology. 2017 May;126(5):822-833. | CrossRef | PubMed |
- Simoni RF, Cangiani LM, Pereira AM, Abreu MP, Cangiani LH, Zemi G. Eficácia do emprego da metadona ou da clonidina no intraoperatório para controle da dor pós-operatória imediata após uso de remifentanil [Efficacy of intraoperative methadone and clonidine in pain control in the immediate postoperative period after the use of remifentanil]. Rev Bras Anestesiol. 2009 Jul-Aug;59(4):421-30. | CrossRef | PubMed |
- Moro ET, Lambert MF, Pereira AL, Artioli T, Graicer G, Bevilacqua J, et al. The effect of methadone on postoperative quality of recovery in patients undergoing laparoscopic cholecystectomy: A prospective, randomized, double blinded, controlled clinical trial. J Clin Anesth. 2019 Mar;53:64-69. | CrossRef | PubMed |
- Downie WW, Leatham PA, Rhind VM, Wright V, Branco JA, Anderson JA. Studies with pain rating scales. Ann Rheum Dis. 1978 Aug;37(4):378-81. | CrossRef | PubMed |
- Breivik EK, Björnsson GA, Skovlund E. A comparison of pain rating scales by sampling from clinical trial data. Clin J Pain. 2000 Mar;16(1):22-8. | CrossRef | PubMed |
- Serrano-Atero M, Caballero J, Cañas A, García-Saura PL, Serrano-Álvarez C, Prieto J. Valoración del Dolor (I). Rev Soc Esp Dolor. 2002;9(2):94-108. [On line]. | Link |
- Muñoz HR, Guerrero ME, Brandes V, Cortínez LI. Effect of timing of morphine administration during remifentanil-based anaesthesia on early recovery from anaesthesia and postoperative pain. Br J Anaesth. 2002 Jun;88(6):814-8. | CrossRef | PubMed |
- Mao J. NMDA and opioid receptors: their interactions in antinociception, tolerance and neuroplasticity. Brain Res Brain Res Rev. 1999 Nov;30(3):289-304. | CrossRef | PubMed |
- Gagnon B, Bruera E. Differences in the ratios of morphine to methadone in patients with neuropathic pain versus non-neuropathic pain. J Pain Symptom Manage. 1999 Aug;18(2):120-5. | CrossRef | PubMed |
- Ripamonti C, Groff L, Brunelli C, Polastri D, Stavrakis A, De Conno F. Switching from morphine to oral methadone in treating cancer pain: what is the equianalgesic dose ratio? J Clin Oncol. 1998 Oct;16(10):3216-21. | CrossRef | PubMed |
- Bowdle TA, Even A, Shen DD, Swardstrom M. Methadone for the induction of anesthesia: plasma histamine concentration, arterial blood pressure, and heart rate. Anesth Analg. 2004 Jun;98(6):1692-7, table of contents. | CrossRef | PubMed |
- Christrup LL. Morphine metabolites. Acta Anaesthesiol Scand. 1997 Jan;41(1 Pt 2):116-22. | CrossRef | PubMed |
- Smith MT. Neuroexcitatory effects of morphine and hydromorphone: evidence implicating the 3-glucuronide metabolites. Clin Exp Pharmacol Physiol. 2000 Jul;27(7):524-8. | CrossRef | PubMed |
- Vaughan CW, Connor M. In search of a role for the morphine metabolite morphine-3-glucuronide. Anesth Analg. 2003 Aug;97(2):311-2. | CrossRef | PubMed |
- Wilder-Smith OH, Tassonyi E, Crul BJ, Arendt-Nielsen L. Quantitative sensory testing and human surgery: effects of analgesic management on postoperative neuroplasticity. Anesthesiology. 2003 May;98(5):1214-22. | CrossRef | PubMed |
- Rolke R, Baron R, Maier C, Tölle TR, Treede -DR, Beyer A, et al. Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS): standardized protocol and reference values. Pain. 2006 Aug;123(3):231-243. | CrossRef | PubMed |
- Hjermstad MJ, Fayers PM, Haugen DF, Caraceni A, Hanks GW, Loge JH, et al. Studies comparing Numerical Rating Scales, Verbal Rating Scales, and Visual Analogue Scales for assessment of pain intensity in adults: a systematic literature review. J Pain Symptom Manage. 2011 Jun;41(6):1073-93. | CrossRef | PubMed |
 Bisgaard T, Kehlet H, Rosenberg J. Pain and convalescence after laparoscopic cholecystectomy. Eur J Surg. 2001 Feb;167(2):84-96. | CrossRef | PubMed |
Bisgaard T, Kehlet H, Rosenberg J. Pain and convalescence after laparoscopic cholecystectomy. Eur J Surg. 2001 Feb;167(2):84-96. | CrossRef | PubMed | Lau H, Brooks DC. Predictive factors for unanticipated admissions after ambulatory laparoscopic cholecystectomy. Arch Surg. 2001 Oct;136(10):1150-3. | CrossRef | PubMed |
Lau H, Brooks DC. Predictive factors for unanticipated admissions after ambulatory laparoscopic cholecystectomy. Arch Surg. 2001 Oct;136(10):1150-3. | CrossRef | PubMed | Bisgaard T. Analgesic treatment after laparoscopic cholecystectomy: a critical assessment of the evidence. Anesthesiology. 2006 Apr;104(4):835-46. | CrossRef | PubMed |
Bisgaard T. Analgesic treatment after laparoscopic cholecystectomy: a critical assessment of the evidence. Anesthesiology. 2006 Apr;104(4):835-46. | CrossRef | PubMed | Egan TD. Remifentanil pharmacokinetics and pharmacodynamics. A preliminary appraisal. Clin Pharmacokinet. 1995 Aug;29(2):80-94. | CrossRef | PubMed |
Egan TD. Remifentanil pharmacokinetics and pharmacodynamics. A preliminary appraisal. Clin Pharmacokinet. 1995 Aug;29(2):80-94. | CrossRef | PubMed | Michelsen LG, Hug CC Jr. The pharmacokinetics of remifentanil. J Clin Anesth. 1996 Dec;8(8):679-82. | CrossRef | PubMed |
Michelsen LG, Hug CC Jr. The pharmacokinetics of remifentanil. J Clin Anesth. 1996 Dec;8(8):679-82. | CrossRef | PubMed | Guignard B, Bossard AE, Coste C, Sessler DI, Lebrault C, Alfonsi P, et al. Acute opioid tolerance: intraoperative remifentanil increases postoperative pain and morphine requirement. Anesthesiology. 2000 Aug;93(2):409-17. | CrossRef | PubMed |
Guignard B, Bossard AE, Coste C, Sessler DI, Lebrault C, Alfonsi P, et al. Acute opioid tolerance: intraoperative remifentanil increases postoperative pain and morphine requirement. Anesthesiology. 2000 Aug;93(2):409-17. | CrossRef | PubMed | Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006 Mar;104(3):570-87. | CrossRef | PubMed |
Angst MS, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006 Mar;104(3):570-87. | CrossRef | PubMed | Chang G, Chen L, Mao J. Opioid tolerance and hyperalgesia. Med Clin North Am. 2007 Mar;91(2):199-211. | CrossRef | PubMed |
Chang G, Chen L, Mao J. Opioid tolerance and hyperalgesia. Med Clin North Am. 2007 Mar;91(2):199-211. | CrossRef | PubMed | Koppert W, Schmelz M. The impact of opioid-induced hyperalgesia for postoperative pain. Best Pract Res Clin Anaesthesiol. 2007 Mar;21(1):65-83. | CrossRef | PubMed |
Koppert W, Schmelz M. The impact of opioid-induced hyperalgesia for postoperative pain. Best Pract Res Clin Anaesthesiol. 2007 Mar;21(1):65-83. | CrossRef | PubMed | Woolf CJ, Thompson SWN. The induction and maintenance of central sensitization is dependent on N-methyl-D-aspartic acid receptor activation; implications for the treatment of post-injury pain hypersensitivity states. Pain. 1991 Mar;44(3):293-299. | CrossRef | PubMed |
Woolf CJ, Thompson SWN. The induction and maintenance of central sensitization is dependent on N-methyl-D-aspartic acid receptor activation; implications for the treatment of post-injury pain hypersensitivity states. Pain. 1991 Mar;44(3):293-299. | CrossRef | PubMed | Woolf CJ, Salter MW. Neuronal plasticity: increasing the gain in pain. Science. 2000 Jun 9;288(5472):1765-9. | CrossRef | PubMed |
Woolf CJ, Salter MW. Neuronal plasticity: increasing the gain in pain. Science. 2000 Jun 9;288(5472):1765-9. | CrossRef | PubMed | Wheeler M, Oderda GM, Ashburn MA, Lipman AG. Adverse events associated with postoperative opioid analgesia: a systematic review. J Pain. 2002 Jun;3(3):159-80. | CrossRef | PubMed |
Wheeler M, Oderda GM, Ashburn MA, Lipman AG. Adverse events associated with postoperative opioid analgesia: a systematic review. J Pain. 2002 Jun;3(3):159-80. | CrossRef | PubMed | De Kock M, Lavand'homme P, Waterloos H. 'Balanced analgesia' in the perioperative period: is there a place for ketamine? Pain. 2001 Jun;92(3):373-380. | CrossRef | PubMed |
De Kock M, Lavand'homme P, Waterloos H. 'Balanced analgesia' in the perioperative period: is there a place for ketamine? Pain. 2001 Jun;92(3):373-380. | CrossRef | PubMed | Bell RF, Dahl JB, Moore RA, Kalso E. Perioperative ketamine for acute postoperative pain. Cochrane Database Syst Rev. 2006 Jan 25;(1):CD004603. | CrossRef | PubMed |
Bell RF, Dahl JB, Moore RA, Kalso E. Perioperative ketamine for acute postoperative pain. Cochrane Database Syst Rev. 2006 Jan 25;(1):CD004603. | CrossRef | PubMed | Joly V, Richebe P, Guignard B, Fletcher D, Maurette P, Sessler DI, et al. Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamine. Anesthesiology. 2005 Jul;103(1):147-55. | CrossRef | PubMed |
Joly V, Richebe P, Guignard B, Fletcher D, Maurette P, Sessler DI, et al. Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamine. Anesthesiology. 2005 Jul;103(1):147-55. | CrossRef | PubMed | Kharasch ED. Intraoperative methadone: rediscovery, reappraisal, and reinvigoration? Anesth Analg. 2011 Jan;112(1):13-6. | CrossRef | PubMed |
Kharasch ED. Intraoperative methadone: rediscovery, reappraisal, and reinvigoration? Anesth Analg. 2011 Jan;112(1):13-6. | CrossRef | PubMed | Gourlay GK, Wilson PR, Glynn CJ. Pharmacodynamics and pharmacokinetics of methadone during the perioperative period. Anesthesiology. 1982 Dec;57(6):458-67. | CrossRef | PubMed |
Gourlay GK, Wilson PR, Glynn CJ. Pharmacodynamics and pharmacokinetics of methadone during the perioperative period. Anesthesiology. 1982 Dec;57(6):458-67. | CrossRef | PubMed | Gourlay GK, Willis RJ, Wilson PR. Postoperative pain control with methadone: influence of supplementary methadone doses and blood concentration--response relationships. Anesthesiology. 1984 Jul;61(1):19-26. | PubMed |
Gourlay GK, Willis RJ, Wilson PR. Postoperative pain control with methadone: influence of supplementary methadone doses and blood concentration--response relationships. Anesthesiology. 1984 Jul;61(1):19-26. | PubMed | Sharma A, Tallchief D, Blood J, Kim T, London A, Kharasch ED. Perioperative pharmacokinetics of methadone in adolescents. Anesthesiology. 2011 Dec;115(6):1153-61. | CrossRef | PubMed |
Sharma A, Tallchief D, Blood J, Kim T, London A, Kharasch ED. Perioperative pharmacokinetics of methadone in adolescents. Anesthesiology. 2011 Dec;115(6):1153-61. | CrossRef | PubMed | Gourlay GK, Willis RJ, Lamberty J. A double-blind comparison of the efficacy of methadone and morphine in postoperative pain control. Anesthesiology. 1986 Mar;64(3):322-7. | CrossRef | PubMed |
Gourlay GK, Willis RJ, Lamberty J. A double-blind comparison of the efficacy of methadone and morphine in postoperative pain control. Anesthesiology. 1986 Mar;64(3):322-7. | CrossRef | PubMed | Berde CB, Beyer JE, Bournaki MC, Levin CR, Sethna NF. Comparison of morphine and methadone for prevention of postoperative pain in 3- to 7-year-old children. J Pediatr. 1991 Jul;119(1 Pt 1):136-41. | CrossRef | PubMed |
Berde CB, Beyer JE, Bournaki MC, Levin CR, Sethna NF. Comparison of morphine and methadone for prevention of postoperative pain in 3- to 7-year-old children. J Pediatr. 1991 Jul;119(1 Pt 1):136-41. | CrossRef | PubMed | Chui PT, Gin T. A double-blind randomised trial comparing postoperative analgesia after perioperative loading doses of methadone or morphine. Anaesth Intensive Care. 1992 Feb;20(1):46-51. | CrossRef | PubMed |
Chui PT, Gin T. A double-blind randomised trial comparing postoperative analgesia after perioperative loading doses of methadone or morphine. Anaesth Intensive Care. 1992 Feb;20(1):46-51. | CrossRef | PubMed | Gottschalk A, Durieux ME, Nemergut EC. Intraoperative methadone improves postoperative pain control in patients undergoing complex spine surgery. Anesth Analg. 2011 Jan;112(1):218-23. | CrossRef | PubMed |
Gottschalk A, Durieux ME, Nemergut EC. Intraoperative methadone improves postoperative pain control in patients undergoing complex spine surgery. Anesth Analg. 2011 Jan;112(1):218-23. | CrossRef | PubMed | Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Marymont JH, Shear T, et al. Intraoperative Methadone for the Prevention of Postoperative Pain: A Randomized, Double-blinded Clinical Trial in Cardiac Surgical Patients. Anesthesiology. 2015 May;122(5):1112-22. | CrossRef | PubMed |
Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Marymont JH, Shear T, et al. Intraoperative Methadone for the Prevention of Postoperative Pain: A Randomized, Double-blinded Clinical Trial in Cardiac Surgical Patients. Anesthesiology. 2015 May;122(5):1112-22. | CrossRef | PubMed | Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Shear TD, Deshur MA, et al. Clinical Effectiveness and Safety of Intraoperative Methadone in Patients Undergoing Posterior Spinal Fusion Surgery: A Randomized, Double-blinded, Controlled Trial. Anesthesiology. 2017 May;126(5):822-833. | CrossRef | PubMed |
Murphy GS, Szokol JW, Avram MJ, Greenberg SB, Shear TD, Deshur MA, et al. Clinical Effectiveness and Safety of Intraoperative Methadone in Patients Undergoing Posterior Spinal Fusion Surgery: A Randomized, Double-blinded, Controlled Trial. Anesthesiology. 2017 May;126(5):822-833. | CrossRef | PubMed | Simoni RF, Cangiani LM, Pereira AM, Abreu MP, Cangiani LH, Zemi G. Eficácia do emprego da metadona ou da clonidina no intraoperatório para controle da dor pós-operatória imediata após uso de remifentanil [Efficacy of intraoperative methadone and clonidine in pain control in the immediate postoperative period after the use of remifentanil]. Rev Bras Anestesiol. 2009 Jul-Aug;59(4):421-30. | CrossRef | PubMed |
Simoni RF, Cangiani LM, Pereira AM, Abreu MP, Cangiani LH, Zemi G. Eficácia do emprego da metadona ou da clonidina no intraoperatório para controle da dor pós-operatória imediata após uso de remifentanil [Efficacy of intraoperative methadone and clonidine in pain control in the immediate postoperative period after the use of remifentanil]. Rev Bras Anestesiol. 2009 Jul-Aug;59(4):421-30. | CrossRef | PubMed | Moro ET, Lambert MF, Pereira AL, Artioli T, Graicer G, Bevilacqua J, et al. The effect of methadone on postoperative quality of recovery in patients undergoing laparoscopic cholecystectomy: A prospective, randomized, double blinded, controlled clinical trial. J Clin Anesth. 2019 Mar;53:64-69. | CrossRef | PubMed |
Moro ET, Lambert MF, Pereira AL, Artioli T, Graicer G, Bevilacqua J, et al. The effect of methadone on postoperative quality of recovery in patients undergoing laparoscopic cholecystectomy: A prospective, randomized, double blinded, controlled clinical trial. J Clin Anesth. 2019 Mar;53:64-69. | CrossRef | PubMed | Downie WW, Leatham PA, Rhind VM, Wright V, Branco JA, Anderson JA. Studies with pain rating scales. Ann Rheum Dis. 1978 Aug;37(4):378-81. | CrossRef | PubMed |
Downie WW, Leatham PA, Rhind VM, Wright V, Branco JA, Anderson JA. Studies with pain rating scales. Ann Rheum Dis. 1978 Aug;37(4):378-81. | CrossRef | PubMed | Breivik EK, Björnsson GA, Skovlund E. A comparison of pain rating scales by sampling from clinical trial data. Clin J Pain. 2000 Mar;16(1):22-8. | CrossRef | PubMed |
Breivik EK, Björnsson GA, Skovlund E. A comparison of pain rating scales by sampling from clinical trial data. Clin J Pain. 2000 Mar;16(1):22-8. | CrossRef | PubMed | Serrano-Atero M, Caballero J, Cañas A, García-Saura PL, Serrano-Álvarez C, Prieto J. Valoración del Dolor (I). Rev Soc Esp Dolor. 2002;9(2):94-108. [On line]. | Link |
Serrano-Atero M, Caballero J, Cañas A, García-Saura PL, Serrano-Álvarez C, Prieto J. Valoración del Dolor (I). Rev Soc Esp Dolor. 2002;9(2):94-108. [On line]. | Link | Muñoz HR, Guerrero ME, Brandes V, Cortínez LI. Effect of timing of morphine administration during remifentanil-based anaesthesia on early recovery from anaesthesia and postoperative pain. Br J Anaesth. 2002 Jun;88(6):814-8. | CrossRef | PubMed |
Muñoz HR, Guerrero ME, Brandes V, Cortínez LI. Effect of timing of morphine administration during remifentanil-based anaesthesia on early recovery from anaesthesia and postoperative pain. Br J Anaesth. 2002 Jun;88(6):814-8. | CrossRef | PubMed | Mao J. NMDA and opioid receptors: their interactions in antinociception, tolerance and neuroplasticity. Brain Res Brain Res Rev. 1999 Nov;30(3):289-304. | CrossRef | PubMed |
Mao J. NMDA and opioid receptors: their interactions in antinociception, tolerance and neuroplasticity. Brain Res Brain Res Rev. 1999 Nov;30(3):289-304. | CrossRef | PubMed | Gagnon B, Bruera E. Differences in the ratios of morphine to methadone in patients with neuropathic pain versus non-neuropathic pain. J Pain Symptom Manage. 1999 Aug;18(2):120-5. | CrossRef | PubMed |
Gagnon B, Bruera E. Differences in the ratios of morphine to methadone in patients with neuropathic pain versus non-neuropathic pain. J Pain Symptom Manage. 1999 Aug;18(2):120-5. | CrossRef | PubMed | Ripamonti C, Groff L, Brunelli C, Polastri D, Stavrakis A, De Conno F. Switching from morphine to oral methadone in treating cancer pain: what is the equianalgesic dose ratio? J Clin Oncol. 1998 Oct;16(10):3216-21. | CrossRef | PubMed |
Ripamonti C, Groff L, Brunelli C, Polastri D, Stavrakis A, De Conno F. Switching from morphine to oral methadone in treating cancer pain: what is the equianalgesic dose ratio? J Clin Oncol. 1998 Oct;16(10):3216-21. | CrossRef | PubMed | Bowdle TA, Even A, Shen DD, Swardstrom M. Methadone for the induction of anesthesia: plasma histamine concentration, arterial blood pressure, and heart rate. Anesth Analg. 2004 Jun;98(6):1692-7, table of contents. | CrossRef | PubMed |
Bowdle TA, Even A, Shen DD, Swardstrom M. Methadone for the induction of anesthesia: plasma histamine concentration, arterial blood pressure, and heart rate. Anesth Analg. 2004 Jun;98(6):1692-7, table of contents. | CrossRef | PubMed | Christrup LL. Morphine metabolites. Acta Anaesthesiol Scand. 1997 Jan;41(1 Pt 2):116-22. | CrossRef | PubMed |
Christrup LL. Morphine metabolites. Acta Anaesthesiol Scand. 1997 Jan;41(1 Pt 2):116-22. | CrossRef | PubMed | Smith MT. Neuroexcitatory effects of morphine and hydromorphone: evidence implicating the 3-glucuronide metabolites. Clin Exp Pharmacol Physiol. 2000 Jul;27(7):524-8. | CrossRef | PubMed |
Smith MT. Neuroexcitatory effects of morphine and hydromorphone: evidence implicating the 3-glucuronide metabolites. Clin Exp Pharmacol Physiol. 2000 Jul;27(7):524-8. | CrossRef | PubMed | Vaughan CW, Connor M. In search of a role for the morphine metabolite morphine-3-glucuronide. Anesth Analg. 2003 Aug;97(2):311-2. | CrossRef | PubMed |
Vaughan CW, Connor M. In search of a role for the morphine metabolite morphine-3-glucuronide. Anesth Analg. 2003 Aug;97(2):311-2. | CrossRef | PubMed | Wilder-Smith OH, Tassonyi E, Crul BJ, Arendt-Nielsen L. Quantitative sensory testing and human surgery: effects of analgesic management on postoperative neuroplasticity. Anesthesiology. 2003 May;98(5):1214-22. | CrossRef | PubMed |
Wilder-Smith OH, Tassonyi E, Crul BJ, Arendt-Nielsen L. Quantitative sensory testing and human surgery: effects of analgesic management on postoperative neuroplasticity. Anesthesiology. 2003 May;98(5):1214-22. | CrossRef | PubMed | Rolke R, Baron R, Maier C, Tölle TR, Treede -DR, Beyer A, et al. Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS): standardized protocol and reference values. Pain. 2006 Aug;123(3):231-243. | CrossRef | PubMed |
Rolke R, Baron R, Maier C, Tölle TR, Treede -DR, Beyer A, et al. Quantitative sensory testing in the German Research Network on Neuropathic Pain (DFNS): standardized protocol and reference values. Pain. 2006 Aug;123(3):231-243. | CrossRef | PubMed | Hjermstad MJ, Fayers PM, Haugen DF, Caraceni A, Hanks GW, Loge JH, et al. Studies comparing Numerical Rating Scales, Verbal Rating Scales, and Visual Analogue Scales for assessment of pain intensity in adults: a systematic literature review. J Pain Symptom Manage. 2011 Jun;41(6):1073-93. | CrossRef | PubMed |
Hjermstad MJ, Fayers PM, Haugen DF, Caraceni A, Hanks GW, Loge JH, et al. Studies comparing Numerical Rating Scales, Verbal Rating Scales, and Visual Analogue Scales for assessment of pain intensity in adults: a systematic literature review. J Pain Symptom Manage. 2011 Jun;41(6):1073-93. | CrossRef | PubMed |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis








