Key Words: SARS-CoV-2, serology, pregnancy, pregnancy outcome, infant, newborn
Resumen
Introducción
El SARS-CoV-2 tiene una rápida expansión por todo el mundo, sin embargo, su capacidad para causar enfermedad grave no es homogénea según sexo y edad.
Objetivo
Determinar las características perinatales, morbilidad, mortalidad y resultados serológicos en neonatos de gestantes seropositivas para SARS-CoV-2.
Métodos
Estudio transversal, descriptivo y retrospectivo. Participaron todos los neonatos cuyas madres presentaron resultado seropositivo para SARS-CoV-2 antes del parto, entre el 15 de abril y 10 de mayo de 2020 en el Instituto Nacional Materno Perinatal de Perú. Se recogió información materna y neonatal a partir de sus historias clínicas. En el análisis se usó estadística descriptiva y prueba exacta de Fisher.
Resultados
Se identificaron 114 neonatos, el 36,8% presentó inmunoglobulinas M y G positivas para SARS-CoV-2; el 7% inmunoglobulinas G y 56,2% fue no reactivo. Las complicaciones obstétricas más frecuentes fueron rotura prematura de membranas (14,9%) y parto pretérmino (8,8%). El 8,8% de los neonatos presentaron un puntaje Apgar al minuto menor o igual a seis, y de ellos solo uno persistió a los cinco minutos; tres neonatos fallecieron. Se evidenció asociación entre el tipo de inmunoglobulina materna y la serología de su recién nacido (p < 0,05). No se observó asociación entre resultados perinatales y el tipo de inmunoglobulinas materna (p > 0,05), ni con los resultados serológicos en el neonato para SARS-CoV-2 (p > 0,05).
Conclusión
El 43,9% de neonatos de madre seropositiva a SARS-CoV-2 tuvo un resultado serológico positivo, siendo más frecuente de tipo Inmunoglobulinas M e Inmunoglobulinas G. El 10,5% de los neonatos presentó alguna morbilidad, siendo más frecuente prematuridad y bajo peso al nacer y el 2,6% falleció. Los resultados perinatales no estuvieron asociadas al tipo de inmunoglobulina de las madres seropositivas a SARS-CoV-2. De igual modo, los resultados perinatales no estuvieron asociados a los resultados serológicos en el neonato.
|
Ideas clave
|
Introducción
Entre las especies de β-coronavirus capaces de infectar humanos, tres de ellas han causado las últimas tres epidemias emergentes de la historia: SARS-CoV, MERS-CoV y SARS-CoV-2 en los años 2002 a 2003, 2012 y 2019 a 2020, respectivamente. La experiencia de la humanidad en las dos primeras infecciones, ha evidenciado resultados adversos en el binomio madre-niño[1]; siendo incierta aun la severidad y frecuencia de afectación por el virus SARS-CoV-2[2].
La Organización Mundial de la Salud declaró a la infección por SARS-CoV-2 como una emergencia de salud pública de preocupación internacional, con un rápido incremento de casos a nivel mundial[3]. En Perú se viene incrementando el número de casos positivos identificados, inicial y principalmente, mediante pruebas serológicas rápidas aplicadas en medios hospitalarios y en la población en general[4].
La primera notificación de un caso probable de transmisión vertical fue realizada en Wuhan, China; en donde un recién nacido de madre con diagnóstico de enfermedad por el nuevo coronavirus 2019 (COVID-19) tuvo una prueba serológica positiva, con valores altos de ambas inmunoglobulinas M y G. En el post parto inmediato, al considerar que los anticuerpos tipo Inmunoglobulinas M no pasan a través de la placenta, se podría sospechar que se tratan de anticuerpos propios del neonato, pudiendo tratarse de una infección intrauterina[5]. Sin embargo, existe controversia respecto a los resultados serológicos como instrumento para el diagnóstico y definición de la transmisión vertical[6]. Por otro lado, en estudios limitados el uso de pruebas moleculares en recién nacidos, no permite determinar si el momento de la infección fue durante el parto o en el periodo perinatal[7],[8],[9],[10].
El hallazgo de inmunoglobulinas en recién nacidos procedentes de madres infectadas por SARS-CoV-2 ha sido evidenciado en escasos reportes. Aún no está claro el efecto en el neonato, ni el rol de la serología en el binomio madre-niño[5],[6].
El objetivo de este estudio fue investigar las características perinatales, morbilidad y mortalidad en neonatos de gestantes seropositivas a SARS-CoV-2.
Métodos
Diseño de estudio y contexto
De acuerdo a la clasificación de diseños de estudio de Josep M. Argimon Pallás[11], el presente estudio según su finalidad es descriptivo; según su secuencia temporal es transversal; según control de la asignación de los factores el estudio es observacional; en relación con la cronología de los hechos es retrospectivo; y entre los tipos de diseños descriptivos transversales, corresponde a estudios de asociación cruzada.
El estudio fue realizado en el Instituto Nacional Materno Perinatal del Ministerio de Salud de Perú, un establecimiento del tercer nivel de atención, con categoría III-2; calificado como centro de referencia nacional. En Perú se dio la declaratoria del estado de emergencia por la infección de COVID-19 desde el 15 de marzo de 2020, y continuó al momento de la culminación de la presente investigación. En este lapso el instituto atendió exclusivamente a través del Servicio de Emergencia, aplicando a toda gestante la prueba serológica para el diagnóstico de infección de COVID-19, independientemente del tipo de parto, así como a todo neonato procedente de gestante seropositiva para el virus SARS-CoV-2, dentro de las primeras 12 horas de nacimiento. Se siguieron los protocolos institucionales para evitar el contagio de la madre al recién nacido, mediante la implementación de áreas de aislamiento, cuidados intermedios y unidades de cuidados intensivos neonatales adaptados para su atención diferenciada y evitar riesgos de transmisibilidad.
Población y muestra
La población objetivo de estudio fueron los recién nacidos procedentes de gestantes seropositivas para el virus SARS-CoV-2. El marco muestral fueron los recién nacidos atendidos en el Instituto Nacional Materno Perinatal de Perú, entre el 15 de abril y el 10 de mayo de 2020.
Criterios de inclusión:
a) Neonato cuya madre presentó anticuerpos anti-SARS-CoV-2 al ingreso hospitalario.
b) Ocurrencia del parto en la institución.
c) Neonato que tuvo resultado válido para la prueba serológica.
Criterios de exclusión:
a) Historial médico con subregistro para las variables maternas.
b) Historial médico con subregistro para las variables neonatales.
No se realizó un cálculo de tamaño muestral dado que se incluyeron todos los neonatos que elegibles según los criterios mencionados.
Prueba de detección de anticuerpos anti-SARS-CoV-2
Se empleó la prueba serológica One Step Test Kit COVID-19, validada por la Comunidad Europea. Se trata de un ensayo rápido que utiliza el método de inmunocromatografía para detectar simultáneamente la inmunoglobulina M e inmunoglobulina G. Había tres posibilidades: inmunoglobulinas M y G negativas: no hay infección o está en una fase temprana; inmunoglobulina M positiva e inmunoglobulina G negativa: infección aguda en una fase más evolucionada; inmunoglobulina M positiva/inmunoglobulina G positiva: infección en fase de resolución. Los resultados fueron registrados por el personal de salud en una ficha estándar de pruebas serológicas de la oficina de Epidemiología y Salud Ambiental del Instituto Nacional Materno Perinatal.
Variables
Las variables relacionadas con la madre fueron: la edad materna indicada en años cumplidos previo al embarazo y clasificada en edad adolescente (menor a 19 años), edad materna adulta (de 19 a 34 años) y edad materna avanzada (de 35 años a más); paridad indicado como nulípara (no haber tenido un parto previo), primípara (haber tenido un parto previo) y multípara (haber tenido previamente dos o más partos); resultado de prueba rápida reportado en valores cualitativos de inmunoglobulinas M e inmunoglobulinas G; indicación de síntomas respiratorios (como tos, dolor de garganta, cefalea, fiebre, escalofrío, congestión nasal) al momento de su ingreso hospitalario; presencia de complicaciones en el embarazo y tipo de complicación; vía de parto según cesárea o parto vaginal.
Las variables relacionadas con el neonato fueron: edad gestacional al momento del parto indicado como prematuridad (menor a 37 semanas), a término (mayor igual a 37 semanas); peso del recién nacido medido en gramos y consignado como bajo peso al nacer (menor de 2 500 gramos), peso normal (2 500 gramosa menor de 4 000 gramos) y macrosómico (mayor igual a 4000 gramos); sexo del recién nacido indicado como masculino o femenino; puntaje APGAR indicado al minuto y cinco minutos de vida, indicado como depresión (menor e igual a 6 puntos) y normal (mayor a 6 puntos); resultado de prueba serológica rápida del neonato en las primeras 12 horas de vida; presencia de morbilidad en el recién nacido registrado por el médico de neonatología; ingreso a zona de aislamiento, área de intermedios o unidad de cuidados intensivos neonatales; días de hospitalización indicado como menos o igual a 3 días, de 4 a 7 día s y más de 7 días; condición de egreso como fallecido o vivo
Recolección de la información
La información de los resultados de la prueba de serología rápida aplicada a las gestantes y los recién nacidos se obtuvieron a partir de las fichas estandarizadas de pruebas serológicas de la oficina de Epidemiología y Salud Ambiental del Instituto Nacional Materno Perinatal. Los datos maternos y neonatales se consiguieron a partir de la revisión de sus respectivas historias clínicas. Los sesgos de medición que pueden suceder en los estudios retrospectivos, al momento de recoger la información de los documentos antes mencionados, se trataron de reducir al recurrir a dos investigadores, que hicieron dicha labor, con independencia entre sí, desde el ingreso de la paciente hasta el egreso materno y del recién nacido con los diagnósticos definitivos. Se tomaron los resguardos necesarios para garantizar el anonimato de los participantes a través de la codificación de su identidad al recoger datos de las fuentes de información.
Análisis estadístico
Inicialmente se realizó un análisis exploratorio de los datos para evidenciar la existencia de datos perdidos procedentes de la gestante o del recién nacido, para su exclusión del análisis; identificando datos completos para las variables de estudio. Se realizaron tablas de contingencia con representaciones de frecuencias absolutas y proporcionales por columna, según tipo de resultados serológicos en la gestante y en el recién nacido. Con la finalidad de identificar asociaciones cruzadas de variables se aplicó la prueba exacta de Fisher, previa evaluación de supuestos de frecuencias esperadas. El criterio para la decisión de rechazar o no una hipótesis estadística, se tomó como valor crítico un nivel de significancia del 5%. Los datos fueron procesados en el software estadístico R versión 4,0 y en su plataforma de R estudio.
Consideraciones éticas
La investigación contó con la aprobación del Comité de Ética Institucional de Investigación del Instituto Nacional Materno Perinatal y con el permiso institucional correspondiente, los datos fueron recogidos retrospectivamente a partir de registros médicos y salvaguardando la identidad de los participantes, mediante codificación de la identidad. Asimismo, se siguieron las pautas éticas internacionales para la investigación relacionada con la salud del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS).
Resultados
En el periodo de estudio se identificaron 114 neonatos procedentes de gestantes seropositivas para el virus SARS-CoV-2 (Gráfico 1).
En la Tabla 1 se muestran características de las 114 gestantes seropositivas a SARS-CoV-2, donde se observa que 69,3% (79) fueron gestantes en edad adulta, el 36% (41) fueron multíparas y 36% (41) primíparas y 93,9% (107) eran asintomáticas. Las complicaciones obstétricas más frecuentes fueron la rotura prematura de membranas 14,9% (17), parto pretérmino 8,8% (10) y preeclampsia 6,1% (7).
Tabla 1. Características de gestantes seropositivas a SARS-CoV-2.
La Tabla 2 muestra que 56,1% (64) de los neonatos tuvieron una prueba serológica negativa para SARS-CoV-2, el 36,9% (42) fue positivo a inmunoglobulinas M e inmunoglobulinas G y 7% (8) a inmunoglobulinas G. Asimismo, se muestran las características perinatales de los neonatos, donde 8,8% (10) fue prematuro, 68,4% (78) nació de parto vaginal, un neonato presentó puntaje de Apgar a los cinco minutos de vida menor de 6. En relación con el peso de nacimiento, 7% (8) tuvo bajo peso y 6,1% (7) fue macrosómico. El 7% (8) de los neonatos requirió hospitalización en cuidados intensivos para COVID-19, mientras que 91,2% (104) de neonatos estuvo en asilamiento junto a la madre. En cuanto a los días de hospitalización, el 3,5% (4) se mantuvo hospitalizado por más de siete días.
De los 114 neonatos, el 10,5% (12) de neonatos presentó morbilidad, siendo más frecuente la prematuridad encontrada en 10 de los neonatos. Del total de prematuros, ocho fueron prematuros tardíos (entre 34 a 36 semanas de edad gestacional), uno fue prematuro moderado (de 33 semanas de edad gestacional) y uno fue muy prematuro (de 30 semanas de edad gestacional). Entre la morbilidad en recién nacidos prematuros se encontró que cuatro tuvieron neumonía, dos sepsis y shock. Asimismo, cuatro prematuros requirieron ventilación asistida.
En cuanto a los recién nacidos a término, el 41,7% (43) presentó alguna morbilidad, entre las cuales estuvieron taquipnea transitoria, hipoglicemia, sepsis, malformación adenomatosa quística e hidrocele.
Fallecieron tres neonatos de madres seropositivas a SARS-CoV-2. Uno de ellos procedía de madre de 37 años, con rotura prematura de membranas y asintomática para COVID-19. El parto ocurrió a las 30 semanas de edad gestacional, con 1 330 gramos de peso al nacer, serología negativa para SARS-CoV-2, diagnóstico de neumonía, sepsis tardía y shock séptico. El recién nacido requirió ventilación mecánica asistida y falleció a los 27 días. El segundo caso de mortalidad fue un neonato que procedió de madre de 21 años con hemorragia del tercer trimestre por desprendimiento prematuro de placenta; el parto ocurrió a las 34 semanas de edad gestacional. El neonato tuvo un peso al nacer de 1 600 gramos, serología negativa para SARS-CoV-2, depresión severa, asfixia severa, ciclope además de otras malformaciones congénitas mayores. Falleció en la primera hora de vida. El tercer caso de mortalidad se trató de un neonato de madre de 25 años. El parto ocurrió a las 38 semanas de edad gestacional con 3 456 gramos de peso al nacer, serología positiva de inmunoglobulinas M y G para SARS-CoV-2, con malformación adenomatosa quística de pulmón derecho, sepsis y shock séptico. Requirió ventilación asistida y falleció a los 12 días de vida.
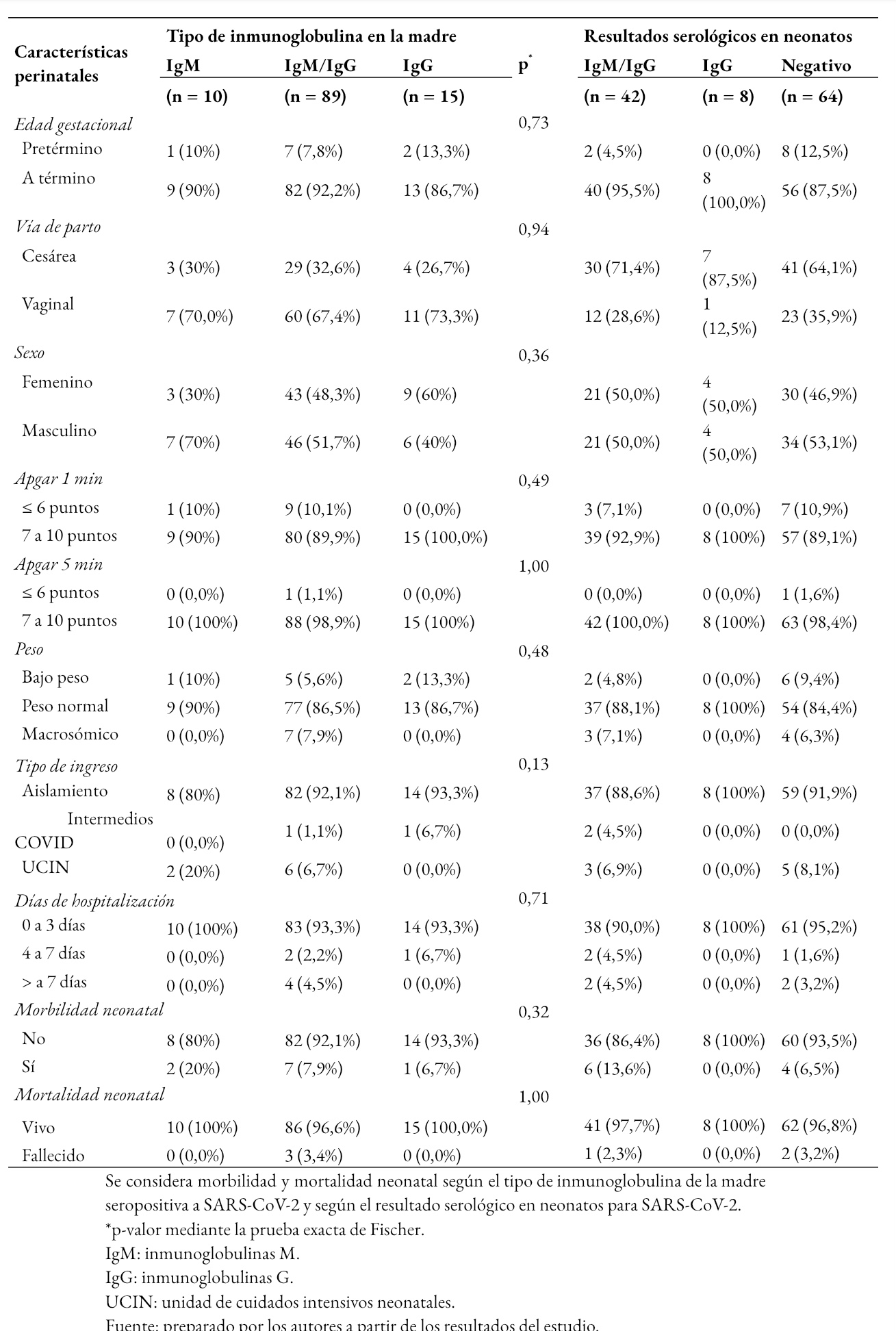
En la Tabla 3 se muestra que los resultados serológicos de los neonatos se asociaron al tipo de inmunoglobulinas materna para el virus SARS-CoV-2 (p < 0,01). Los neonatos con serología positiva para ambas inmunoglobulinas M y G, se relacionó con mayor frecuencia al tipo de inmunoglobulina materna de tipo Inmunoglobulina M e Inmunoglobulina G. Un resultado positivo neonatal de tipo Inmunoglobulina G se vinculó con mayor frecuencia al tipo de inmunoglobulina materna G; mientras que, un resultado serológico neonatal negativo se observó con mayor frecuencia cuando la madre presento inmunoglobulina de tipo M y G.
En la Tabla 4 se muestra que el parto prematuro se presentó con mayor frecuencia en el grupo de gestantes con resultado de inmunoglobulina tipo G, 2 de 15 (13,3%); con respecto al grupo de gestantes con inmunoglobulinas M, 1 de 10 (10%); o ambas inmunoglobulinas M y G, 7 de 89 (7,8%). Al comparar las características perinatales, morbilidad y mortalidad neonatal según el tipo de inmunoglobulina de la madre para SARS-CoV-2, no se encontró asociación (p > 0,05).
De igual forma, se describieron las características perinatales, morbilidad y mortalidad neonatal en función de los resultados serológicos en neonatos. Se observó que el grupo de neonatos con resultados negativos para ambas inmunoglobulinas presentó con mayor frecuencia prematuridad 12,5% (8 de 64 neonatos), bajo peso al nacer 9,4% (6 de 64 neonatos), ingreso a cuidados intensivos 8,1% (5 de 64 neonatos) y 3,2% de mortalidad (2 de 64 neonatos). Mientras que, en el grupo de neonatos con serología positiva a ambas inmunoglobulinas M y G, el 13,6% (6 de 42) presentó morbilidad y hubo un caso de muerte neonatal. Sin embargo, al comparar los resultados perinatales según el resultado de la serología en los neonatos para SARS-CoV-2, no se encontró que exista asociación (p > 0,05).
Discusión
La evidencia disponible sobre las consecuencias de desarrollar COVID-19 en las embarazadas y recién nacidos es aún insuficiente. Entre otras razones, debido a los límites diagnósticos de las pruebas moleculares y las pruebas serológicas actualmente vigentes[12],[13]. El ensayo serológico utilizado en el presente estudio, tanto en gestantes como en neonatos, cuenta con la validación de la Comunidad Europea, lo que garantiza que la prueba cumple con los estándares internacionalmente aceptables.
Las complicaciones obstétricas más frecuentes en las madres seropositivas para SARS-CoV-2 fueron la rotura prematura de membranas, parto pretérmino y preeclampsia. Ello difiere de los resultados obtenidos en otra investigación que incluyó a gestantes, y que reportó aborto espontáneo y parto pretérmino como las complicaciones más frecuentes[14]. Otro trabajo, que incluyó una serie de 42 gestantes con COVID-19, ocho estuvieron complicadas con neumonía, preeclampsia y síndrome de HELLP, que desaparecieron al resolverse dicha neumonía[15]. Estos hallazgos sugieren la variabilidad de las complicaciones en el embarazo según la severidad clínica de la enfermedad. Asimismo, en otro estudio se propone que la carga viral podría estar relacionada al grado de afectación y probable transmisión vertical[16]. Al comparar los hallazgos del presente estudio, se debe considerar que corresponden a una población de gestantes que en su mayoría se encontraban asintomáticas y en el tercer trimestre de gestación. Esto puede explicar las diferencias encontradas respecto a otros estudios.
En los registros de la oficina de estadística de nuestra institución antes de la pandemia por COVID-19 se reportó preeclampsia en 7,7% de gestantes que dieron parto para el año 2018 y 8,6% en 2019, rotura prematura de membranas 18,4% en 2018 y 17,6% en 2019. En cuanto a parto pretérmino en los años 2018 y 2019 se reportó 10,8% y 11,2% respectivamente. Estas cifras fueron porcentualmente similares a las frecuencias encontradas en el presente estudio.
Al ser el Instituto Nacional Materno Perinatal una institución del III nivel de atención, centro de referencia nacional para atención obstétrica y neonatal, del 20% al 25% de los nacimientos requieren de hospitalización tanto en cuidados intensivos como intermedios, siendo el hallazgo más frecuente el ser prematuro. De forma similar, en nuestro estudio el 10,5% presentó morbilidad que requirió hospitalización, siendo la primera causa de ella la prematuridad. Asimismo, en los registros estadísticos de nuestra institución la primera causa de muerte en años previos a la pandemia por COVID-19 fueron las malformaciones congénitas, seguida de la causa infecciosa; similar a lo encontrado en el presente estudio, donde dos de los tres fallecimientos correspondió a malformaciones congénitas y uno de ellos a causa infecciosa.
La prueba serológica en neonatos fue realizada dentro de las 12 horas del nacimiento; encontrándose que 36,9% tuvo un resultado positivo a ambas inmunoglobulinas M y G, lo cual se relaciona con la positividad materna y está por encima de los resultados obtenidos en otras series, que utilizaron exámenes moleculares de retrotranscripción de reacción en cadena de la polimerasa (RT-PCR), para definir la presencia de infección[14],[15]. Cuando se emplean las pruebas serológicas, hay que tomar en cuenta la posibilidad de los resultados falsos positivos, que pueden estar en relación a una reacción cruzada con otros virus, que causan la producción inespecífica de inmunoglobulinas M, macromoléculas o por algún estado inflamatorio placentario que permita que la inmunoglobulina M materna pueda atravesar la placenta[16],[17]. Sin embargo, en el presente estudio ninguna de las madres presentó corioamnionitis que pudiese estar relacionado a un cuadro inflamatorio placentario. Asimismo, el 93,9% de neonatos fue dado de alta sin complicaciones en los tres primeros días.
Los neonatos con resultados positivos para ambas inmunoglobulinas M y G, procedían con mayor frecuencia de gestantes con el mismo perfil de positividad. Los recién nacidos con resultados positivos a las inmunoglobulinas M y G, en teoría se considerarían infectados por el SARS-CoV-2[6], pero las limitaciones antes expresadas respecto a este tipo de pruebas, impiden que esta conclusión sea definitiva[17]. La transmisión vertical es potencialmente factible debido a la existencia de receptores enzima conversora de la angiotensina -2 en la placenta[18], a través de los cuales el virus podría penetrar a las células placentarias[19]. No obstante, las pruebas moleculares de RT-PCR no han podido identificar al virus en el líquido amniótico, cordón umbilical ni leche materna en la mayoría de estudios[20],[21]. Excepcionalmente, un reporte evidenció el hallazgo del virus en fluidos biológicos como una potencial transmisión transplacentaria[22].
La interpretación de la seropositividad en recién nacidos se asocia al valor predictivo positivo de la prueba. Esto varía de acuerdo a la prevalencia de la enfermedad en una determinada población y características propias del grupo en la que se aplique la prueba[23],[24]. En este caso, aun no se ha establecido la prevalencia nacional del SARS-CoV-2. Los recién nacidos que tuvieron resultados serológicos positivos de la inmunoglobulina de tipo G (7%), no deben considerarse necesariamente como infectados. El hallazgo de inmunoglobulinas G en el neonato, en principio, podría significar una transmisión pasiva de los anticuerpos de la madre[6]. Los neonatos que presentaron inmunoglobulinas G positiva fueron a término y asintomáticos; mientras que aquellos que tuvieron resultados positivos para ambas inmunoglobulinas M y G presentaron mayor frecuencia de morbilidad neonatal y hospitalización.
Para comprobar la transmisión vertical del virus, además del hallazgo de anticuerpos inmunoglobulinas M en el recién nacido, es necesario comprobar la exposición temprana de la infección en muestras biológicas mediante la RT-PCR[17], que no se incluyó en el presente estudio. Por lo que no se puede aseverar que los hallazgos del estudio se deban a la transmisión vertical; pero nos permite observar los hallazgos perinatales en función del estado serológico y clínico de la madre y el neonato.
No se evidenció asociación entre prematuridad y resultados serológicos de la madre, ni con la serología en el neonato. Esto es similar a otros reportes que utilizaron RT-PCR para la identificación de SARS-CoV-2[14],[25]. Sin embargo, aún no es posible definir los procedimientos y el momento más adecuado para tomar la muestra que garantice la detección de la infección por el SARS-CoV-2, ya que además de las razones antes expresadas, la gran mayoría de investigaciones tiene muestras muy pequeñas.
A pesar de que la información materna y de su recién nacido fueron recogidas de forma independiente, el carácter retrospectivo del estudio limita la calidad de los datos. Asimismo, las pruebas serológicas presentan valores de sensibilidad, especificidad y valores predictivos que son aún inciertas en gestantes y neonatos, no siendo de primera elección para un diagnóstico definitivo. Sin embargo, son utilizadas cuando las pruebas moleculares no están disponibles, como sucede en la mayoría de los países en desarrollo.
Conclusiones
Las gestantes seropositivas para SARS-CoV-2 que acuden a nuestra institución al momento del parto fueron en su mayoría asintomáticas, así como sus recién nacidos.
El 43,9% de neonatos de madre seropositiva a SARS-CoV-2 tuvo un resultado serológico positivo, siendo más frecuente de tipo inmunoglobulina M e inmunoglobulina G. El 10,5% de neonatos presentó alguna morbilidad, las más frecuentes fueron prematuridad y bajo peso al nacer. El 2,6% de los recién nacidos falleció.
Los resultados perinatales no estuvieron asociados al tipo de inmunoglobulina de las madres que fueron seropositivas a SARS-CoV-2. De igual modo, los resultados perinatales no estuvieron relacionados con los resultados serológicos en el neonato.
Notas
Roles de autoría
CDA, MES, EMI, EGR, ETM, RHP, YEV: conceptualización, gestión de datos, investigación, supervisión, presentación de datos, preparación de manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones). RAC, CVV, LMS, OGC: investigación, preparación de manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones). PAP, ARV, CSD: investigación, supervisión, presentación de datos, preparación de manuscrito (desarrollo del borrador original), redacción (revisiones y ediciones).
Agradecimientos
Los autores expresan su agradecimiento a las gestantes y sus recién nacidos que fueron atendidos en el Instituto Nacional Materno Perinatal de Perú cuyos antecedentes fueron utilizados en este estudio, de igual forma al personal de salud de la institución.
Conflictos de intereses
Los autores completaron el formulario de declaración de conflictos de intereses del ICMJE, y declararon que no recibieron fondos por la realización de este artículo; no tienen relaciones financieras con organizaciones que puedan tener interés en el artículo publicado en los últimos tres años y no tienen otras relaciones o actividades que puedan influenciar en la publicación del artículo.
Financiamiento
Los autores declaran que no recibieron financiamiento económico para la realización de este estudio
Consideraciones éticas
El estudio se realizó conforme a las Pautas éticas internacionales para la investigación relacionada con la salud con seres humanos, Cuarta Edición. Ginebra: Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS); 2016. El protocolo del estudio fue aprobado por el Comité Institucional de Ética del Instituto Nacional Materno Perinatal de Perú. El protocolo obtuvo el permiso para la generación de la información en condiciones de la actual pandemia, y la ausencia de riesgos asociados para los pacientes. La confidencialidad de los datos fue resguardada a través de un proceso de anonimización de la base de datos mediante codificación de la identidad.
Disponibilidad de los datos
Los datos utilizados para el presente estudio se encuentran disponibles previa solicitud.

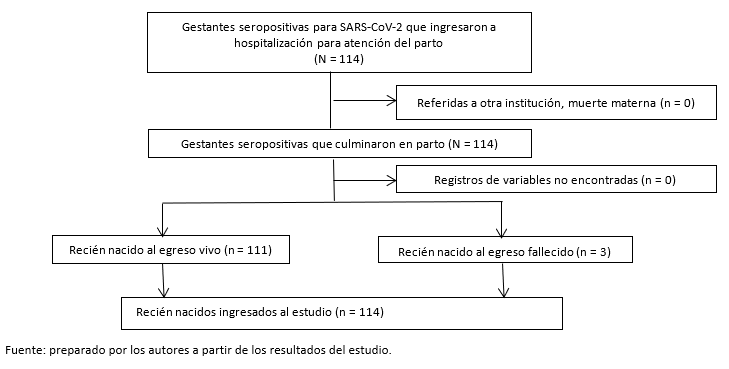

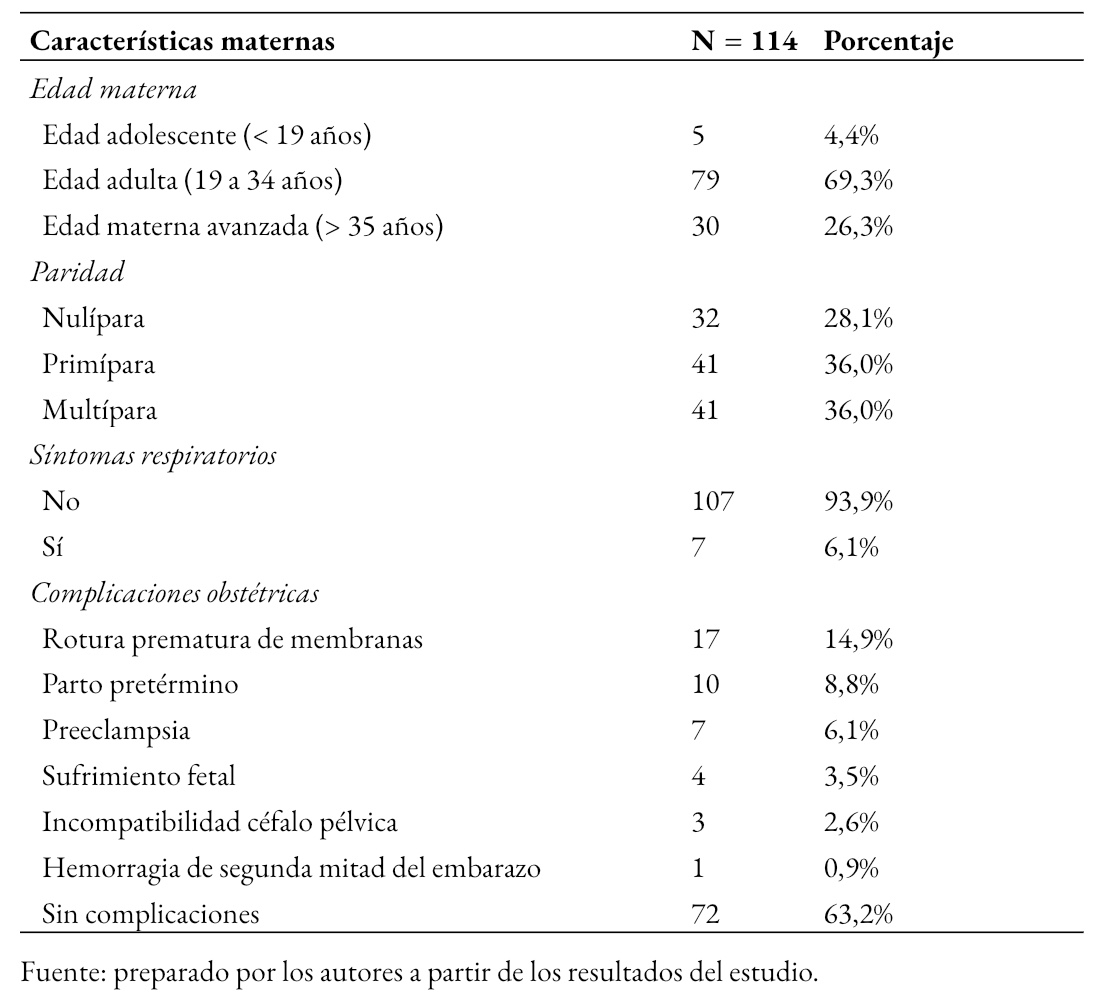 Tabla 1. Características de gestantes seropositivas a SARS-CoV-2.
Tabla 1. Características de gestantes seropositivas a SARS-CoV-2.

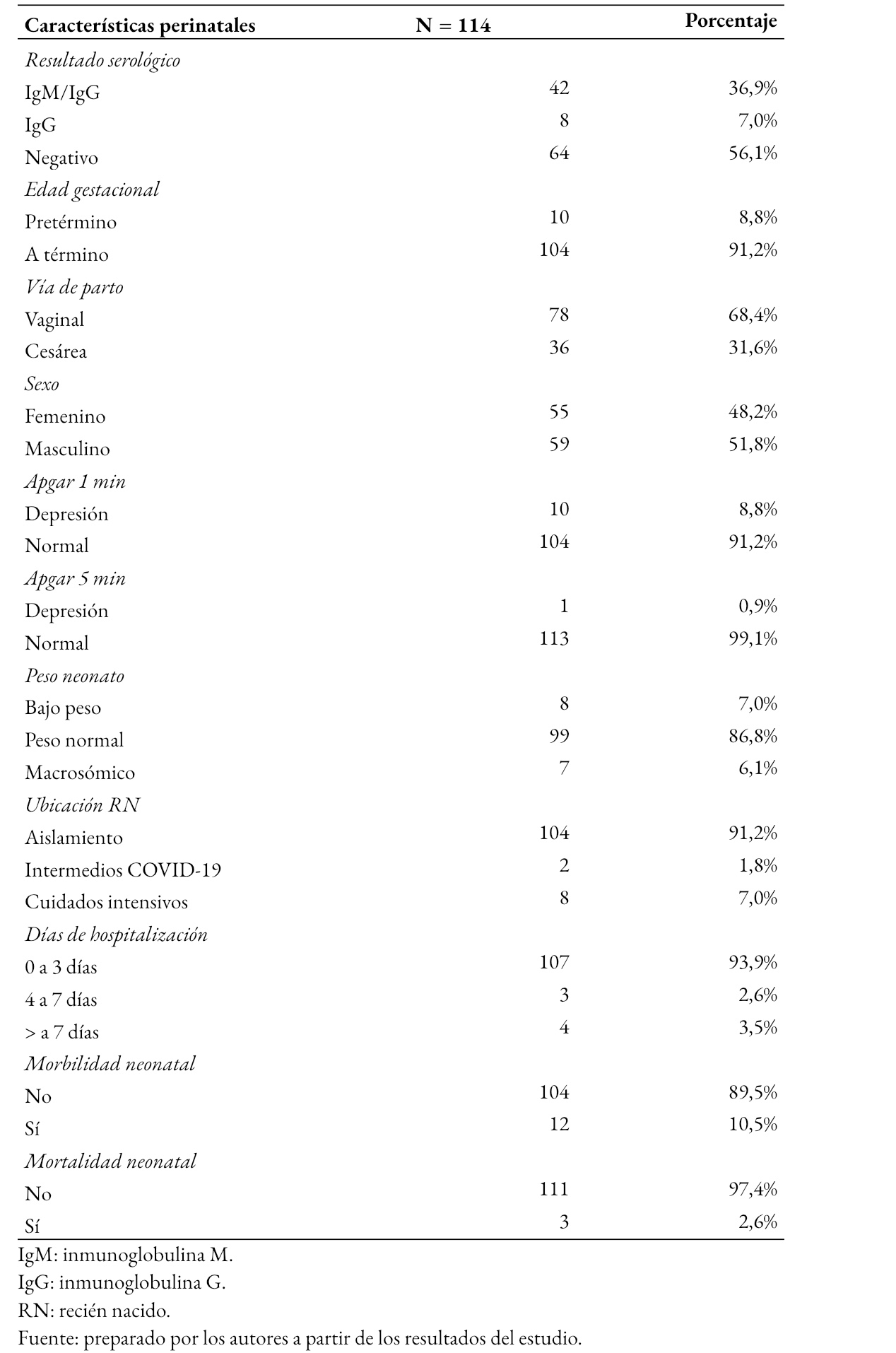 Tabla 2.Características perinatales, morbilidad y mortalidad en neonatos de gestantes seropositivas para SARS-CoV-2.
Tabla 2.Características perinatales, morbilidad y mortalidad en neonatos de gestantes seropositivas para SARS-CoV-2.

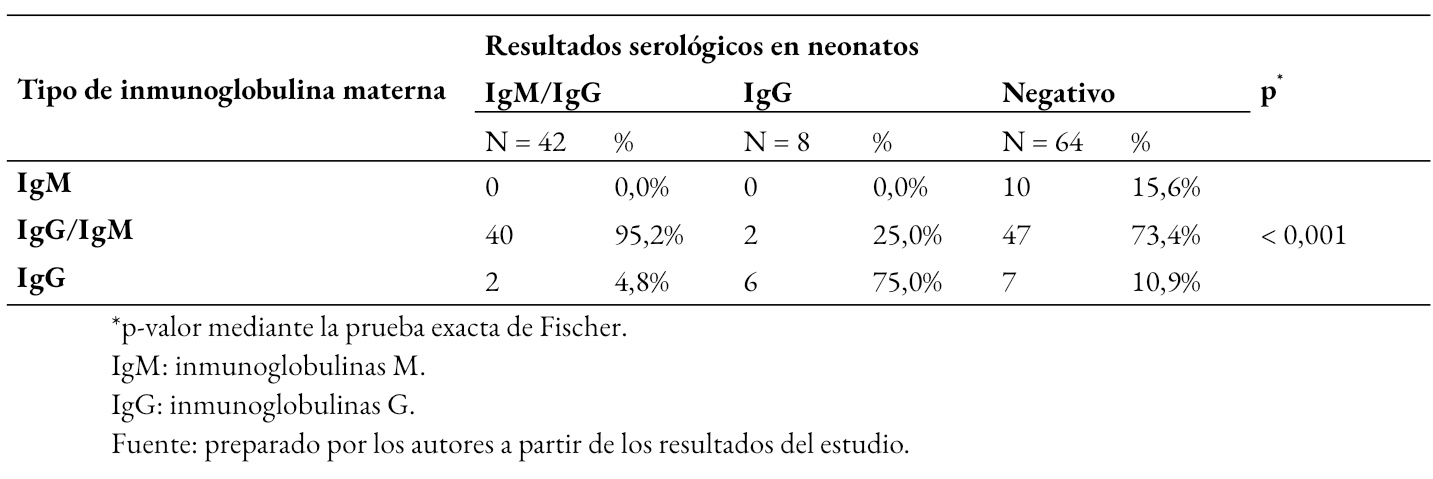 Tabla 3. Comparación entre resultados serológicos de neonatos y tipo de inmunoglobulina materna seropositiva para SARS-CoV-2.
Tabla 3. Comparación entre resultados serológicos de neonatos y tipo de inmunoglobulina materna seropositiva para SARS-CoV-2.

 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Introducción
El SARS-CoV-2 tiene una rápida expansión por todo el mundo, sin embargo, su capacidad para causar enfermedad grave no es homogénea según sexo y edad.
Objetivo
Determinar las características perinatales, morbilidad, mortalidad y resultados serológicos en neonatos de gestantes seropositivas para SARS-CoV-2.
Métodos
Estudio transversal, descriptivo y retrospectivo. Participaron todos los neonatos cuyas madres presentaron resultado seropositivo para SARS-CoV-2 antes del parto, entre el 15 de abril y 10 de mayo de 2020 en el Instituto Nacional Materno Perinatal de Perú. Se recogió información materna y neonatal a partir de sus historias clínicas. En el análisis se usó estadística descriptiva y prueba exacta de Fisher.
Resultados
Se identificaron 114 neonatos, el 36,8% presentó inmunoglobulinas M y G positivas para SARS-CoV-2; el 7% inmunoglobulinas G y 56,2% fue no reactivo. Las complicaciones obstétricas más frecuentes fueron rotura prematura de membranas (14,9%) y parto pretérmino (8,8%). El 8,8% de los neonatos presentaron un puntaje Apgar al minuto menor o igual a seis, y de ellos solo uno persistió a los cinco minutos; tres neonatos fallecieron. Se evidenció asociación entre el tipo de inmunoglobulina materna y la serología de su recién nacido (p < 0,05). No se observó asociación entre resultados perinatales y el tipo de inmunoglobulinas materna (p > 0,05), ni con los resultados serológicos en el neonato para SARS-CoV-2 (p > 0,05).
Conclusión
El 43,9% de neonatos de madre seropositiva a SARS-CoV-2 tuvo un resultado serológico positivo, siendo más frecuente de tipo Inmunoglobulinas M e Inmunoglobulinas G. El 10,5% de los neonatos presentó alguna morbilidad, siendo más frecuente prematuridad y bajo peso al nacer y el 2,6% falleció. Los resultados perinatales no estuvieron asociadas al tipo de inmunoglobulina de las madres seropositivas a SARS-CoV-2. De igual modo, los resultados perinatales no estuvieron asociados a los resultados serológicos en el neonato.
 Authors:
Carmen Dávila-Aliaga[1,2], Marcos Espínola-Sánchez[1,3], Elina Mendoza-Ibáñez[1], Enrique Guevara-Ríos[1,4], Elsa Torres-Marcos[1], Rosmary Hinojosa-Pérez[1], Ylia Espinoza-Vivas[1], Ricardo Álvarez-Carrasco[1], Carlos Velásquez-Vásquez[1], Luis Meza-Santibáñez[1], Oswaldo Gonzales-Carrillo[1], Pedro Arango-Ochante[1], Augusto Racchumí-Vela[1], Claudia Saldaña-Díaz[1]
Authors:
Carmen Dávila-Aliaga[1,2], Marcos Espínola-Sánchez[1,3], Elina Mendoza-Ibáñez[1], Enrique Guevara-Ríos[1,4], Elsa Torres-Marcos[1], Rosmary Hinojosa-Pérez[1], Ylia Espinoza-Vivas[1], Ricardo Álvarez-Carrasco[1], Carlos Velásquez-Vásquez[1], Luis Meza-Santibáñez[1], Oswaldo Gonzales-Carrillo[1], Pedro Arango-Ochante[1], Augusto Racchumí-Vela[1], Claudia Saldaña-Díaz[1]
Affiliation:
[1] Instituto Nacional Materno Perinatal, Lima, Perú
[2] Universidad Nacional Federico Villarreal, Lima, Perú
[3] Universidad Privada del Norte, Lima, Perú
[4] Universidad Nacional Mayor de San Marcos, Lima, Perú
E-mail: marcosespinola.es@gmail.com
Author address:
[1] Santa Rosa, 941, Cercado de Lima Lima, Perú 15003

Citation: Dávila-Aliaga C, Espínola-Sánchez M, Mendoza-Ibáñez E, Guevara-Ríos E, Torres-Marcos E, Hinojosa-Pérez R, et al. Perinatal outcomes and serological results in neonates of pregnant women seropositive to SARS-CoV-2: A cross-sectional descriptive study. Medwave 2020;20(11):e8084 doi: 10.5867/medwave.2020.11.8084
Submission date: 13/8/2020
Acceptance date: 30/11/2020
Publication date: 21/12/2020
Origin: Not commissioned
Type of review: Externally peer-reviewed by three reviewers, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Schwartz DA, Graham AL. Potential Maternal and Infant Outcomes from (Wuhan) Coronavirus 2019-nCoV Infecting Pregnant Women: Lessons from SARS, MERS, and Other Human Coronavirus Infections. Viruses. 2020 Feb 10;12(2):194. | CrossRef | PubMed |
- Duran P, Berman S, Niermeyer S, Jaenisch T, Forster T, Gomez Ponce de Leon R, et al. COVID-19 and newborn health: systematic review. Rev Panam Salud Publica. 2020 Apr 27;44:e54. | CrossRef | PubMed |
- Organización Mundial de la Salud. Coronavirus disease (COVID-2019) situation reports-130. 2020. Geneva: Organización Mundial de la Salud; 2020. [On line] | Link |
- Ministerio de Salud. Casos confirmados por Coronavirus COVID-19 ascienden a 183 198 en el Perú (Comunicado N° 121). 2020. Lima: MINSA; 2020 [On line]. | Link |
- Zeng H, Xu C, Fan J, Tang Y, Deng Q, Zhang W, et al. Antibodies in Infants Born to Mothers With COVID-19 Pneumonia. JAMA. 2020 May 12;323(18):1848-1849. | CrossRef | PubMed |
- Dong L, Tian J, He S, Zhu C, Wang J, Liu C, et al. Possible Vertical Transmission of SARS-CoV-2 From an Infected Mother to Her Newborn. JAMA. 2020 May 12;323(18):1846-1848. | CrossRef | PubMed |
- Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet. 2020 Mar 7;395(10226):809-815. | CrossRef | PubMed |
- Karimi-Zarchi M, Neamatzadeh H, Dastgheib SA, Abbasi H, Mirjalili SR, Behforouz A, et al. Vertical Transmission of Coronavirus Disease 19 (COVID-19) from Infected Pregnant Mothers to Neonates: A Review. Fetal Pediatr Pathol. 2020 Jun;39(3):246-250. | CrossRef | PubMed |
- Zaigham M, Andersson O. Maternal and perinatal outcomes with COVID-19: A systematic review of 108 pregnancies. Acta Obstet Gynecol Scand. 2020 Jul;99(7):823-829. | CrossRef | PubMed |
- Zhu H, Wang L, Fang C, Peng S, Zhang L, Chang G, et al. Clinical analysis of 10 neonates born to mothers with 2019-nCoV pneumonia. Transl Pediatr. 2020 Feb;9(1):51-60. | CrossRef | PubMed |
- Josep Argimon Pallás, Josep Jiménez Villa. Métodos de Investigación Clínica y Epidemiolçogica. 4ª edición. Barcelona: Elsevier; 2013.
- Zhang W, Du RH, Li B, Zheng XS, Yang XL, Hu B, et al. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect. 2020 Feb 17;9(1):386-389. | CrossRef | PubMed |
- Aguilar-Gamboa F. Desafíos para el manejo y detección de pacientes con COVID-19 en Latinoamérica. Rev Exp Med. 2020;6(1):63-7. | CrossRef |
- Yan J, Guo J, Fan C, Juan J, Yu X, Li J, et al. Coronavirus disease 2019 in pregnant women: a report based on 116 cases. Am J Obstet Gynecol. 2020 Jul;223(1):111.e1-111.e14. | CrossRef | PubMed |
- Mendoza M, Garcia-Ruiz I, Maiz N, Rodo C, Garcia-Manau P, Serrano B, et al. Pre-eclampsia- like syndrome induced by severe COVID-19: a prospective observational study. BJOG. 2020 Oct;127(11):1374-1380. | CrossRef | PubMed |
- Walker KF, O'Donoghue K, Grace N, Dorling J, Comeau JL, Li W, et al. Maternal transmission of SARS-COV-2 to the neonate, and possible routes for such transmission: a systematic review and critical analysis. BJOG. 2020 Oct;127(11):1324-1336. | CrossRef | PubMed |
- Organización Panamericana de la Salud. COVID-19: Recomendaciones para el cuidado integral de mujeres embarazadas y recién nacidos. 2020. Geneva: Organización Mundial de la Salud; 2020 [On line]. | Link |
- Blumberg DA, Underwood MA, Hedriana HL, Lakshminrusimha S. Vertical Transmission of SARS-CoV-2: What is the Optimal Definition? Am J Perinatol. 2020 Jun;37(8):769-772. | CrossRef | PubMed |
- Soler MJ, Lloveras J, Batlle D. Enzima conversiva de la angiotensina 2 y su papel emergente en la regulación del sistema renina-angiotensina [Angiotensin converting enzyme 2 and its emerging role in the regulation of the renin angiotensin system]. Med Clin (Barc). 2008 Jul 12;131(6):230-6. Spanish. | CrossRef | PubMed |
- Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020 Mar;579(7798):270-273. | CrossRef | PubMed |
- Llaque P. Infección por el nuevo coronavirus 2019 en niños. Rev Peru Med Exp Salud Publica. 2020 Apr Jun;37(2):335-340. Spanish. | CrossRef | PubMed |
- Santos Sara. Transmisión vertical SARS-CoV-2. Rev. Esp. Salud Publica. 2020 [On line]. | Link |
- Vivanti AJ, Vauloup-Fellous C, Prevot S, Zupan V, Suffee C, Do Cao J, et al. Transplacental transmission of SARS-CoV-2 infection. Nat Commun. 2020 Jul 14;11(1):3572. | CrossRef | PubMed |
- Bravo-Grau S, Cruz J. Estudios de exactitud diagnóstica: Herramientas para su Interpretación. Rev Chil Radiol. 2015; 21(4):158-164. | CrossRef |
- Medina M. Generalidades de las pruebas diagnósticas, y su utilidad en la toma de decisiones médicas. Rev. Colomb. Psiquiat. 2011;40(4):787-797. | CrossRef |
- Simões E Silva AC, Leal CRV. Is SARS-CoV-2 Vertically Transmitted? Front Pediatr. 2020 May 15;8:276. | CrossRef | PubMed |
 Schwartz DA, Graham AL. Potential Maternal and Infant Outcomes from (Wuhan) Coronavirus 2019-nCoV Infecting Pregnant Women: Lessons from SARS, MERS, and Other Human Coronavirus Infections. Viruses. 2020 Feb 10;12(2):194. | CrossRef | PubMed |
Schwartz DA, Graham AL. Potential Maternal and Infant Outcomes from (Wuhan) Coronavirus 2019-nCoV Infecting Pregnant Women: Lessons from SARS, MERS, and Other Human Coronavirus Infections. Viruses. 2020 Feb 10;12(2):194. | CrossRef | PubMed | Duran P, Berman S, Niermeyer S, Jaenisch T, Forster T, Gomez Ponce de Leon R, et al. COVID-19 and newborn health: systematic review. Rev Panam Salud Publica. 2020 Apr 27;44:e54. | CrossRef | PubMed |
Duran P, Berman S, Niermeyer S, Jaenisch T, Forster T, Gomez Ponce de Leon R, et al. COVID-19 and newborn health: systematic review. Rev Panam Salud Publica. 2020 Apr 27;44:e54. | CrossRef | PubMed | Organización Mundial de la Salud. Coronavirus disease (COVID-2019) situation reports-130. 2020. Geneva: Organización Mundial de la Salud; 2020. [On line] | Link |
Organización Mundial de la Salud. Coronavirus disease (COVID-2019) situation reports-130. 2020. Geneva: Organización Mundial de la Salud; 2020. [On line] | Link | Ministerio de Salud. Casos confirmados por Coronavirus COVID-19 ascienden a 183 198 en el Perú (Comunicado N° 121). 2020. Lima: MINSA; 2020 [On line]. | Link |
Ministerio de Salud. Casos confirmados por Coronavirus COVID-19 ascienden a 183 198 en el Perú (Comunicado N° 121). 2020. Lima: MINSA; 2020 [On line]. | Link | Zeng H, Xu C, Fan J, Tang Y, Deng Q, Zhang W, et al. Antibodies in Infants Born to Mothers With COVID-19 Pneumonia. JAMA. 2020 May 12;323(18):1848-1849. | CrossRef | PubMed |
Zeng H, Xu C, Fan J, Tang Y, Deng Q, Zhang W, et al. Antibodies in Infants Born to Mothers With COVID-19 Pneumonia. JAMA. 2020 May 12;323(18):1848-1849. | CrossRef | PubMed | Dong L, Tian J, He S, Zhu C, Wang J, Liu C, et al. Possible Vertical Transmission of SARS-CoV-2 From an Infected Mother to Her Newborn. JAMA. 2020 May 12;323(18):1846-1848. | CrossRef | PubMed |
Dong L, Tian J, He S, Zhu C, Wang J, Liu C, et al. Possible Vertical Transmission of SARS-CoV-2 From an Infected Mother to Her Newborn. JAMA. 2020 May 12;323(18):1846-1848. | CrossRef | PubMed | Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet. 2020 Mar 7;395(10226):809-815. | CrossRef | PubMed |
Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W, et al. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet. 2020 Mar 7;395(10226):809-815. | CrossRef | PubMed | Karimi-Zarchi M, Neamatzadeh H, Dastgheib SA, Abbasi H, Mirjalili SR, Behforouz A, et al. Vertical Transmission of Coronavirus Disease 19 (COVID-19) from Infected Pregnant Mothers to Neonates: A Review. Fetal Pediatr Pathol. 2020 Jun;39(3):246-250. | CrossRef | PubMed |
Karimi-Zarchi M, Neamatzadeh H, Dastgheib SA, Abbasi H, Mirjalili SR, Behforouz A, et al. Vertical Transmission of Coronavirus Disease 19 (COVID-19) from Infected Pregnant Mothers to Neonates: A Review. Fetal Pediatr Pathol. 2020 Jun;39(3):246-250. | CrossRef | PubMed | Zaigham M, Andersson O. Maternal and perinatal outcomes with COVID-19: A systematic review of 108 pregnancies. Acta Obstet Gynecol Scand. 2020 Jul;99(7):823-829. | CrossRef | PubMed |
Zaigham M, Andersson O. Maternal and perinatal outcomes with COVID-19: A systematic review of 108 pregnancies. Acta Obstet Gynecol Scand. 2020 Jul;99(7):823-829. | CrossRef | PubMed | Zhu H, Wang L, Fang C, Peng S, Zhang L, Chang G, et al. Clinical analysis of 10 neonates born to mothers with 2019-nCoV pneumonia. Transl Pediatr. 2020 Feb;9(1):51-60. | CrossRef | PubMed |
Zhu H, Wang L, Fang C, Peng S, Zhang L, Chang G, et al. Clinical analysis of 10 neonates born to mothers with 2019-nCoV pneumonia. Transl Pediatr. 2020 Feb;9(1):51-60. | CrossRef | PubMed | Josep Argimon Pallás, Josep Jiménez Villa. Métodos de Investigación Clínica y Epidemiolçogica. 4ª edición. Barcelona: Elsevier; 2013.
Josep Argimon Pallás, Josep Jiménez Villa. Métodos de Investigación Clínica y Epidemiolçogica. 4ª edición. Barcelona: Elsevier; 2013.  Zhang W, Du RH, Li B, Zheng XS, Yang XL, Hu B, et al. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect. 2020 Feb 17;9(1):386-389. | CrossRef | PubMed |
Zhang W, Du RH, Li B, Zheng XS, Yang XL, Hu B, et al. Molecular and serological investigation of 2019-nCoV infected patients: implication of multiple shedding routes. Emerg Microbes Infect. 2020 Feb 17;9(1):386-389. | CrossRef | PubMed | Aguilar-Gamboa F. Desafíos para el manejo y detección de pacientes con COVID-19 en Latinoamérica. Rev Exp Med. 2020;6(1):63-7. | CrossRef |
Aguilar-Gamboa F. Desafíos para el manejo y detección de pacientes con COVID-19 en Latinoamérica. Rev Exp Med. 2020;6(1):63-7. | CrossRef | Yan J, Guo J, Fan C, Juan J, Yu X, Li J, et al. Coronavirus disease 2019 in pregnant women: a report based on 116 cases. Am J Obstet Gynecol. 2020 Jul;223(1):111.e1-111.e14. | CrossRef | PubMed |
Yan J, Guo J, Fan C, Juan J, Yu X, Li J, et al. Coronavirus disease 2019 in pregnant women: a report based on 116 cases. Am J Obstet Gynecol. 2020 Jul;223(1):111.e1-111.e14. | CrossRef | PubMed | Mendoza M, Garcia-Ruiz I, Maiz N, Rodo C, Garcia-Manau P, Serrano B, et al. Pre-eclampsia- like syndrome induced by severe COVID-19: a prospective observational study. BJOG. 2020 Oct;127(11):1374-1380. | CrossRef | PubMed |
Mendoza M, Garcia-Ruiz I, Maiz N, Rodo C, Garcia-Manau P, Serrano B, et al. Pre-eclampsia- like syndrome induced by severe COVID-19: a prospective observational study. BJOG. 2020 Oct;127(11):1374-1380. | CrossRef | PubMed | Walker KF, O'Donoghue K, Grace N, Dorling J, Comeau JL, Li W, et al. Maternal transmission of SARS-COV-2 to the neonate, and possible routes for such transmission: a systematic review and critical analysis. BJOG. 2020 Oct;127(11):1324-1336. | CrossRef | PubMed |
Walker KF, O'Donoghue K, Grace N, Dorling J, Comeau JL, Li W, et al. Maternal transmission of SARS-COV-2 to the neonate, and possible routes for such transmission: a systematic review and critical analysis. BJOG. 2020 Oct;127(11):1324-1336. | CrossRef | PubMed | Organización Panamericana de la Salud. COVID-19: Recomendaciones para el cuidado integral de mujeres embarazadas y recién nacidos. 2020. Geneva: Organización Mundial de la Salud; 2020 [On line]. | Link |
Organización Panamericana de la Salud. COVID-19: Recomendaciones para el cuidado integral de mujeres embarazadas y recién nacidos. 2020. Geneva: Organización Mundial de la Salud; 2020 [On line]. | Link | Blumberg DA, Underwood MA, Hedriana HL, Lakshminrusimha S. Vertical Transmission of SARS-CoV-2: What is the Optimal Definition? Am J Perinatol. 2020 Jun;37(8):769-772. | CrossRef | PubMed |
Blumberg DA, Underwood MA, Hedriana HL, Lakshminrusimha S. Vertical Transmission of SARS-CoV-2: What is the Optimal Definition? Am J Perinatol. 2020 Jun;37(8):769-772. | CrossRef | PubMed | Soler MJ, Lloveras J, Batlle D. Enzima conversiva de la angiotensina 2 y su papel emergente en la regulación del sistema renina-angiotensina [Angiotensin converting enzyme 2 and its emerging role in the regulation of the renin angiotensin system]. Med Clin (Barc). 2008 Jul 12;131(6):230-6. Spanish. | CrossRef | PubMed |
Soler MJ, Lloveras J, Batlle D. Enzima conversiva de la angiotensina 2 y su papel emergente en la regulación del sistema renina-angiotensina [Angiotensin converting enzyme 2 and its emerging role in the regulation of the renin angiotensin system]. Med Clin (Barc). 2008 Jul 12;131(6):230-6. Spanish. | CrossRef | PubMed | Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020 Mar;579(7798):270-273. | CrossRef | PubMed |
Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020 Mar;579(7798):270-273. | CrossRef | PubMed | Llaque P. Infección por el nuevo coronavirus 2019 en niños. Rev Peru Med Exp Salud Publica. 2020 Apr Jun;37(2):335-340. Spanish. | CrossRef | PubMed |
Llaque P. Infección por el nuevo coronavirus 2019 en niños. Rev Peru Med Exp Salud Publica. 2020 Apr Jun;37(2):335-340. Spanish. | CrossRef | PubMed | Vivanti AJ, Vauloup-Fellous C, Prevot S, Zupan V, Suffee C, Do Cao J, et al. Transplacental transmission of SARS-CoV-2 infection. Nat Commun. 2020 Jul 14;11(1):3572. | CrossRef | PubMed |
Vivanti AJ, Vauloup-Fellous C, Prevot S, Zupan V, Suffee C, Do Cao J, et al. Transplacental transmission of SARS-CoV-2 infection. Nat Commun. 2020 Jul 14;11(1):3572. | CrossRef | PubMed | Bravo-Grau S, Cruz J. Estudios de exactitud diagnóstica: Herramientas para su Interpretación. Rev Chil Radiol. 2015; 21(4):158-164. | CrossRef |
Bravo-Grau S, Cruz J. Estudios de exactitud diagnóstica: Herramientas para su Interpretación. Rev Chil Radiol. 2015; 21(4):158-164. | CrossRef | Medina M. Generalidades de las pruebas diagnósticas, y su utilidad en la toma de decisiones médicas. Rev. Colomb. Psiquiat. 2011;40(4):787-797. | CrossRef |
Medina M. Generalidades de las pruebas diagnósticas, y su utilidad en la toma de decisiones médicas. Rev. Colomb. Psiquiat. 2011;40(4):787-797. | CrossRef |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis








