Key Words: melanoma, panniculitis, BRAF kinases, adverse drug reaction
Resumen
Las terapias target constituyen hoy en día una alternativa terapéutica cada vez más utilizada para el manejo de pacientes con melanoma metastásico. Sin embargo, se han descrito múltiples efectos farmacológicos adversos asociados a su uso, siendo los cutáneos los de mayor prevalencia. Se presenta el caso de un hombre de 55 años con diagnóstico de melanoma cutáneo metastásico etapa IV, BRAFV600E mutado, en tratamiento con dabrafenib/trametinib que consultó por desarrollo de lesiones nodulares eritematosas sensibles en extremidades superiores e inferiores, asociadas a sensación febril durante el curso del tratamiento. Se descartó alguna infección sobreagregada. Se realizó una biopsia de las lesiones cutáneas, con confirmación diagnóstica histopatológica de una paniculitis mixta de predominio septal, granulomatosa y con vasculitis leucocitoclástica. La paniculitis asociada a esta terapia ha sido descrita en la literatura y se ha considerado un efecto farmacológico inmunomediado adverso, relacionándose a un mejor pronóstico para el melanoma metastásico en tratamiento. Por lo tanto, así como en el caso presentado, se evita la suspensión del fármaco y se asocia terapia sintomática en caso de mayores molestias del paciente. Es de alta relevancia para el dermatólogo conocer e interpretar adecuadamente este efecto adverso farmacológico, y así indicar el manejo más adecuado para el paciente.
|
Ideas claves
|
Introducción
Las terapias blanco o target son tratamientos basados en drogas capaces de interferir en procesos críticos del crecimiento y supervivencia de la célula neoplásica, actuando sobre ciertas moléculas específicas[1]. En oncología presenta un amplio uso en diversas neoplasias, teniendo en melanoma metastásico un rol relevante, mediante el bloqueo de la señalización intracelular de la vía MAPK (del inglés Mitogen-Activated Protein Kinase)[2].
Dentro de los esquemas terapéuticos para el melanoma metastásico asociado a mutaciones activantes del oncogén BRAF, está la combinación de inhibidores BRAF y MEK, asociación que busca disminuir la posibilidad de resistencia a la terapia, pero que implica una serie de reacciones adversas al medicamento secundarias a su uso, especialmente cutáneas[3].
A continuación reportamos un caso clínico de un paciente que presentó una paniculitis, con confirmación histopatológica, en contexto de terapia target con dabrafenib/trametinib por melanoma metastásico. Este efecto adverso, con escasos reportes internacionales[4] y sin reportes nacionales, traduciría una mejor respuesta a la terapia descrita de melanoma metastásico, lo que resulta de alto interés para el clínico. Para este caso se contó con consentimiento informado del paciente.
Reporte de caso
Hombre de 55 años, con antecedente de melanoma metastásico, que se manifestó con compromiso a nivel ganglionar, pulmonar y columna vertebral en tomografía por emisión de positrones/tomografía computarizada (PET-CT, del inglés Positron Emission Tomography- Computed Tomography). El primario cutáneo fue pesquisado en región supraclavicular derecha, como una lesión eritematosa extirpada por cirugía convencional, con diagnóstico histológico de melanoma spitzoide. Se inició inmunoterapia con nivolumab con mala respuesta clínica tras seis ciclos de terapia, por lo que se realizó estudio adicional de BRAFV600E resultando mutado, decidiéndose inicio de terapia target con dabrafenib/trametinib.
Tras ocho meses de tratamiento, el paciente consultó por lesiones maculares eritematosas dolorosas en extremidades inferiores de dos meses de evolución, asociadas a sensación febril. Al examen físico presentaba múltiples máculas y nódulos eritematosos, de predominio en extremidades superiores e inferiores dolorosas a la palpación (Figura 1). Se hospitalizó para estudio y se realizaron exámenes de laboratorio. Entre ellos destacaba un hemograma con anemia leve, sin leucocitosis, proteína C reactiva 71 miligramos por litro, virus herpes simple 59 milímetros por hora y láctico deshidrogenasa 32 unidades por litro. Las funciones renal y hepática estaban conservadas. Los cultivos resultaron negativos.
Fue evaluado por el equipo de dermatología y, bajo la hipótesis diagnóstica de un eritema nodoso secundario a la terapia, se le realizó biopsia punch 6 milímetros de lesión eritematosas de muslo derecho. El estudio histopatológico informó paniculitis mixta de predominio septal, granulomatosa y con vasculitis leucocitoclástica de vasos pequeños, asociada a dermatitis linfoplasmocitaria superficial y profunda (Figura 2). Se consideró un efecto adverso farmacológico de la terapia, pero asociado a buen pronóstico. Por este motivo, se indicó mantener el tratamiento, agregando antipiréticos y analgésicos en caso necesario.
Figura 2. Estudio histopatológico.
Discusión
La terapia target actualmente se considera dentro de los pilares para el tratamiento del melanoma metastásico asociado a BRAF mutado, siendo la terapia combinada la de elección en estos casos[5]. Dentro de las reacciones cutáneas adversas al medicamento más frecuentes descritas para inhibidores BRAF se incluye erupción cutánea, tumores (queratosis, carcinomas espinocelulares, dermatitis seborreica, dermatosis palmoplantar, fotosensibilidad y paniculitis entre otras)[6]; las cuales disminuyen globalmente si se emplea terapia combinada BRAF/MEK (dabrafenib/trametinib), en contraste a monoterapia[7].
Particularmente, la paniculitis como reacción adversa a terapia target se ha relacionado con la familia anti-BRAF (dabrafenib o vemurafenib) como monoterapia, con menor número de reportes asociados a la combinación BRAF/MEK (dabrafenib/trametinib)[4]. La presentación clínica simula un eritema nodoso con afectación frecuente, tanto de extremidades inferiores como superiores, con una latencia de 48 días como mediana en diversos estudios y con diferentes hallazgos histológicos. Dentro de ellos, lo más frecuentemente descrito es una paniculitis mixta con infiltrado neutrofílico[8].
En suma, nuestro caso clínico presentó el cuadro clínico característico con una latencia clínica tras la exposición al fármaco más acotada respecto a la media. En el análisis histológico presentó, además, vasculitis leucocitoclástica; hallazgo muy poco descrito[8]. El diagnóstico diferencial considera morfea profunda, paniculitis lúpica, síndrome de Sweet, paniculitis por bypass intestinal, paniculitis por deficiencia de α-1 antitripsina, paniculitis infecciosa y paniculitis facticia[3].
La paniculitis, al igual que el vitíligo secundario a este tipo de terapias, representaría una manifestación in vivo de una activación inmune secundaria a la terapia target. Esto debe ser conocido por el equipo médico tratante, pues se ha reportado en estudios retrospectivos que el grupo de pacientes que presentan dicha dichas reacciones inmunomediadas tienen un menor riesgo de progresión de la enfermedad, en contraste con el grupo de pacientes en terapia target que no presentan dichas manifestaciones (Hazard ratio: 0,53; intervalo de confianza 95%: 0,29 a 0,98, p = 0,04), lo que se podría traducir en mejores cifras de sobrevida general y tiempo libre de progresión[9],[10].
Se ha propuesto entonces, que ante todo paciente en tratamiento con esta terapia que evolucione con un cuadro clínico de paniculitis como el reportado en nuestro caso, se realice una exploración de signos y síntomas sistémicos, un estudio de laboratorio básico de hemograma, proteína C reactiva, creatincinasa, electrolitos plasmáticos y otras pruebas de acuerdo a la sintomatología del paciente. Si la historia y el estudio no orientan otra posible etiología de la paniculitis, y el paciente no presenta signos clínicos de vasculitis, debiese enfrentarse como una reacción secundaria al tratamiento y optar por un manejo sintomático consistente en reposo, analgésicos y/o corticoides. Además, dentro de lo posible, se sugiere evitar la suspensión farmacológica, opción que debiese ser considerada sólo en casos de dolor muy intenso que no responden al manejo inicial o a la disminución de la dosis del inhibidor BRAF[4] (Figura 3).
Figura 3. Diagrama de flujo ante sospecha de paniculitis por inhibidor BRAF.
Conclusiones
Las manifestaciones cutáneas como la paniculitis son reacciones adversas descritas para las nuevas terapias antineoplásicas. Dado que su uso se ha masificado en la actualidad, es esperable que sean aún más comúnmente observadas por el clínico. Es necesario el conocimiento de estos potenciales efectos adversos por parte de los equipos de salud, y su adecuada interpretación caso a caso, con el fin de entregar al paciente el manejo más adecuado.
Notas
Roles de autoría
VM: conceptualización, metodología, validación, investigación, redacción original, visualización y administración del proyecto. MR: validación, edición y revisión, visualización. AS: validación, edición y revisión. FV: investigación, edición, revisión de redacción y supervisión del proyecto. LC: investigación, edición, revisión de redacción y visualización.
Financiamiento
Los autores no recibieron ningún tipo de financiamiento en este trabajo.
Conflictos de interés
Los autores completaron la declaración de conflictos de interés de ICMJE y declararon que no recibieron fondos por la realización de este artículo; no tienen relaciones financieras con organizaciones que puedan tener interés en el artículo publicado en los últimos tres años y no tienen otras relaciones o actividades que puedan influenciar en la publicación del artículo. Los formularios se pueden solicitar contactando al autor responsable o al Comité Editorial de la Revista.
Consideraciones éticas
El consentimiento informado solicitado por Medwave para la publicación de este reporte de caso, incluyendo las imágenes mostradas, ha sido firmado por el paciente. Los autores declaran que se respetó la privacidad del paciente según las normas de CIOMS, de privacidad de los datos recolectados. Una copia del consentimiento informado fue remitida a la dirección editorial de la revista.

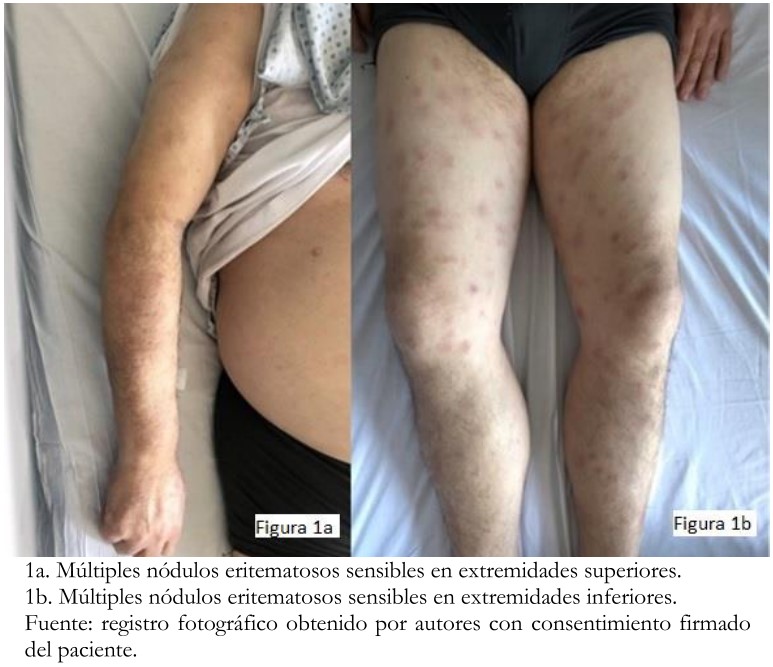 Figura 1. Examen físico.
Figura 1. Examen físico.

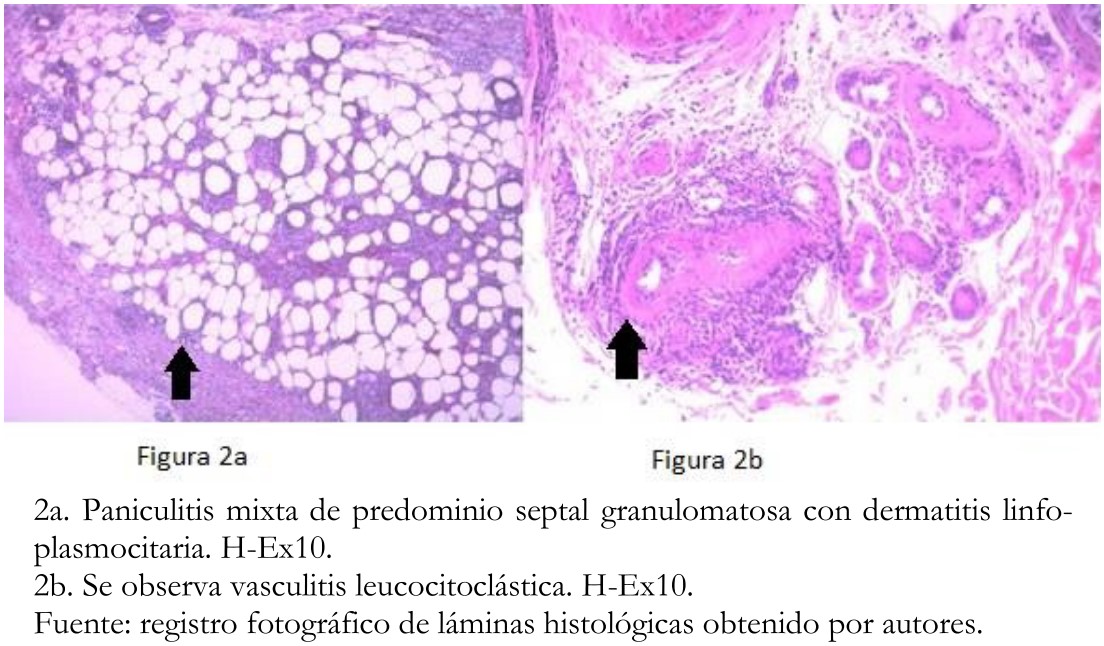 Figura 2. Estudio histopatológico.
Figura 2. Estudio histopatológico.

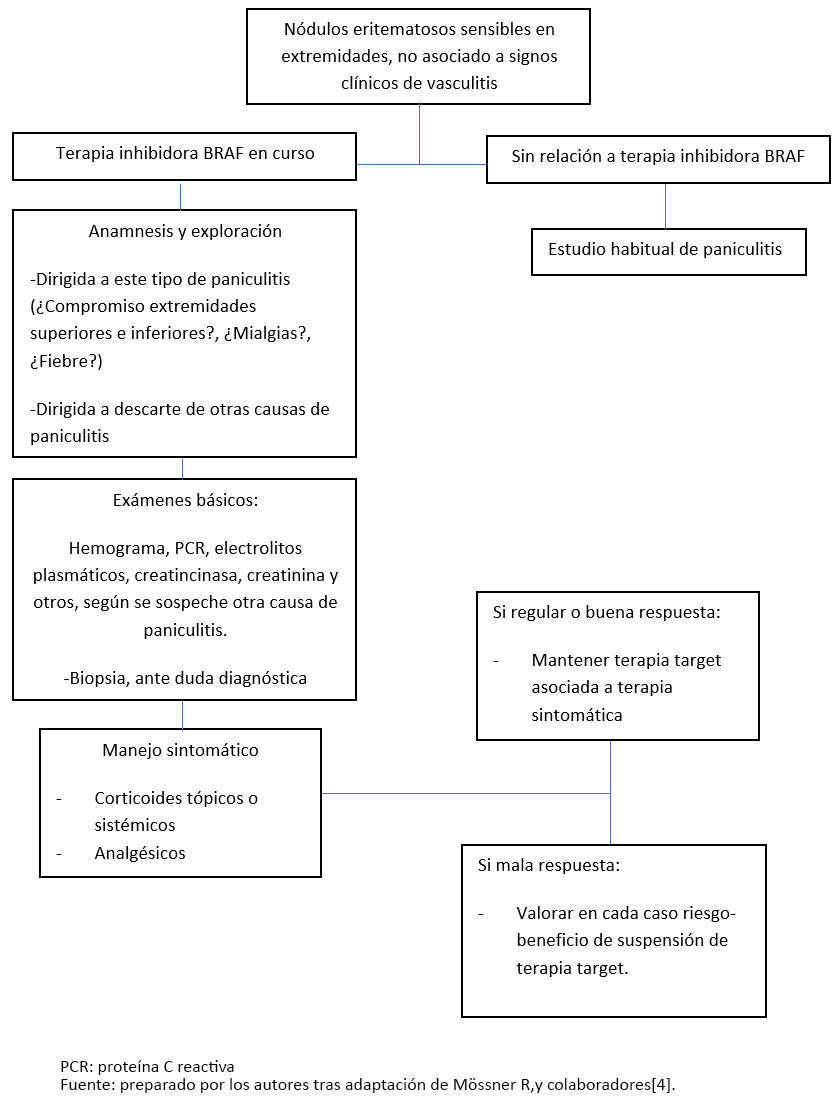 Figura 3. Diagrama de flujo ante sospecha de paniculitis por inhibidor BRAF.
Figura 3. Diagrama de flujo ante sospecha de paniculitis por inhibidor BRAF.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Las terapias target constituyen hoy en día una alternativa terapéutica cada vez más utilizada para el manejo de pacientes con melanoma metastásico. Sin embargo, se han descrito múltiples efectos farmacológicos adversos asociados a su uso, siendo los cutáneos los de mayor prevalencia. Se presenta el caso de un hombre de 55 años con diagnóstico de melanoma cutáneo metastásico etapa IV, BRAFV600E mutado, en tratamiento con dabrafenib/trametinib que consultó por desarrollo de lesiones nodulares eritematosas sensibles en extremidades superiores e inferiores, asociadas a sensación febril durante el curso del tratamiento. Se descartó alguna infección sobreagregada. Se realizó una biopsia de las lesiones cutáneas, con confirmación diagnóstica histopatológica de una paniculitis mixta de predominio septal, granulomatosa y con vasculitis leucocitoclástica. La paniculitis asociada a esta terapia ha sido descrita en la literatura y se ha considerado un efecto farmacológico inmunomediado adverso, relacionándose a un mejor pronóstico para el melanoma metastásico en tratamiento. Por lo tanto, así como en el caso presentado, se evita la suspensión del fármaco y se asocia terapia sintomática en caso de mayores molestias del paciente. Es de alta relevancia para el dermatólogo conocer e interpretar adecuadamente este efecto adverso farmacológico, y así indicar el manejo más adecuado para el paciente.
 Authors:
Víctor Manubens-Vargas[1], Manuel Rodríguez-Ortubia[1], Alejandra Salas-Gianini[1], Fernando Valenzuela[1], Laura Carreño-Toro[2]
Authors:
Víctor Manubens-Vargas[1], Manuel Rodríguez-Ortubia[1], Alejandra Salas-Gianini[1], Fernando Valenzuela[1], Laura Carreño-Toro[2]
Affiliation:
[1] Departamento de Dermatología, Facultad de Medicina, Universidad de Chile, Santiago, Chile
[2] Servicio de Anatomía Patológica, Hospital Clínico Universidad de Chile, Santiago, Chile
E-mail: victor.manubens.v@gmail.com
Author address:
[1] Santos Dumont 999, Independencia Santiago, Chile

Citation: Manubens-Vargas V, Rodríguez-Ortubia M, Salas-Gianini A, Valenzuela F, Carreño-Toro L. Panniculitis in association with target therapy in melanoma patient, what the dermatologist should know: A case report. Medwave 2020;20(7):e8010 doi: 10.5867/medwave.2020.07.8010
Submission date: 3/5/2020
Acceptance date: 12/8/2020
Publication date: 26/8/2020
Origin: Not commissioned
Type of review: Externally peer-reviewed by three reviewers, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Sawyers C. Targeted cancer therapy. Nature. 2004 Nov 18;432(7015):294-7. | CrossRef | PubMed |
- McArthur GA, Chapman PB, Robert C, Larkin J, Haanen JB, Dummer R, et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014 Mar;15(3):323-32. | CrossRef | PubMed |
- Macdonald JB, Macdonald B, Golitz LE, LoRusso P, Sekulic A. Cutaneous adverse effects of targeted therapies: Part II: Inhibitors of intracellular molecular signaling pathways. J Am Acad Dermatol. 2015 Feb;72(2):221-36; quiz 237-8. | CrossRef | PubMed |
- Mössner R, Zimmer L, Berking C, Hoeller C, Loquai C, Richtig E, et al. Erythema nodosum-like lesions during BRAF inhibitor therapy: Report on 16 new cases and review of the literature. J Eur Acad Dermatol Venereol. 2015 Sep;29(9):1797-806. | CrossRef | PubMed |
- Robert C, Grob JJ, Stroyakovskiy D, Karaszewska B, Hauschild A, Levchenko E, et al. Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med. 2019 Aug 15;381(7):626-636. | CrossRef | PubMed |
- Hwang SJ, Anforth R, Carlos G, Fernandez-Peñas P. Cutaneous Adverse Events of New Anti-melanoma Therapies: Classification and Management. Actas Dermosifiliogr. 2017 Jan-Feb;108(1):6-16. | CrossRef | PubMed |
- Carlos G, Anforth R, Clements A, Menzies AM, Carlino MS, Chou S, et al. Cutaneous Toxic Effects of BRAF Inhibitors Alone and in Combination With MEK Inhibitors for Metastatic Melanoma. JAMA Dermatol. 2015 Oct;151(10):1103-9. | CrossRef | PubMed |
- Choy B, Chou S, Anforth R, Fernández-Peñas P. Panniculitis in patients treated with BRAF inhibitors: a case series. Am J Dermatopathol. 2014 Jun;36(6):493-7. | CrossRef | PubMed |
- Consoli F, Manganoni AM, Grisanti S, Petrelli F, Venturini M, Rangoni G, et al. Panniculitis and vitiligo occurring during BRAF and MEK inhibitors combination in advanced melanoma patients: Potential predictive role of treatment efficacy. PLoS One. 2019 Apr 2;14(4):e0214884. | CrossRef | PubMed |
- Ben-Betzalel G, Baruch EN, Boursi B, Steinberg-Silman Y, Asher N, Shapira-Frommer R, et al. Possible immune adverse events as predictors of durable response to BRAF inhibitors in patients with BRAF V600-mutant metastatic melanoma. Eur J Cancer. 2018 Sep;101:229-235. | CrossRef | PubMed |
 McArthur GA, Chapman PB, Robert C, Larkin J, Haanen JB, Dummer R, et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014 Mar;15(3):323-32. | CrossRef | PubMed |
McArthur GA, Chapman PB, Robert C, Larkin J, Haanen JB, Dummer R, et al. Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol. 2014 Mar;15(3):323-32. | CrossRef | PubMed | Macdonald JB, Macdonald B, Golitz LE, LoRusso P, Sekulic A. Cutaneous adverse effects of targeted therapies: Part II: Inhibitors of intracellular molecular signaling pathways. J Am Acad Dermatol. 2015 Feb;72(2):221-36; quiz 237-8. | CrossRef | PubMed |
Macdonald JB, Macdonald B, Golitz LE, LoRusso P, Sekulic A. Cutaneous adverse effects of targeted therapies: Part II: Inhibitors of intracellular molecular signaling pathways. J Am Acad Dermatol. 2015 Feb;72(2):221-36; quiz 237-8. | CrossRef | PubMed | Mössner R, Zimmer L, Berking C, Hoeller C, Loquai C, Richtig E, et al. Erythema nodosum-like lesions during BRAF inhibitor therapy: Report on 16 new cases and review of the literature. J Eur Acad Dermatol Venereol. 2015 Sep;29(9):1797-806. | CrossRef | PubMed |
Mössner R, Zimmer L, Berking C, Hoeller C, Loquai C, Richtig E, et al. Erythema nodosum-like lesions during BRAF inhibitor therapy: Report on 16 new cases and review of the literature. J Eur Acad Dermatol Venereol. 2015 Sep;29(9):1797-806. | CrossRef | PubMed | Robert C, Grob JJ, Stroyakovskiy D, Karaszewska B, Hauschild A, Levchenko E, et al. Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med. 2019 Aug 15;381(7):626-636. | CrossRef | PubMed |
Robert C, Grob JJ, Stroyakovskiy D, Karaszewska B, Hauschild A, Levchenko E, et al. Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. N Engl J Med. 2019 Aug 15;381(7):626-636. | CrossRef | PubMed | Hwang SJ, Anforth R, Carlos G, Fernandez-Peñas P. Cutaneous Adverse Events of New Anti-melanoma Therapies: Classification and Management. Actas Dermosifiliogr. 2017 Jan-Feb;108(1):6-16. | CrossRef | PubMed |
Hwang SJ, Anforth R, Carlos G, Fernandez-Peñas P. Cutaneous Adverse Events of New Anti-melanoma Therapies: Classification and Management. Actas Dermosifiliogr. 2017 Jan-Feb;108(1):6-16. | CrossRef | PubMed | Carlos G, Anforth R, Clements A, Menzies AM, Carlino MS, Chou S, et al. Cutaneous Toxic Effects of BRAF Inhibitors Alone and in Combination With MEK Inhibitors for Metastatic Melanoma. JAMA Dermatol. 2015 Oct;151(10):1103-9. | CrossRef | PubMed |
Carlos G, Anforth R, Clements A, Menzies AM, Carlino MS, Chou S, et al. Cutaneous Toxic Effects of BRAF Inhibitors Alone and in Combination With MEK Inhibitors for Metastatic Melanoma. JAMA Dermatol. 2015 Oct;151(10):1103-9. | CrossRef | PubMed | Choy B, Chou S, Anforth R, Fernández-Peñas P. Panniculitis in patients treated with BRAF inhibitors: a case series. Am J Dermatopathol. 2014 Jun;36(6):493-7. | CrossRef | PubMed |
Choy B, Chou S, Anforth R, Fernández-Peñas P. Panniculitis in patients treated with BRAF inhibitors: a case series. Am J Dermatopathol. 2014 Jun;36(6):493-7. | CrossRef | PubMed |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis








