Key Words: rheumatoid arthritis, alopecia areata, alopecia universalis, leflunomide
Resumen
La artritis reumatoide es una enfermedad de tipo autoinmune. Por su carácter altamente invalidante, requiere de manejo farmacológico agresivo. Para ello, habitualmente se hace necesario el uso de drogas inmunomoduladoras agrupadas bajo el nombre de fármacos antirreumáticos modificadores de la enfermedad. Uno de los utilizados con mayor frecuencia es la leflunomida, la cual por su mecanismo de acción es capaz de suprimir ejes fundamentales en el proceso de la enfermedad. Sin embargo, su uso no se encuentra exento de efectos secundarios. Si bien existen series que reportan que los efectos adversos más prevalentes son diarrea, náuseas, exantema y alopecia, existen escasos reportes de casos de alopecia areata universal secundaria al uso de leflunomida. A propósito de un caso en el Hospital Regional de Talca, se realizó una revisión de la literatura acerca del tema.
Introducción
La artritis reumatoide es la enfermedad autoinmune con mayor prevalencia en Latinoamérica, afectando entre 0,4 y 1% de la población [1]. Por su sintomatología altamente invalidante, precisa de tratamientos con diversas drogas inmunosupresoras y terapias biológicas, agrupadas bajo el nombre de fármacos antirreumáticos modificadores de la enfermedad.
La leflunomida es uno de los fármacos antirreumáticos modificadores de la enfermedad, más utilizados en el tratamiento de la artritis reumatoide. Su mecanismo de acción consiste en la inhibición de la enzima dihidroorato deshidrogenasa, clave en la síntesis de novo de las pirimidinas vía predominante en los linfocitos T activados. Además, participa bloqueando la acción del factor de necrosis tumoral α [2],[3]. Ambos, cumplen un rol patogénico principal en la artritis reumatoide.
Todo tratamiento farmacológico no está exento de efectos adversos. La leflunomida cuenta con varios estudios que corroboran su perfil de seguridad, dando a conocer los efectos adversos más frecuentes relacionados a su consumo. Uno de los primeros trabajos realizados fue por el grupo Smolen et al., el cual reporta un 19% de efectos adversos, siendo los más frecuentes diarrea, náuseas, hipertensión arterial, alteración de las pruebas hepáticas, infecciones secundarias a inmunosupresión, exantema, alopecia y neuropatía periférica [4]. Si bien la alopecia es un efecto adverso conocido [2],[3],[4], existen escasos reportes en la literatura de alopecia areata universal secundaria al uso de leflunomida.
Caso clínico
Previo consentimiento informado, se presenta el caso de una paciente de sexo femenino, de 35 años, con antecedente de sinovectomía en 2007 con biopsia compatible con artritis reumatoide. Inicia controles en 2010 en el Hospital Regional de Talca con factor reumatoide y anticuerpo anti péptido citrulinado negativos.
Se inicia terapia con prednisona en dosis bajas (10 mg al día), celecoxib (200 mg al día), ácido fólico (5 mg semanal) y metotrexato hasta 15 mg semanal, debiendo suspender terapia con metotrexato en mayo de 2011 por alteración de pruebas hepáticas. En julio de 2011 se decide iniciar tratamiento con azatioprina hasta 125 mg sin respuesta satisfactoria, persistiendo con poliartritis, velocidad de sedimentación globular y proteína C reactiva permanentemente elevadas. Tras normalización de pruebas hepáticas, en abril de 2012 se suspende azatioprina y se inicia terapia con leflunomida. Por su potencial teratogénico reportado en estudios clínicos animales, se decide iniciar método anticonceptivo en conjunto con la utilización de esta droga.
En controles posteriores al inicio del tratamiento con leflunomida, se constata buena tolerancia gastrointestinal, sin alteraciones de enzimas hepáticas, manteniéndose con cifras de presión arterial dentro de rango normal, sin reporte de infecciones intercurrentes, exantemas ni alopecia, con regular respuesta en cuanto a alivio de dolor e impotencia funcional.
En agosto de 2013, por persistencia de artritis reumatoide activa (18 de 28 articulaciones inflamadas), velocidad de sedimentación globular: 94 mm/hr y proteína C reactiva: 78 mg/l, con importante limitación funcional; inicia terapia biológica con etanercept 50 mg subcutáneo semanal, asociada a leflunomida 20 mg al día. La paciente evoluciona favorablemente, recuperando su capacidad funcional, con disminución de articulaciones inflamadas, llegando a cero en algunos controles y con tendencia a la baja de parámetros inflamatorios (velocidad de sedimentación globular y proteína C reactiva), con buena tolerancia de medicamentos y sin reporte de efectos secundarios.
En agosto de 2014, la paciente inicia con caída de pelo progresiva. Evaluada por dermatología, se diagnostica alopecia areata y se inicia tratamiento con minoxidil tópico, persistiendo la progresión de caída del pelo. Se realiza estudio de mesenquimopatías con anticuerpos negativos. En octubre de 2014 la paciente se presenta con alopecia areata universal (Figuras 1 y 2). Es reevaluada por equipo de reumatología y dermatología. Se analizaron leflunomida y etanercept como posibles gatillantes de la alopecia y, dadas las características clínicas de ésta, se concluyó alopecia areata universal secundaria a uso de leflunomida. Por esta razón se realizó prueba terapéutica, se suspendió leflunomida y se agregó colestiramina por 10 días para acelerar el proceso de eliminación del fármaco. Además, se indicó tratamiento tópico con difenciprona como manejo coadyuvante para alopecia. Se inició lento recrecimiento de pelo tras cuatro meses de suspensión de terapia con leflunomida (Figura 3), manteniendo etanercept con regular control de su artritis reumatoide.

Figura 1. Alopecia areata en entremidades.

Figura 2. Alopecia areata en cuero cabelludo.
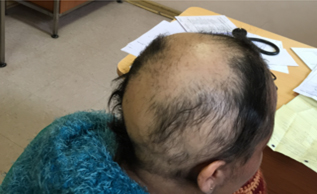
Figura 3. Crecimiento de pelo en cuero cabelludo, cuatro meses después de la suspensión de leflunomida.
Discusión
La alopecia areata es una enfermedad de tipo autoinmune, que representa una forma clásica de pérdida de pelo en piel no cicatricial. Afecta cualquier área del cuerpo provista de pelo, siendo la localización más frecuente el cuello cabelludo (90%) [5]. Se produce en distintas etnias, edades y en ambos sexos. En Estados Unidos se estima su prevalencia entre 0,1 y 0,2% de la población [5],[6], con un riesgo de desarrollo de enfermedad en el transcurso de la vida de 2,0% [7].
El crecimiento del folículo piloso es un proceso cíclico, el cual consta de tres etapas. La primera de ellas, y la más importante en la fisiopatología de la alopecia areata, es la fase anágena, la más activa y con mayor crecimiento y pigmentación del pelo. Le sigue la fase catágena, en la cual se produce apoptosis e involución del folículo piloso. Finalmente, la fase telógena es una etapa de quiescencia, previa al reinicio del nuevo ciclo [8],[9].
El folículo piloso es considerado un santuario inmunológico, puesto que cuenta con características inmunológicas privilegiadas que proporcionan un medio que en condiciones normales, hacen poco probable un ataque autoinmune. Esto se establece mediante regulación a la baja de los complejos de histocompatibilidad mayor I y II, con lo cual disminuyen plausiblemente la presentación de autoantígenos en los linfocitos T CD8+ [9],[10]. Sin embargo, este equilibrio se ve afectado en la alopecia areata al producirse a nivel del folículo piloso un infiltrado celular-inflamatorio que inhibe el crecimiento del pelo. Esto se da principalmente en la fase anágena, puesto que se cree que los antígenos más inmunogénicos son los asociados a la producción de pigmento, especialmente abundantes en esta fase del ciclo [9],[11].
Debido a su asociación con otras enfermedades autoinmunes como vitiligo [12], se piensa que existiría susceptibilidad genética para desarrollar alopecia areata. No obstante, sería necesario algún desencadenante ambiental para la expresión de la enfermedad, como son fármacos, estrés, dieta, infecciones, entre otros [13]. Dentro de los desencadenantes de la alopecia areata juegan un rol fundamental los fármacos. En el campo de la reumatología, existen diversas drogas que tienen entre sus efectos adversos más frecuentes la caída de pelo. A pesar de ello, existen escasos reportes en la literatura sobre alopecia areata como efecto secundario a las terapias utilizadas en este campo.
Existe sólo un caso de alopecia areata y uso de leflunomida como monoterapia en una paciente con artritis reumatoide, publicado por Gottenberg et al. en el año 2002. En esta paciente se manifestó como alopecia areata en parches tras tres semanas de iniciado el tratamiento, posterior a lo cual se suspendió la leflunomida con recrecimiento del pelo luego de tres meses sin el fármaco [14].
Otra revisión, realizada por Navarro et al. en 2012, muestra la asociación entre alopecia areata, uso de leflunomida y terapia biológica, particularmente anti factor de necrosis tumoral α, adalimumab, etanercept e infliximab. Esta publicación deja de manifiesto que el tiempo de aparición de este efecto adverso es variable, pudiendo fluctuar entre las 24 y 48 horas, hasta las 208 semanas después de iniciado el fármaco [15]. Por ello, no es extraño que la paciente citada en este trabajo haya presentado este efecto adverso tras dos años de uso de terapia con leflunomida.
Ha sido particularmente controvertida la asociación entre uso de drogas anti factor de necrosis tumoral α [16] y la aparición de alopecia areata, puesto que una de la citoquinas implicadas en la patogénesis de la alopecia areata sería el factor de necrosis tumoral α, por lo que se vislumbraba como una de las posibles terapias a esta enfermedad. No obstante, algunos reportes muestran asociación de tipo causa-efecto entre esta terapia biológica y la aparición de alopecia areata [16],[17],[18]. Sin embargo, la patogénesis de esta asociación sigue siendo materia de investigación.
Conclusión
La artritis reumatoide es una enfermedad que puede causar gran impotencia funcional en los pacientes que la padecen. Debido a esto, es necesario emplear diversas drogas con el fin de lograr objetivos terapéuticos que mejoren el dolor y la funcionalidad. Con el advenimiento de nuevos fármacos antirreumáticos modificadores de la enfermedad, surgen nuevas aristas en el tratamiento de la artritis reumatoide. Para la utilización de estas drogas, es necesario conocer los efectos adversos que producen, el tiempo en cual se desarrollan y su forma de presentación habitual.
Notas
Aspectos éticos
El consentimiento informado solicitado por Medwave, ha sido firmado por la paciente; una copia de este fue remitido a la dirección editorial de la revista.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos intereses del ICMJE traducido al castellano por Medwave, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiación externas.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

La artritis reumatoide es una enfermedad de tipo autoinmune. Por su carácter altamente invalidante, requiere de manejo farmacológico agresivo. Para ello, habitualmente se hace necesario el uso de drogas inmunomoduladoras agrupadas bajo el nombre de fármacos antirreumáticos modificadores de la enfermedad. Uno de los utilizados con mayor frecuencia es la leflunomida, la cual por su mecanismo de acción es capaz de suprimir ejes fundamentales en el proceso de la enfermedad. Sin embargo, su uso no se encuentra exento de efectos secundarios. Si bien existen series que reportan que los efectos adversos más prevalentes son diarrea, náuseas, exantema y alopecia, existen escasos reportes de casos de alopecia areata universal secundaria al uso de leflunomida. A propósito de un caso en el Hospital Regional de Talca, se realizó una revisión de la literatura acerca del tema.
 Authors:
María Ignacia Molina Molina[1], Carmen María Pinochet Paiva[2], José Ignacio Quezada Morales[1]
Authors:
María Ignacia Molina Molina[1], Carmen María Pinochet Paiva[2], José Ignacio Quezada Morales[1]
Affiliation:
[1] Facultad Medicina, Universidad Católica del Maule, Talca, Chile
[2] Hospital Regional de Talca, Región del Maule, Chile
E-mail: mignaciamolina@gmail.com
Author address:
[1] Avenida San Miguel 3605
Talca
Región del Maule
Chile

Citation: Molina Molina MI, Pinochet Paiva CM, Quezada Morales JI. Alopecia areata secondary to the use of leflunomide in patients with rheumatoid arthritis: a case report and literature review. Medwave 2015 Dic;15(11):e6350 doi: 10.5867/medwave.2015.11.6350
Submission date: 9/11/2015
Acceptance date: 22/12/2015
Publication date: 30/12/2015
Origin: not requested
Type of review: reviewed by one external peer reviewer, double-blind

Comments (0)
We are pleased to have your comment on one of our articles. Your comment will be published as soon as it is posted. However, Medwave reserves the right to remove it later if the editors consider your comment to be: offensive in some sense, irrelevant, trivial, contains grammatical mistakes, contains political harangues, appears to be advertising, contains data from a particular person or suggests the need for changes in practice in terms of diagnostic, preventive or therapeutic interventions, if that evidence has not previously been published in a peer-reviewed journal.
No comments on this article.
To comment please log in
 Medwave provides HTML and PDF download counts as well as other harvested interaction metrics.
Medwave provides HTML and PDF download counts as well as other harvested interaction metrics. There may be a 48-hour delay for most recent metrics to be posted.

- Cardiel MH; Latin American Rheumatology Associations of the Pan-American League of Associations for Rheumatology (PANLAR); Grupo Latinoamericano de Estudio de Artritis Reumatoide (GLADAR). First Latin American position paper on the pharmacological treatment of rheumatoid arthritis. Rheumatology (Oxford). 2006 Jun;45 Suppl 2:ii7-ii22. | PubMed |
- Smolen JS, Emery P. Efficacy and safety of leflunomide in active rheumatoid arthritis. Rheumatology (Oxford). 2000 Jun;39 Suppl 1:48-56. | PubMed |
- Wiacek R, Kolossa K, Jankowski T, Jeka S, Karmowski A, Karmowski M, et al. The efficacy and safety of leflunomide in patients with active rheumatoid arthritis. Adv Clin Exp Med. 2012 May-Jun;21(3):337-42. | PubMed |
- Smolen JS, Kalden JR, Scott DL, Rozman B, Kvien TK, Larsen A, et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicentre trial. European Leflunomide Study Group. Lancet. 1999 Jan 23;353(9149):259-66. | PubMed |
- Alkhalifah A, Alsantali A, Wang E, McElwee KJ, Shapiro J. Alopecia areata update: part I. Clinical picture, histopathology, and pathogenesis. J Am Acad Dermatol. 2010 Feb;62(2):177-88, quiz 189-90. | CrossRef | PubMed |
- Safavi K. Prevalence of alopecia areata in the First National Health and Nutrition Examination Survey. Arch Dermatol. 1992 May;128(5):702. | PubMed |
- Finner AM. Alopecia areata: Clinical presentation, diagnosis, and unusual cases. Dermatol Ther. 2011 May-Jun;24(3):348-54. | CrossRef | PubMed |
- Schneider MR, Schmidt-Ullrich R, Paus R. The hair follicle as a dynamic miniorgan. Curr Biol. 2009 Feb 10;19(3):R132-42. | CrossRef | PubMed |
- Gilhar A, Etzioni A, Paus R. Alopecia areata. N Engl J Med. 2012 Apr 19;366(16):1515-25. | CrossRef | PubMed |
- Ito T, Ito N, Saatoff M, Hashizume H, Fukamizu H, Nickoloff BJ, et al. Maintenance of hair follicle immune privilege is linked to prevention of NK cell attack. J Invest Dermatol. 2008 May;128(5):1196-206. | PubMed |
- Meyer KC, Klatte JE, Dinh HV, Harries MJ, Reithmayer K, Meyer W, et al. Evidence that the bulge region is a site of relative immune privilege in human hair follicles. Br J Dermatol. 2008 Nov;159(5):1077-85. | CrossRef | PubMed |
- Kuchabal SD, Kuchabal DS. Alopecia Areata Associated with Localized Vitiligo. Case Rep Dermatol. 2010 Mar 27;2(1):27-31. | PubMed |
- Ito T. Recent advances in the pathogenesis of autoimmune hair loss disease alopecia areata. Clin Dev Immunol. 2013;2013:348546. | CrossRef | PubMed |
- Gottenberg JE, Venancie PY, Mariette X. Alopecia areata in a patient with rheumatoid arthritis treated with leflunomide. J Rheumatol. 2002 Aug;29(8):1806-7. | PubMed |
- Navarro R, Daudén E, Gallo E, Santiago Sánchez-Mateos D, García-Diez A. Alopecia areata during treatment of psoriasis with adalimumab and leflunomide: a case and review of the literature. Skin Pharmacol Physiol. 2012;25(2):107-10. | CrossRef | PubMed |
- Chaves Y, Duarte G, Ben-Said B, Tebib J, Berard F, Nicolas JF. Alopecia areata universalis during treatment of rheumatoid arthritis with anti-TNF-alpha antibody (adalimumab). Dermatology. 2008;217(4):380. | CrossRef | PubMed |
- Lazzarini R, Capareli GC, Buense R, Lellis RF. Alopecia universalis during treatment with leflunomide and adalimumab - case report. An Bras Dermatol. 2014 Mar-Apr;89(2):320-2. | PubMed |
- Costa L, Atteno M, Caso F, Scarpato L, Del Puente A, Scarpa R. Alopecia areata in a patient with psoriatic arthritis and Crohn's disease receiving etanercept. Int J Rheum Dis. 2014 Feb;17(2):219-20. | CrossRef | PubMed |
 Cardiel MH; Latin American Rheumatology Associations of the Pan-American League of Associations for Rheumatology (PANLAR); Grupo Latinoamericano de Estudio de Artritis Reumatoide (GLADAR). First Latin American position paper on the pharmacological treatment of rheumatoid arthritis. Rheumatology (Oxford). 2006 Jun;45 Suppl 2:ii7-ii22. | PubMed |
Cardiel MH; Latin American Rheumatology Associations of the Pan-American League of Associations for Rheumatology (PANLAR); Grupo Latinoamericano de Estudio de Artritis Reumatoide (GLADAR). First Latin American position paper on the pharmacological treatment of rheumatoid arthritis. Rheumatology (Oxford). 2006 Jun;45 Suppl 2:ii7-ii22. | PubMed | Smolen JS, Emery P. Efficacy and safety of leflunomide in active rheumatoid arthritis. Rheumatology (Oxford). 2000 Jun;39 Suppl 1:48-56. | PubMed |
Smolen JS, Emery P. Efficacy and safety of leflunomide in active rheumatoid arthritis. Rheumatology (Oxford). 2000 Jun;39 Suppl 1:48-56. | PubMed | Wiacek R, Kolossa K, Jankowski T, Jeka S, Karmowski A, Karmowski M, et al. The efficacy and safety of leflunomide in patients with active rheumatoid arthritis. Adv Clin Exp Med. 2012 May-Jun;21(3):337-42. | PubMed |
Wiacek R, Kolossa K, Jankowski T, Jeka S, Karmowski A, Karmowski M, et al. The efficacy and safety of leflunomide in patients with active rheumatoid arthritis. Adv Clin Exp Med. 2012 May-Jun;21(3):337-42. | PubMed | Smolen JS, Kalden JR, Scott DL, Rozman B, Kvien TK, Larsen A, et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicentre trial. European Leflunomide Study Group. Lancet. 1999 Jan 23;353(9149):259-66. | PubMed |
Smolen JS, Kalden JR, Scott DL, Rozman B, Kvien TK, Larsen A, et al. Efficacy and safety of leflunomide compared with placebo and sulphasalazine in active rheumatoid arthritis: a double-blind, randomised, multicentre trial. European Leflunomide Study Group. Lancet. 1999 Jan 23;353(9149):259-66. | PubMed | Alkhalifah A, Alsantali A, Wang E, McElwee KJ, Shapiro J. Alopecia areata update: part I. Clinical picture, histopathology, and pathogenesis. J Am Acad Dermatol. 2010 Feb;62(2):177-88, quiz 189-90. | CrossRef | PubMed |
Alkhalifah A, Alsantali A, Wang E, McElwee KJ, Shapiro J. Alopecia areata update: part I. Clinical picture, histopathology, and pathogenesis. J Am Acad Dermatol. 2010 Feb;62(2):177-88, quiz 189-90. | CrossRef | PubMed | Safavi K. Prevalence of alopecia areata in the First National Health and Nutrition Examination Survey. Arch Dermatol. 1992 May;128(5):702. | PubMed |
Safavi K. Prevalence of alopecia areata in the First National Health and Nutrition Examination Survey. Arch Dermatol. 1992 May;128(5):702. | PubMed | Finner AM. Alopecia areata: Clinical presentation, diagnosis, and unusual cases. Dermatol Ther. 2011 May-Jun;24(3):348-54. | CrossRef | PubMed |
Finner AM. Alopecia areata: Clinical presentation, diagnosis, and unusual cases. Dermatol Ther. 2011 May-Jun;24(3):348-54. | CrossRef | PubMed | Schneider MR, Schmidt-Ullrich R, Paus R. The hair follicle as a dynamic miniorgan. Curr Biol. 2009 Feb 10;19(3):R132-42. | CrossRef | PubMed |
Schneider MR, Schmidt-Ullrich R, Paus R. The hair follicle as a dynamic miniorgan. Curr Biol. 2009 Feb 10;19(3):R132-42. | CrossRef | PubMed | Gilhar A, Etzioni A, Paus R. Alopecia areata. N Engl J Med. 2012 Apr 19;366(16):1515-25. | CrossRef | PubMed |
Gilhar A, Etzioni A, Paus R. Alopecia areata. N Engl J Med. 2012 Apr 19;366(16):1515-25. | CrossRef | PubMed | Ito T, Ito N, Saatoff M, Hashizume H, Fukamizu H, Nickoloff BJ, et al. Maintenance of hair follicle immune privilege is linked to prevention of NK cell attack. J Invest Dermatol. 2008 May;128(5):1196-206. | PubMed |
Ito T, Ito N, Saatoff M, Hashizume H, Fukamizu H, Nickoloff BJ, et al. Maintenance of hair follicle immune privilege is linked to prevention of NK cell attack. J Invest Dermatol. 2008 May;128(5):1196-206. | PubMed | Meyer KC, Klatte JE, Dinh HV, Harries MJ, Reithmayer K, Meyer W, et al. Evidence that the bulge region is a site of relative immune privilege in human hair follicles. Br J Dermatol. 2008 Nov;159(5):1077-85. | CrossRef | PubMed |
Meyer KC, Klatte JE, Dinh HV, Harries MJ, Reithmayer K, Meyer W, et al. Evidence that the bulge region is a site of relative immune privilege in human hair follicles. Br J Dermatol. 2008 Nov;159(5):1077-85. | CrossRef | PubMed | Kuchabal SD, Kuchabal DS. Alopecia Areata Associated with Localized Vitiligo. Case Rep Dermatol. 2010 Mar 27;2(1):27-31. | PubMed |
Kuchabal SD, Kuchabal DS. Alopecia Areata Associated with Localized Vitiligo. Case Rep Dermatol. 2010 Mar 27;2(1):27-31. | PubMed | Ito T. Recent advances in the pathogenesis of autoimmune hair loss disease alopecia areata. Clin Dev Immunol. 2013;2013:348546. | CrossRef | PubMed |
Ito T. Recent advances in the pathogenesis of autoimmune hair loss disease alopecia areata. Clin Dev Immunol. 2013;2013:348546. | CrossRef | PubMed | Gottenberg JE, Venancie PY, Mariette X. Alopecia areata in a patient with rheumatoid arthritis treated with leflunomide. J Rheumatol. 2002 Aug;29(8):1806-7. | PubMed |
Gottenberg JE, Venancie PY, Mariette X. Alopecia areata in a patient with rheumatoid arthritis treated with leflunomide. J Rheumatol. 2002 Aug;29(8):1806-7. | PubMed | Navarro R, Daudén E, Gallo E, Santiago Sánchez-Mateos D, García-Diez A. Alopecia areata during treatment of psoriasis with adalimumab and leflunomide: a case and review of the literature. Skin Pharmacol Physiol. 2012;25(2):107-10. | CrossRef | PubMed |
Navarro R, Daudén E, Gallo E, Santiago Sánchez-Mateos D, García-Diez A. Alopecia areata during treatment of psoriasis with adalimumab and leflunomide: a case and review of the literature. Skin Pharmacol Physiol. 2012;25(2):107-10. | CrossRef | PubMed | Chaves Y, Duarte G, Ben-Said B, Tebib J, Berard F, Nicolas JF. Alopecia areata universalis during treatment of rheumatoid arthritis with anti-TNF-alpha antibody (adalimumab). Dermatology. 2008;217(4):380. | CrossRef | PubMed |
Chaves Y, Duarte G, Ben-Said B, Tebib J, Berard F, Nicolas JF. Alopecia areata universalis during treatment of rheumatoid arthritis with anti-TNF-alpha antibody (adalimumab). Dermatology. 2008;217(4):380. | CrossRef | PubMed | Lazzarini R, Capareli GC, Buense R, Lellis RF. Alopecia universalis during treatment with leflunomide and adalimumab - case report. An Bras Dermatol. 2014 Mar-Apr;89(2):320-2. | PubMed |
Lazzarini R, Capareli GC, Buense R, Lellis RF. Alopecia universalis during treatment with leflunomide and adalimumab - case report. An Bras Dermatol. 2014 Mar-Apr;89(2):320-2. | PubMed |Systematization of initiatives in sexual and reproductive health about good practices criteria in response to the COVID-19 pandemic in primary health care in Chile
Clinical, psychological, social, and family characterization of suicidal behavior in Chilean adolescents: a multiple correspondence analysis








