
 Para Descargar PDF debe Abrir sesión.
Para Descargar PDF debe Abrir sesión.
Palabras clave: Klebsiella pneumoniae, drug resistance, urinary infections
Las carbapenemasas son uno de los mecanismos enzimáticos de resistencia antimicrobiana, que compromete la mayor parte de los antibióticos betalactámicos. Por lo general, su producción se debe al uso indiscriminado de antimicrobianos. A nivel mundial, la expansión de este mecanismo de resistencia es inminente y las medidas de control son limitadas. Con el objeto de discutir los problemas relacionados a este mecanismo emergente de resistencia, reportamos un caso de Klebsiella pneumoniae productora de carbapenemasas en Huancayo, la Región de la Sierra Central de Perú.
Nos dirigimos hacia la era post antibiótica, donde las infecciones que actualmente son tratables se convertirán en mortales [1]. Este alarmante hecho viene expandiéndose rápidamente a nivel mundial, y Perú no está al margen de esta situación. Un ejemplo de ello son las bacterias de la familia Enterobacteriaceae resistentes a carbapenémicos, las cuales están asociadas a altas tasas de mortalidad debido a las limitadas opciones terapéuticas [1],[2]. A pesar de las múltiples estrategias utilizadas para reducir este problema, las únicas medidas de control que han mostrado ser eficaces son el correcto lavado de manos, las estrictas precauciones de contacto y el uso racional de antimicrobianos [3].
Los carbapenémicos, por su parte, corresponden a la última línea de antimicrobianos dentro de la familia de los betalactámicos. Estos son utilizados en situaciones donde se presenta resistencia a cefalosporinas, aminopenicilinas, ureidopenicilinas u otros antimicrobianos de uso habitual. Las carbapenemasas son un grupo de enzimas capaces de hidrolizar a esta familia de antimicrobianos.
En términos generales, las beta-lactamasas se pueden clasificar en dos tipos [4]:
Clasificaciones
Diferentes autores han clasificado a las betalactamasas de múltiples maneras. Actualmente la clasificación más utilizada es la de Ambler [4]. Según este autor, las betalactamasas se dividen en cuatro clases: A, B, C y D. Las clases A y D son serino-betalactamasas, las de clase B metalo-betalactamasas, y las de clase C cefalosporinasas [4]. Esta clasificación surge en 1980, al analizar muestras de betalactamasas capaces de hidrolizar carbapenémicos que no podían ser inhibidas por el ácido etilen-diamino-tertra-acético. A estas betalactamasas se les denominó serino-betalactamasas, para diferenciarlas de las que sí podían ser inhibidas por este ácido, como las metalo-betalactamasas.
De esta clasificación, las carbapenemasas se encuentran dentro de los grupo A, B y D; de modo que las clases A y D corresponden a serino-carbapenemasas, y las de clase B a metalo-carbapenemasas.
En algunos casos, la hiperexpresión de genes de resistencia que no hidrolizan carbapenémicos puede dar lugar a actividad carbapenemasa. Lo anterior sucede con las carbapenemasas clase C. Esta clase de enzimas corresponde más bien a la hiperproducción de la enzima AmpC, la cual de manera normal no hidroliza carbapenémicos. Sin embargo, cuando sus mecanismos de autorregulación se ven alterados, produce una hiperexpresión del gen ampC con la consiguiente hiperexpresión de la enzima AmpC, lo que lleva a la degradación de carbapenémicos. La Figura 1 muestra la clasificación de las carbapenemasas según Ambler.
Figura 1. Clasificación de las carbapenemasas según Ambler.
Otra clasificación utilizada es la de Bush y colaboradores [5]. Esta cataloga las betalactamasas según sus características funcionales, agrupándolas en cuatro conjuntos:
- Grupo 1: cefalosporinasas.
- Grupo 2: serinobetalactamasas.
- Grupo 3: metalobetalactamasas.
- Grupo 4: betalactamasas no caracterizadas por completo.
De esta clasificación, las carbapenemasas corresponden a los grupos 1, grupo 2 (2df, 2f) y grupo 3 (3a, 3b y 3c).
Los primeros casos de Klebsiella pneumoniae productora de carbapenemasas fueron reportados en Estados Unidos en 1996. Posteriormente, el año 2005 se reportó el primer caso de Klebsiella pneumoniae productora de carbapenemasas en América Latina (Medellín, Colombia), en 2012 se informó el primer caso en Chile y en 2013 el primer caso de carbapenemasa producida por Klebsiella pneumoniae en Lima, Perú [6],[7]. En la Tabla 1 se muestra la integración entre las clasificaciones [5] de Ambler y de Bush.
Tabla 1. Clasificación de las carbapenemasas según Ambler & Bush, adaptado de Bush Jacoby [5].
El objetivo de este reporte de caso es discutir en torno al uso racional de antimicrobianos, y la real necesidad de tratar infecciones del tracto urinario asintomáticas mediante la presentación de un caso clínico. Ello, dado que aun cuando el fenotipo de resistencia tiente al médico a la eliminación del microorganismo, se debe tener siempre presente que éste pudiese formar parte de una microbiota que coloniza al paciente. Por este motivo, el tratar dicha colonización puede dar lugar a la expresión de diversos mecanismos de resistencia en microorganismos que naturalmente no los expresan y que no están causando enfermedad.
Se trata de un paciente de sexo masculino de 36 años de edad, natural de Huancayo, Perú, con antecedentes de lesión vertebro medular, asociada a paraplejia. Por este motivo se encuentra con kinesioterapia motora y es usuario de sonda Folley intermitentemente.
En los últimos cinco años, el paciente ha presentado cinco episodios de infecciones de tracto urinario, recibiendo en dos ocasiones tratamiento con ciprofloxacino de manera ambulatoria. Posteriormente, los últimos tres episodios de infecciones de tracto urinario han requerido hospitalización. En el primer período se trató con ceftriaxona y con imipenem en las dos últimas hospitalizaciones.
El 28 de agosto de 2016, el paciente fue hospitalizado al obtenerse un resultado de urocultivo con desarrollo de Klebsiella pneumoniae resistente a carbapenénmicos (Tabla 2). En dicha oportunidad recibió tratamiento antimicrobiano con imipenem hasta completar siete días, a la espera de valoración por el equipo de infectología.
Paralelamente, se procedió a instaurar precauciones de contacto para el paciente, además de la búsqueda activa de los contactos intrahospitalarios e intradomiciliarios. Durante el periodo hospitalario no se aisló este patógeno en ninguna otra muestra (28 camas, esposa e hijo), y los pacientes que estuvieron en contacto no presentaron ningún cuadro de infección aguda durante su hospitalización.
Meses después se realizaron dos urocultivos de control al paciente, con un intervalo de 15 días de diferencia. En ellos se evidenció la presencia del mismo microorganismo y fenotipo de resistencia que en etapas anteriores. Esto no se asoció a sintomatología urinaria, motivo por el cual fue considerado como una colonización.
Un año después de la pesquisa de la cepa, el paciente se encontraba estable, sin síntomas urinarios y continuó recibiendo kinesioterapia motora por la secuela del traumatismo vertebro medular.
Respecto del diagnóstico microbiológico, la primera muestra para urocultivo fue tomada en el servicio de emergencia con fecha 28 de agosto de 2016. En esa oportunidad se procedió a la identificación y estudio de susceptibilidad antimicrobiana mediante sistema automatizado Vitek®2 Compact, identificándose la cepa de Klebsiella pneumoniae con fenotipo de resistencia a carbapenémicos.
La confirmación diagnóstica de la producción de carbapenemasas se realizó mediante el método de Kirby Bauer, de acuerdo a los lineamientos del Clinical Laboratory Standards Institute 2015 y del Manual de Procedimientos para la detección fenotípica de carbapenemasas (2014) de la Sociedad Científica Peruana de Microbiología. De igual modo, se le realizó el test fenotípico de Hodge.
Finalmente, el 20 de septiembre de 2016 la cepa fue enviada al Instituto Nacional de Salud de Perú. El 3 de octubre de ese año se confirmó el hallazgo de Klebsiella pneumoniae productora de carbapenemasas, mediante la reacción de polimerasa en cadena convencional.
Tabla 2. Antibiograma para Klebsiella pneumoniae.
Las carbapenemasas son un grupo de enzimas que poseen la capacidad de hidrolizar los antibióticos carbapenémicos. Las carbapenemasas del tipo Klebsiella pneumoniae carbapenemase, corresponden a la clase A de Ambler y grupo 2f de Bush. Estas son las enzimas aisladas con mayor frecuencia a nivel mundial [5].
Entre los factores para su adquisición se incluyen inmunosupresión, exposición previa a antibióticos de amplio espectro, presencia de catéter urinario y estancia prolongada en unidades de cuidados intensivos [8],[9]. Desde 2011 que en Perú se realiza vigilancia epidemiológica de la resistencia antimicrobiana [10]. A raíz de ella, en 2013 y 2014 se reportaron los primeros casos de carabapenemasas en la capital de nuestro país, Lima. Lamentablemente estos dos casos fueron mortales, a diferencia del presentado en este trabajo que representa una colonización por Klebsiella pneumoniae productora de carbapenemasas. Hasta 2017 no se habían identificado nuevos perfiles de resistencia, los que se presentaron en otras ciudades del país.
El año 2009, los Centros para el Control y Prevención de Enfermedades de los Estados Unidos (CDC), difundieron las estrategias para el control de las infecciones por enterobacterias productoras de carbapenemasas. Se tomaron como puntos principales: el aislamiento del caso índice, la implementación de protocolos de detección de cepas resistentes a carbapenémicos, y la vigilancia semanal de contactos del caso índice [11]. Asimismo, un estudio de pacientes colonizados con Klebsiella pneumoniae productora de carbapenemasas señaló que la instauración de medidas de bioseguridad en hospitales de alta prevalencia, disminuyen la incidencia de este microorganismo [12].
Otro aspecto muy importante es valorar la colonización por Klebsiella pneumoniae productora de carbapenemasas. Un estudio demostró que la duración de la colonización es menor de cuatro semanas en 17% de los pacientes; mientras que 83% de ellos permanecen colonizados por más de cuatro semanas con una media de duración de 270 días [13]. En el presente caso, el paciente persistió colonizado por Klebsiella pneumoniae productora de carbapenemasas luego de un año.
En cuanto a las medidas para el manejo de las infecciones por Klebisella pneumoniae productora de carbapenemasas, estas se basan en dos ejes principales. En primer lugar resulta fundamental el control y contención del caso índice, con el fin de disminuir la transmisibilidad del microorganismo. Estas medidas de control constan de lavado clínico de manos estricto, precauciones de contacto y desinfección diaria de las superficies en la unidad en donde se encuentra el paciente.
Considerando que la Klebsiella pneumoniae forma parte de la microbiota intestinal, es que algunos autores sugieren la realización de hisopados rectales de rutina [14]. Ello, con la finalidad de detectar precozmente a los pacientes portadores de esta bacteria con fenotipos de resistencia XDR, ya sea del tipo betalactamasas de espectro extendido o carbapenemasas producidas por Klebsiella pneumoniae.
Es importante tener en cuenta que las carbapenemasas producidas por Klebsiella pneumoniae son plasmidiales. Por este motivo, de no establecerse las medidas de control de manera precoz, el riesgo de traspaso plasmidial entre distintos géneros bacterianos es elevado. Esto podría generar el mismo fenotipo de resistencia en otros microorganismos que se encuentran en coinfección en el mismo paciente o en otras unidades clínicas, lo que constituiría una infección asociada a la atención en salud.
En cuanto al manejo farmacológico, una vez detectada la cepa se debe valorar que esta no sea colonización. Posteriormente, ya definido que el microorganismo está causando enfermedad en el paciente, el esquema recomendado consta de colistin (polimixina E), asociado a meropenem o imipenem, o bien el uso de ceftazidima-avibactam [15].
Otros autores han descrito remisión total de infecciones por Klebsiella pneumoniae productora de carbapenemasas en hemocultivos, con el uso de fosfomicina a dosis altas vía oral (nueve gramos cada ocho horas), asociada a otros antibióticos según antibiograma. Este tratamiento habría dado resultados de hemocultivos negativos a los dos días de iniciado el esquema [16].
Otra opción es el empleo de fosfomicina en monoterapia a dosis altas (ocho gramos cada ocho horas) vía intravenosa, con resultado de cultivos negativos a las 24 horas desde iniciada la terapia [17]. Cabe destacar que la biodisponibilidad de fosfomicina es de aproximadamente 30% cuando es administrada por vía oral. Por ende, el uso de fosfomicina oral ha de ser a dosis altas para simular la dosis de administración intravenosa recomendada de tres gramos cada ocho horas. La administración vía oral de este antimicrobiano se debe a que muchos países aún no cuentan con la presentación intravenosa, viéndose obligados a utilizar otras vías para la administración del fármaco teniendo en cuenta sus parámetros farmacocinéticos.
Como se acaba de mencionar, tener presente la farmacocinética de cada antimicrobiano [18],[19], resulta crucial a la hora de predecir la concentración de antibiótico deseada en distintos compartimentos extravasculares. Los parámetros farmacocinéticos de los antimicrobianos indicados en infección por Klebsiella pneumoniae productora de carbapenemasas, se presentan en la Tabla 3.
En cuanto al impacto en la mortalidad asociado a este patógeno, se observó en un hospital de Estados Unidos, una mortalidad de 32,1% para Klebsiella pneumoniae productora de carbapenemasas, en comparación a 9,9% para cepas sensibles [20]. No se dispone de estudios de mortalidad por Klebsiella pneumoniae productora de carbapenemasas en nuestro país, debido a la baja incidencia reportada.
En retrospectiva, detallando la historia clínica, se encontraron como factores de riesgo para la adquisición de esta cepa el uso irracional de antimicrobianos, así como también la utilización crónica de sondaje intermitente por sonda Folley. No se obtuvieron otros datos que contribuyan para la adquisición de una cepa de Klebsiella pneumoniae productora de carbapenemasas.
Lamentablemente, hasta el momento de la elaboración de este reporte, nuestro hospital no cuenta con normativas específicas para el manejo de estos casos. Nuestro actuar respondió al hecho alarmante de aislar un germen multirresistente y su probable repercusión dentro de nuestro hospital.
Los factores de riesgo implicados en la adquisición de cepas resistentes a carbapenémicos en el presente caso clínico, fueron el uso indiscriminado de antimicrobianos en hospitalizaciones previas junto con el uso crónico de sonda Folley intermitente.
En virtud de los antecedentes presentados en este caso, resulta prioritaria la creación de protocolos específicos para el manejo de casos de enterobacterias resistentes a carbapenémicos. Ello, considerando que son estos antimicrobianos los de última línea en el manejo de infecciones graves.
La vigilancia activa mediante hisopados rectales en pacientes hospitalizados ha dado resultados favorables para la detección temprana de fenotipos de resistencia XDR; ya sean betalactamasas de espectro extendido como carbapenemasas producidas por Klebsiella pneumoniae.
El uso de colistin asociado a meropenem o imipenem está indicado siempre y cuando el microorganismo se encuentre causando enfermedad, y no sea parte de la microbiota del paciente como colonización. Ello, al considerar que 83% de los pacientes permanecen colonizados por más de cuatro semanas. Esto implica que no se debe iniciar quimioterapia antimicrobiana en pacientes que cursan infecciones asintomáticas del tracto urinario.
La utilización de fosfomicina en casos de infecciones por Klebsiella pneumoniae resistente a carbapenémicos, se muestra como una buena alternativa cuando los esquemas de primera línea han sido refractarios.
La toma innecesaria de urocultivos, tiende a producir confusión en cuanto al manejo de pacientes con bacteriuria asintomática. Esto tienta al clínico a indicar esquemas antimicrobianos a microorganismos que forman parte de la microbiota del paciente. En consecuencia, ello genera una selección positiva y la expresión de mecanismos de resistencia.
Aspectos éticos
Los autores declaran que se respetó la privacidad de la paciente según las normas de CIOMS, de privacidad de los datos recolectados.
Declaración de conflictos de intereses
Los autores han completado el formulario de declaración de conflictos de intereses del ICMJE, y declaran no haber recibido financiamiento para la realización del reporte; no tener relaciones financieras con organizaciones que podrían tener intereses en el artículo publicado, en los últimos tres años; y no tener otras relaciones o actividades que podrían influir sobre el artículo publicado. Los formularios pueden ser solicitados contactando al autor responsable o a la dirección editorial de la Revista.
Financiamiento
Los autores declaran que no hubo fuentes de financiamiento externo.
Agradecimientos
Al Instituto Nacional de Salud del Perú, por la colaboración en la confirmación de la cepa.

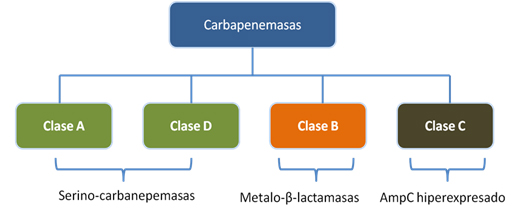 Figura 1. Clasificación de las carbapenemasas según Ambler.
Figura 1. Clasificación de las carbapenemasas según Ambler.

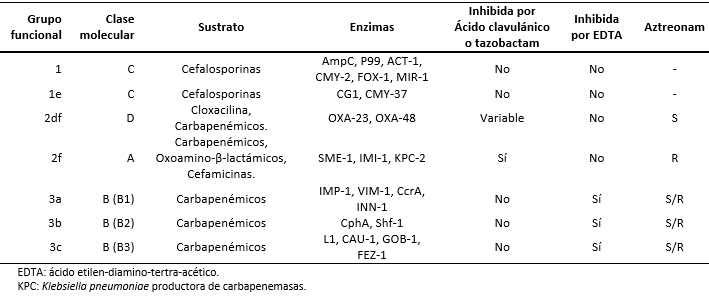 Tabla 1. Clasificación de las carbapenemasas según Ambler & Bush, adaptado de Bush Jacoby [5].
Tabla 1. Clasificación de las carbapenemasas según Ambler & Bush, adaptado de Bush Jacoby [5].

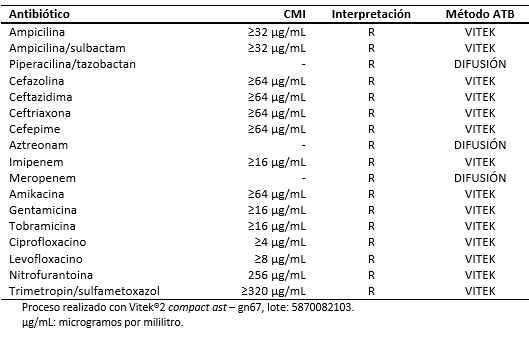 Tabla 2. Antibiograma para Klebsiella pneumoniae.
Tabla 2. Antibiograma para Klebsiella pneumoniae.

 Tabla 3. Parámetros farmacocinéticos de antimicrobianos [16] indicados para Klebsiella pneumoniae productora de carbapenemasas.
Tabla 3. Parámetros farmacocinéticos de antimicrobianos [16] indicados para Klebsiella pneumoniae productora de carbapenemasas.
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.

Carbapenemases are one of the major mechanisms of antimicrobial resistance, usually due to the indiscriminate use of antibiotics. The expansion of this mechanism of resistance at world level is imminent and control measures are limited. In the region of the Central Sierra of Peru - Huancayo, we report a case of carbapenemase-producing Klebsiella pneumoniae, with the purpose of discussing the problems related to this emerging mechanism of antibiotic resistance.
 Autores:
Jhosef Franck Quispe Pari[1,2], Jacqueline Olimpia Ingaruca Rojas[3], Abel Moises Castro Mucha[2], Marivel Liz Castro Ortega[2], Francklin Jhordy Ccoicca Hinojosa[2], Raul Montalvo Otivo[4], Alfonso Agustín Prieto Pozo[5], Francisco Luis Daniel Salvador Sagüez[5,6]
Autores:
Jhosef Franck Quispe Pari[1,2], Jacqueline Olimpia Ingaruca Rojas[3], Abel Moises Castro Mucha[2], Marivel Liz Castro Ortega[2], Francklin Jhordy Ccoicca Hinojosa[2], Raul Montalvo Otivo[4], Alfonso Agustín Prieto Pozo[5], Francisco Luis Daniel Salvador Sagüez[5,6]

Citación: Quispe Pari JF, Ingaruca Rojas JO, Castro Mucha AM, Castro Ortega ML, Ccoicca Hinojosa FJ, Montalvo Otivo R, et al. Carbapenemase producing Klebsiella pneumoniae in Peru: a case report and antimicrobial resistance discussion . Medwave 2018 Mar-Abr;18(2):e7191 doi: 10.5867/medwave.2018.02.7191
Fecha de envío: 11/11/2017
Fecha de aceptación: 29/1/2018
Fecha de publicación: 3/4/2018
Origen: no solicitado
Tipo de revisión: con revisión por un par revisor externo, a doble ciego

Nos complace que usted tenga interés en comentar uno de nuestros artículos. Su comentario será publicado inmediatamente. No obstante, Medwave se reserva el derecho a eliminarlo posteriormente si la dirección editorial considera que su comentario es: ofensivo en algún sentido, irrelevante, trivial, contiene errores de lenguaje, contiene arengas políticas, obedece a fines comerciales, contiene datos de alguna persona en particular, o sugiere cambios en el manejo de pacientes que no hayan sido publicados previamente en alguna revista con revisión por pares.
Nombre/name: Jose Armando Gonzales
Fecha/date: 2018-05-07 17:15:31
Comentario/comment:
Klebsiella pneumoniae productora de carbapenemasas en Perú: ¿Existe la necesidad de más estudios fenotÃpicos y genotÃpicos?
Estimada editora:
He leÃdo con gran interés la publicación de Quispe Pari et al. acerca del aislamiento de Klebsiella pneumoniae productora de carbapenemasa en Perú [1]. Los autores describieron el interesante caso de un paciente de 36 años de Huancayo Perú que tuvo colonización por Klebsiella pneumoniae productora de KPC. Los autores usaron el Sistema automatizado Vitek 2 para la identificación y sensibilidad a antimicrobianos, lo cual les alertó de la presencia de resistencia a carbapenems. También mencionaron que el método de Kirby Bauer fue usado para confirmar la producción de carbapenemasas. A mi parecer esto es impreciso, ya que la detección de carbapenemasas no es posible con el uso de esta técnica. El método de Kirby Bauer solo evalúa resistencia a carbapenem, pero no proporciona información sobre el mecanismo de resistencia, el cual puede ser secundario no solo a carbapenemasas, sino también a mutaciones de porinas o bombas de expulsión.
Para una evaluación más detallada de la producción de carbapenemasas, los autores usaron el test modificado de Hodge, el cual es un buen estudio para detectar la mayorÃa de carbapenemasas. Sin embargo, falsos negativos han sido reportados en casos de cepas productoras de NDM y falsos positivos en casos de mecanismos mixtos de resistencia distintos a carbapenemasas [2]. En años recientes, muchos otros estudios fenotÃpicos han emergido y han mostrado claramente tasas de detección mas altas que el test modificado de Hodge. Entre ellos tenemos el método modificado de inactivación de carbapenem y las pruebas cromogénicas (Carba NP, Rapidec Carba NP, Rapid Cab Blue, etc.). Estas pruebas han mostrado una sensibilidad y especificidad de 88-99% y 99-100% respectivamente [3]. Una clara ventaja de estos métodos es su rapidez para dar resultados, el cual varÃa de 30 minutos a 2 horas [3].
Otro punto de discusión es la detección genotÃpica de KPC reportado por los autores. En su reporte, ellos señalan que la cepa de Klebsiella fue evaluada por el método convencional de reacción de cadena polimerasa, pero no mencionan el tipo de prueba genotÃpica utilizada y no proporcionaron información sobre el tipo de KPC o la secuencia genómica. Actualmente tenemos muchas pruebas para evaluación genotÃpica como el FilmArray BCID, Verigene BC-GN y el X-pert Carba-R. Otra prueba que ha ganado mucha popularidad es el next-generation sequencing. Este método secuencia todo el ADN cromosomal y extracromosomal, permitiendo la identificación de genes responsables de la producción de carbapenemasas, porinas y bombas de expulsión. Esta técnica también nos da datos acerca sobre la afinidad y transmisión de cepas. En el Perú hay información muy limitada acerca de la secuenciación de cepas de Klebsiella. El caso peruano publicado por Horna et al. revela la presencia de una cepa de Klebsiella productora de KPC-2 con una secuencia tipo (ST) 340 [4]. Otros reportes en Latinoamérica han documentado el ST 258 como el clon predominante. Yo creo que el reporte de Quispe Pari et al. es una excelente iniciativa que dará lugar a más estudios claramente necesarios en Perú para determinar la epidemiologÃa de cepas resistentes.
Declaración de Conflicto de Intereses
El autor declara que no tiene conflicto de intereses.
Referencias
1. Quispe Pari JF, Ingaruca Rojas JO, Castro Mucha AM, Castro Ortega ML, Ccoicca Hinojosa FJ, Montalvo Otivo R, Prieto Pozo AA, Salvador Sagüez FLD. Carbapenemase producing Klebsiella pneumoniae in Peru: a case report and antimicrobial resistance discussion. Medwave. 2018 Apr 3; 18(2):e7191. DOI: 10.5867/medwave.2018.02.7191. Spanish, English. PMID:29652297
2. Anderson KF, Lonsway DR, Rasheed JK, Biddle J, Jensen B, McDougal LK, Carey RB, Thompson A, Stocker S, Limbago B, Patel JB. Evaluation of methods to identify the Klebsiella pneumoniae carbapenemase in Enterobacteriaceae. J Clin Microbiol. 2007 Aug; 45(8):2723-5. DOI:10.1128/JCM.00015-07. PMID:17581941
3. Tamma PD, Opene BN, Gluck A, Chambers KK, Carroll KC, Simner PJ. Comparison of 11 Phenotypic Assays for Accurate Detection of Carbapenemase-Producing Enterobacteriaceae. J Clin Microbiol. 2017 Apr; 55(4):1046-1055. DOI:10.1128/JCM.02338-16. PMID:28077701
4. Horna G, Velasquez J, Fernández N, Tamariz J, Ruiz J. Characterisation of the first KPC-2-producing Klebsiella pneumoniae ST340 from Peru. J Glob Antimicrob Resist. 2017 Jun; 9:36-40. DOI: 10.1371/journal.pone.0154092. ECollection 2016.PMID:27104910.
Para comentar debe iniciar sesión
 Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
Medwave publica las vistas HTML y descargas PDF por artículo, junto con otras métricas de redes sociales.
 WHO’s first global report on antibiotic resistance reveals serious, worldwide threat to public health. Who.int. 2018 [on line]. | Link |
WHO’s first global report on antibiotic resistance reveals serious, worldwide threat to public health. Who.int. 2018 [on line]. | Link | Gupta N, Limbago BM, Patel JB, Kallen AJ. Carbapenem-resistant Enterobacteriaceae: epidemiology and prevention. Clin Infect Dis. 2011 Jul 1;53(1):60-7. | CrossRef | PubMed |
Gupta N, Limbago BM, Patel JB, Kallen AJ. Carbapenem-resistant Enterobacteriaceae: epidemiology and prevention. Clin Infect Dis. 2011 Jul 1;53(1):60-7. | CrossRef | PubMed | Garro G. Enterobacterias resistentes a carbapenems, un desafío para la atención hospitalaria. Boletín Epidemiológico Ministerio de Salud del Perú. 2014;23:667-668. | Link |
Garro G. Enterobacterias resistentes a carbapenems, un desafío para la atención hospitalaria. Boletín Epidemiológico Ministerio de Salud del Perú. 2014;23:667-668. | Link | Queenan AM, Bush K. Carbapenemases: the versatile beta-lactamases. Clin Microbiol Rev. 2007 Jul;20(3):440-58, table of contents. | PubMed |
Queenan AM, Bush K. Carbapenemases: the versatile beta-lactamases. Clin Microbiol Rev. 2007 Jul;20(3):440-58, table of contents. | PubMed | Bush K, Jacoby GA. Updated functional classification of beta-lactamases.Antimicrob Agents Chemother. 2010 Mar;54(3):969-76. | CrossRef | PubMed |
Bush K, Jacoby GA. Updated functional classification of beta-lactamases.Antimicrob Agents Chemother. 2010 Mar;54(3):969-76. | CrossRef | PubMed | Velásquez J, Hernández R, Pamo O, Candiotti M, Pinedo Y, Sacsaquispe R et al. Klebsiella pneumoniae resistente a los carbapenemes. Primer caso de carbapenemasa tipo KPC en Perú. Revista de la Sociedad Peruana de Medicina Interna. 2013;26(4):192-196. | Link |
Velásquez J, Hernández R, Pamo O, Candiotti M, Pinedo Y, Sacsaquispe R et al. Klebsiella pneumoniae resistente a los carbapenemes. Primer caso de carbapenemasa tipo KPC en Perú. Revista de la Sociedad Peruana de Medicina Interna. 2013;26(4):192-196. | Link | Cifuentes M, García P, San Martín P, Silva F, Zúñiga J, Reyes S, et al. [First isolation of KPC in Chile: from Italy to a public hospital in Santiago]. Rev Chilena Infectol. 2012 Apr;29(2):224-8. | CrossRef | PubMed |
Cifuentes M, García P, San Martín P, Silva F, Zúñiga J, Reyes S, et al. [First isolation of KPC in Chile: from Italy to a public hospital in Santiago]. Rev Chilena Infectol. 2012 Apr;29(2):224-8. | CrossRef | PubMed | Jiao Y, Qin Y, Liu J, Li Q, Dong Y, Shang Y, et al. Risk factors for carbapenem-resistant Klebsiella pneumoniae infection/colonization and predictors of mortality: a retrospective study. Pathog Glob Health. 2015 Mar;109(2):68-74. | CrossRef | PubMed |
Jiao Y, Qin Y, Liu J, Li Q, Dong Y, Shang Y, et al. Risk factors for carbapenem-resistant Klebsiella pneumoniae infection/colonization and predictors of mortality: a retrospective study. Pathog Glob Health. 2015 Mar;109(2):68-74. | CrossRef | PubMed | Lin MY, Lyles-Banks RD, Lolans K, Hines DW, Spear JB, Petrak R, et al. The importance of long-term acute care hospitals in the regional epidemiology of Klebsiella pneumoniae carbapenemase-producing Enterobacteriaceae. lin Infect Dis. 2013 Nov;57(9):1246-52. | CrossRef | PubMed |
Lin MY, Lyles-Banks RD, Lolans K, Hines DW, Spear JB, Petrak R, et al. The importance of long-term acute care hospitals in the regional epidemiology of Klebsiella pneumoniae carbapenemase-producing Enterobacteriaceae. lin Infect Dis. 2013 Nov;57(9):1246-52. | CrossRef | PubMed | Ministerio de Salud del Perú. Protocolo para la detección de KPC en Enterobacterias. Lima: Centro Nacional de Salud Pública; 2014:1-8. | Link |
Ministerio de Salud del Perú. Protocolo para la detección de KPC en Enterobacterias. Lima: Centro Nacional de Salud Pública; 2014:1-8. | Link | Hayden MK, Lin MY, Lolans K, Weiner S, Blom D, Moore NM, et al. Prevention of colonization and infection by Klebsiella pneumoniae carbapenemase-producing enterobacteriaceae in long-term acute-care hospitals. Clin Infect Dis. 2015 Apr 15;60(8):1153-61. | CrossRef | PubMed |
Hayden MK, Lin MY, Lolans K, Weiner S, Blom D, Moore NM, et al. Prevention of colonization and infection by Klebsiella pneumoniae carbapenemase-producing enterobacteriaceae in long-term acute-care hospitals. Clin Infect Dis. 2015 Apr 15;60(8):1153-61. | CrossRef | PubMed | Guidance for Control of Infections with Carbapenem-Resistant or Carbapenemase-Producing Enterobacteriaceae in Acute Care Facilities. Cdc.gov. 2018 [on line]. | Link |
Guidance for Control of Infections with Carbapenem-Resistant or Carbapenemase-Producing Enterobacteriaceae in Acute Care Facilities. Cdc.gov. 2018 [on line]. | Link | Haverkate MR, Weiner S, Lolans K, Moore NM, Weinstein RA, Bonten MJ, et al. Duration of Colonization With Klebsiella pneumoniae Carbapenemase-Producing Bacteria at Long-Term Acute Care Hospitals in Chicago, Illinois. Open Forum Infect Dis. 2016 Aug 30;3(4):ofw178. | PubMed |
Haverkate MR, Weiner S, Lolans K, Moore NM, Weinstein RA, Bonten MJ, et al. Duration of Colonization With Klebsiella pneumoniae Carbapenemase-Producing Bacteria at Long-Term Acute Care Hospitals in Chicago, Illinois. Open Forum Infect Dis. 2016 Aug 30;3(4):ofw178. | PubMed | Lemmenmeier E, Kohler P, Bruderer T, Goldenberger D, Kleger GR, Schlegel M. First documented outbreak of KPC-2-producing Klebsiella pneumoniae in Switzerland: infection control measures and clinical management. Infection. 2014 Jun;42(3):529-34. | CrossRef | PubMed |
Lemmenmeier E, Kohler P, Bruderer T, Goldenberger D, Kleger GR, Schlegel M. First documented outbreak of KPC-2-producing Klebsiella pneumoniae in Switzerland: infection control measures and clinical management. Infection. 2014 Jun;42(3):529-34. | CrossRef | PubMed | Kyle JM, Stollings JL, White KD, Noto MJ, Wheeler AP. Fosfomycin for multidrug treatment of Klebsiella pneumoniae carbapenemase bacteremia. Ann Pharmacother. 2015 Mar;49(3):366-7. | CrossRef | PubMed |
Kyle JM, Stollings JL, White KD, Noto MJ, Wheeler AP. Fosfomycin for multidrug treatment of Klebsiella pneumoniae carbapenemase bacteremia. Ann Pharmacother. 2015 Mar;49(3):366-7. | CrossRef | PubMed | Simkins J, Fan J, Camargo JF, Aragon L, Frederick C. Intravenous Fosfomycin Treatment for Carbapenem-Resistant Klebsiella pneumoniae in the United States. Ann Pharmacother. 2015 Oct;49(10):1177-8. | CrossRef | PubMed |
Simkins J, Fan J, Camargo JF, Aragon L, Frederick C. Intravenous Fosfomycin Treatment for Carbapenem-Resistant Klebsiella pneumoniae in the United States. Ann Pharmacother. 2015 Oct;49(10):1177-8. | CrossRef | PubMed |