La mejor pauta de alimentación en el primer año de vida
The best feeding schedule in the first year of life
María Jesús Rebollo García
Resumen
Este texto completo es una transcripción editada y revisada de una conferencia dictada en el XVII Curso de Extensión de Pediatría, organizado por el Servicio de Pediatría del Hospital Clínico San Borja Arriarán, el Departamento de Pediatría Centro de la Facultad de Medicina de la Universidad de Chile, el Servicio de Salud Metropolitano Central y la Dirección de Atención Primaria. Se realizó entre el 01 de abril y el 25 de noviembre de 2008 y sus directores fueron el Dr. Francisco Barrera y la Dra. Cristina Casado.
Introducción
La pauta de alimentación de un lactante debe cumplir los siguientes requisitos básicos:
- Satisfacer las necesidades de macro y micronutrientes, permitiendo el crecimiento y desarrollo funcional y mental óptimos de acuerdo al potencial genético del individuo.
- Adecuarse a las capacidades de absorción, metabolismo y excreción del lactante, especialmente en los primeros meses de vida.
- Promover buen estado de salud a largo plazo.
- Seguridad.
- Costo asequible para toda la población.
La leche materna, el gold standard de la nutrición infantil
El gold standard de la nutrición del lactante es la leche materna debido a las características que posee: ser específica para la especie humana, diferente a todas las leches de otros mamíferos. Esto condiciona ventajas en distintos aspectos: proporciona los nutrientes necesarios a la etapa de desarrollo del niño, facilita la digestión y absorción de los nutrientes, tiene ventajas inmunológicas, posee factores de crecimiento, promueve la salud a largo plazo, favorece el desarrollo cognitivo del niño, posee ventajas psicológicas tanto para la madre como para el niño y tiene menor costo.
La leche materna satisface las necesidades nutricionales de macro y micronutrientes durante los primeros seis meses de vida, de modo que no es necesario adicionar otros alimentos, agua ni jugos en este periodo. Desde el punto de vista inmunológico, se ha demostrado que disminuye la incidencia y/o gravedad de enfermedades infecciosas como diarrea aguda, infección del tracto respiratorio, otitis media aguda e infección urinaria. En cuanto a la promoción de la salud a largo plazo, tendría un efecto protector contra diabetes tipo 1 y 2, sobrepeso, obesidad e hipercolesterolemia en individuos de alto riesgo y además tendría efecto protector contra la alergia alimentaria, la atopia y la enfermedad celíaca en niños de riesgo. Finalmente, la leche materna favorece el desarrollo cognitivo y disminuye el riesgo de muerte súbita durante el primer año de vida (1).
Cuando no se dispone de leche materna la alternativa es la leche de vaca con la cual se elaboran las fórmulas. En la Tabla I se muestran algunas características cuantitativas de la leche materna y la leche de vaca no modificada. Se puede ver que en cantidad de proteínas la leche de vaca supera tres veces la leche humana y, como se verá más adelante, el tipo de proteínas también es muy diferente. El aporte de grasas es similar en cuanto a cantidad, pero el tipo de grasa es muy distinto en ambos casos, ya que la leche materna tiene preferentemente ácidos grasos poliinsaturados, mientras que la leche de vaca tiene principalmente grasas saturadas. En lo que se refiere a minerales, la leche de vaca tiene por lo menos tres veces más calcio y fósforo que la leche materna; lo mismo ocurre con sodio y potasio. En cuanto el hierro, el aporte es similar en cantidad, pero el hierro de la leche humana tiene mucho mayor biodisponibilidad que el de la leche de vaca, el cual tiene, además, menor absorción. Hay estudios que sugieren que hasta 40% de los lactantes alimentados con leche de vaca no modificada tendrían sangrado microscópico en las deposiciones. La carga renal de solutos también es diferente lo que es importante para el riñón en desarrollo.
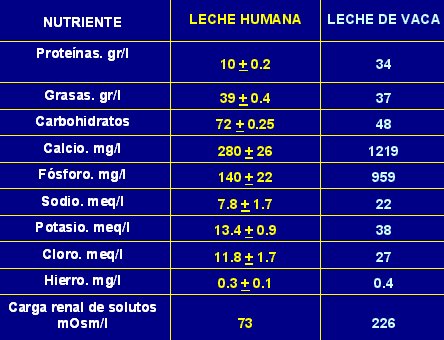
|
| Tabla I. Composición de la leche materna y la leche de vaca no modificada. |
Suplementos para fórmulas según composición de la leche materna
La composición proteica difiere en ambos tipos de leche. La relación caseína/proteína del suero en la leche materna es 40/60 y en la leche de vaca, 80/20. Por otra parte, la leche materna tiene alta concentración de cisteína y taurina y baja concentración de metionina y fenilalanina, en comparación con la leche de vaca.
La taurina, que ha sido uno de los aminoácidos más estudiados, se encuentra en alta concentración en el cerebro en desarrollo y en la retina. Estudios en animales de experimentación han demostrado que el déficit de taurina ocasiona retraso de crecimiento, anomalías en la retina, alteraciones en la osmorregulación del tejido nervioso, en la conjugación de ácidos biliares y anomalías en la absorción de grasa. Por esto, a pesar de que no existe evidencia con base en estudios controlados sobre el beneficio de adicionar taurina a las fórmulas, se recomienda continuar agregando este aminoácido.
El nitrógeno no proteico está en mayor proporción en la leche materna (18 a 30%) que en las leches de otros mamíferos, éste incluye: hormonas y péptidos tróficos, como hormona de crecimiento, hormona tiroidea, insulina, IGF1, factor de crecimiento epidérmico, factor de crecimiento neural, somatostatina y nucleótidos, cuya función es muy importante para las células que se encuentran en rápido crecimiento, como las del intestino y del aparato inmunológico. Estos nucleótidos participan en los procesos de crecimiento, reparación y diferenciación del tracto gastrointestinal, maduración de linfocitos T, activación de macrófagos, células killer y crecimiento de bifidobacterias. La evidencia respecto a la suplementación con nucleótidos en las fórmulas lácteas sugiere que podría mejorar la microbiota intestinal y el nivel de anticuerpos IgG para la vacuna contra el tétanos, si bien los estudios son insuficientes para evaluar efectos a nivel intestinal.
Los ácidos grasos poliinsaturados (PUFA) son ácidos grasos esenciales que el ser humano no puede sintetizar, ya que no puede colocar los dobles enlaces en las posiciones que corresponde. Son dos: el ácido alfa-linolénico (C18:3n-3), precursor de la familia omega-3, que incluye al ácido docosahexaenoico (DHA, C22:6n-3); y el ácido linoleico (C18:2n-6) precursor de la familia omega-6 y del ácido araquidónico (AA, C20:4n-6). Estos ácidos grasos están presentes en la leche materna. El DHA y el AA han sido ampliamente estudiados ya que constituyen los ácidos grasos presentes en mayor cantidad en el tejido nervioso en desarrollo; además, el DHA representa hasta 40% de los ácidos grasos de las membranas de la retina. Los primeros estudios, efectuados en recién nacidos prematuros, demostraron que el aporte de estos ácidos grasos es fundamental para ellos, ya que el beneficio de ambos sobre el desarrollo cognitivo y la función visual está demostrado (2). Estudios más recientes han reportado que los recién nacidos de término también se benefician con el aporte de estos precursores. Se ha demostrado que la ingesta de PUFA y ácidos grasos omega-3 en el embarazo y lactancia tiene efectos favorables sobre el desarrollo cognitivo de los niños, siendo más efectiva la ingesta de DHA preformado que el de su precursor. Por lo tanto la recomendación actual es que la madre embrazada y en lactancia ingiera 200 mg/día de DHA preformado, o pescado dos veces por semana. En el lactante alimentado con fórmula, ésta debe aportar entre 0,2 y 0,5% de DHA y al menos la misma cantidad de AA, el cual debe representar 0,35 a 0,7 % del total de las grasas. La otra conclusión del grupo de expertos que se reunió e hizo estas recomendaciones es que parece razonable continuar el aporte de PUFA en la dieta del lactante durante el segundo semestre de la vida (3).
Los probióticos se definen, según la OMS, como microorganismos vivos que cuando se consumen en cantidades adecuadas son beneficiosos para la salud del huésped. Las acciones de los probióticos son muchas, pero entre las más importantes se cuentan: refuerzo de mecanismos inmunológicos (respuesta humoral), modulación de la respuesta inmune (Th1 – Th2), mejoramiento de la barrera intestinal y estimulación de la síntesis de IgA. Entre los efectos de los probióticos que se han documentado mediante estudios clínicos están: disminución de la incidencia de diarrea aguda (4, 5, 6, 7); disminución de la gravedad de la diarrea (8, 9, 10, 11, 12); prevención de la dermatitis atópica (13); disminución de la gravedad de la dermatitis atópica (14,15) y un efecto beneficioso en la prevención de la enterocolitis necrotizante (16, 17). En un estudio reciente el suplemento con probióticos no previno infecciones, pero mejoró la capacidad de respuesta frente a los antígenos proteicos de las vacunas durante los primeros meses de vida (18). Con respecto a la adición de probióticos en las fórmulas lácteas, los estudios demuestran que algunas cepas son seguras, pero no está clara la concentración ni la dosis que se debe utilizar, ni el grado de viabilidad que mantiene el probiótico en la fórmula.
Los prebióticos son alimentos, especialmente hidratos de carbono, que no son absorbidos por el intestino y promueven el crecimiento de las bacterias probióticas. Los estudios clínicos sobre sus beneficios sugieren que en los niños alimentados con fórmulas suplementadas con prebióticos aumenta la cantidad de bífidobacterias en las deposiciones, disminuyen los episodios de diarrea aguda y mejora la viscosidad y el tránsito de las deposiciones.
Composición de las fórmulas lácteas
Dado que el gold standard es la leche materna, se ha tratado de que las fórmulas lácteas se parezcan lo más posible a ella. Existen normativas a nivel internacional que regulan el contenido de macro y micronutrientes de las fórmulas elaboradas a partir de leche de vaca modificada (FDA, FAO/OMS, Codex alimentarius, EPSGAN, Reglamento sanitario de los alimentos), las cuales se clasifican en fórmulas de inicio y fórmulas de continuación. Las fórmulas de inicio son aquellas en las cuales el contenido de energía y nutrientes se ajusta al de la leche materna, considerando un aumento por menor biodisponibilidad; tienen en cuenta no exceder la capacidad absortiva ni excretora del lactante y se indican en los primeros seis meses, en aquellos niños que no pueden recibir lactancia materna. Las fórmulas de continuación consideran los requerimientos nutricionales del segundo semestre de la vida, tienen menos modificaciones que las de inicio y no se ajustan a la capacidad metabólica del lactante, ya que se considera que a partir de los seis meses el niño tiene suficiente capacidad gastrointestinal y renal para recibir una fórmula no modificada.
En la Tabla II se compara la leche materna con los rangos que recomiendan los organismos internacionales y el Codex alimentario para las fórmulas de inicio, y con la leche Purita fortificada (LPF) preparada al 7,5 % con agregado de 2,5% de maltosa dextrina o azúcar y 2% de aceite vegetal, que en lo posible debe aportar ácidos grasos poliinsaturados omega-3 (aceite de soya o canola). En energía no hay mucha diferencia, pero sí la hay en cantidad de proteínas, ya que la LPF tiene el doble en relación al patrón, que es la leche materna. El tipo de ácidos grasos presenta gran diferencia. En calcio, fósforo y sodio la LPF también se excede, en cambio es adecuada en vitamina C, hierro, zinc y cobre, ya que se encuentra fortificada con micronutrientes.
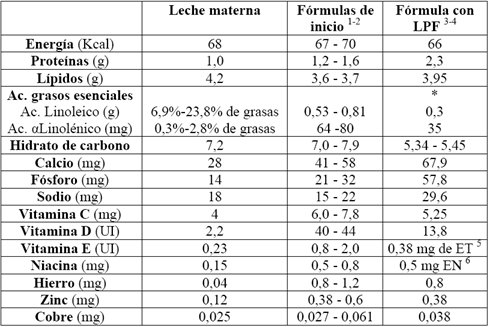
|
| Tabla II. Composición nutricional de fórmulas para lactantes de 0 a 5 meses, por 100 ml. LPF = Leche Purita fortificada. |
En la siguiente tabla se muestran las principales fórmulas de inicio disponibles en Chile en el comercio, comparadas con la leche materna y la recomendación ESPHGAN de nutrientes.
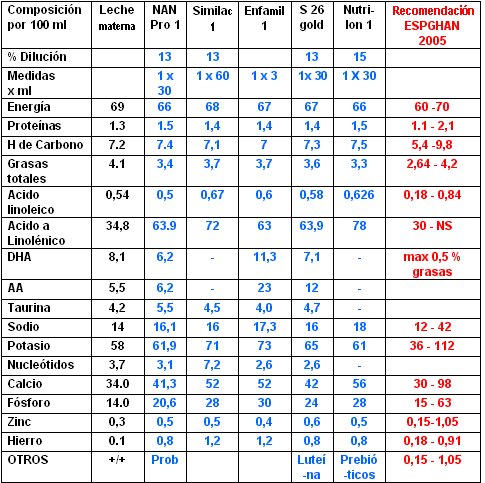
|
| Tabla III. Comparación de fórmulas lácteas disponibles en Chile con leche materna y recomendación ESPGHAN 2005. |
Alimentación complementaria
Se entiende por alimentación complementaria todos aquellos alimentos sólidos o líquidos, excluyendo leche materna y fórmulas lácteas. Esta no es la definición de la OMS, que establece como alimentación complementaria cualquier alimento que no sea leche materna, pero es difícil trabajar con esa definición.
El momento óptimo para la introducción de la alimentación complementaria ha sido establecido por la OMS a la edad de seis meses, con base en aspectos nutricionales y aspectos no nutricionales. Los primeros consideran que la cantidad de leche que produce una madre cuando el niño tiene seis meses es de 600 a 700 ml y si se analiza la necesidad de energía y otros nutrientes como proteínas, hierro, zinc y vitaminas A y D de un niño de esa edad, se encuentra que el aporte podría ser insuficiente. Con respecto a los aspectos no nutricionales, el niño entre los cuatro y seis meses desarrolla ciertas habilidades motoras que le permiten recibir otros tipos de alimentos: pierde el reflejo de extrusión de la lengua, que permite a los lactantes pequeños evitar que entren cosas distintas de la leche; tiene una masticación rudimentaria; la lengua toma un posición más posterior dentro de la boca y desarrolla percepción de sabores y texturas; finalmente, a partir de los cuatro meses hay una maduración de la función renal y gastrointestinal. La EPSHGAN establece que la edad de introducción es entre los cuatro y seis meses, estudios efectuados al respecto no demostraron diferencia en la velocidad de crecimiento al introducir la alimentación complementaria a los cuatro meses versus los seis meses en niños con lactancia exclusiva. En cambio los niños que iniciaron la alimentación complementaria a los seis meses tuvieron menos morbilidad en cuanto a enfermedades infecciosas gastrointestinales, aunque se ha planteado que esto se debería a que los estudios se hicieron en países en vías de desarrollo, que no representan la realidad de la mayoría de los países de Europa.
En Chile se mantiene la normativa contenida en la guía MINSAL 2005, que establece que se debe introducir a los seis meses una papilla que contenga verduras, cereales, carne y aceite vegetal, el cual debe contener ácidos grasos poliinsaturados, la cantidad debe ir en aumento progresivo hasta 150 ml; como postre el niño debe recibir frutas crudas o cocidas; la segunda comida se introduce dos meses después de la primera; las legumbres se incorporan a los 8 meses y el pescado y los huevos, a partir de los 10 meses. Si existen antecedentes de alergia alimentaria se sugiere postergar la introducción de pescado y huevos hasta después del año y en lo mismo en caso de antecedente de enfermedad celíaca, en que se recomienda posponer el consumo de gluten hasta después del año de edad.
Los efectos sobre la salud a largo plazo de la alimentación complementaria se han documentado en varios aspectos:
- La alta densidad de energía de la alimentación complementaria, mayor de 1 caloría por ml, se asocia a mayor riesgo de obesidad en el escolar.
- Las dietas con alto contenido de proteínas, con P% >16 ó más de 4 g/kg/día de proteínas, también se asocian con sobrepeso a los siete años, probablemente por estimulación de factores hormonales como insulina, IGg-1 y adipocitos en este periodo de la vida.
- En cuanto a prevención de alergia en niños de riesgo, que son aquellos que tienen hermanos o padres con alergia o atopia, la única evidencia consistente es que la lactancia materna por cuatro a seis meses los protege. No hay evidencia sobre el beneficio de retardar la introducción de alimentos específicos en estos pacientes.
- Respecto al riesgo cardiovascular, se ha documentado la relación entre agregado de sal en el periodo de lactante y aumento del riesgo de hipertensión arterial en la adolescencia, y se ha planteado que el periodo de lactante sería especialmente vulnerable a la sal.
- Respecto a enfermedad celíaca, los estudios demuestran que el riesgo en pacientes susceptibles disminuye si el gluten se introduce mientras el niño está recibiendo lactancia materna (19).
Suplementos nutricionales
Se mantiene el aporte de vitamina K a todos los recién nacidos.
La vitamina D está en cantidad de 20 U/litro en la leche materna, por lo tanto el niño depende de los depósitos aportados por la madre durante el embarazo, que duran alrededor de dos meses y de su síntesis a partir de la luz ultravioleta. Como las recomendaciones no pueden ser individuales ni considerar el lugar donde vive el niño ni la época del año, se recomienda aportar 200 UI por día de vitamina D (cantidad actualmente en revisión) en aquellos niños que reciben lactancia materna o fórmulas no suplementadas con vitamina D, o en aquellos que reciben fórmula suplementada, pero menos de 500 ml/día. Este aporte se debe hacer desde el mes hasta el año de edad.
En cuanto al hierro, se discute si es necesario suplementar al niño con lactancia materna. El hierro de la leche materna tiene buena biodisponibilidad, pero contiene alrededor de 0,55 mg/L y el lactante en los primeros meses requiere 0,5 a 0,7 mg diarios, por lo tanto va a depender de los depósitos de hierro que tenga en el hígado. Como se ha documentado que el déficit de hierro y la anemia producen alteraciones a nivel del desarrollo psicomotor y cognitivo en los niños menores de dos años, la recomendación en los recién nacidos de término es aportar, a partir de los cuatro meses de edad, 1 a 2 mg/k/día desde los cuatro meses hasta el año de edad. Las fórmulas de inicio o continuación no requieren ningún suplemento, siempre y cuando el niño consuma más de 500 ml al día.
Conclusiones
- La leche materna exclusiva es el alimento de elección durante los primeros seis meses de vida.
- Si no se cuenta con leche materna o esta es insuficiente de debe usar fórmula modificada de inicio o continuación y si no es posible, leche Purita fortificada.
- La alimentación complementaria se debe iniciar a partir de los cuatro a seis meses, procurando no exceder los aportes de energía, proteínas y sal.
- El aporte de PUFA se debe iniciar en el embarazo y mantener el primer año de vida.
Referencias
- Gartner LM, Morton J, Lawrence RA, Naylor AJ, O'Hare D, Schanler RJ, et al. Breastfeeding and the use of human milk. Pediatrics. 2005 Feb;115(2):496-506. | CrossRef | PubMed |
- Uauy R, Hoffman DR, Mena P, Llanos A, Birch EE. Term infant studies of DHA and ARA supplementation on neurodevelopment: results of randomized controlled trials. J Pediatr. 2003 Oct;143(4 Suppl):S17-25. | CrossRef | PubMed |
- Koletzko B, Lien E, Agostoni C, Böhles H, Campoy C, Cetin I, et al. The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations. J Perinat Med. 2008;36(1):5-14. | CrossRef | PubMed |
- Ziegler E, Jeter J, Drulis J, Nelson S, Haschke F, Steenhout P, et al. Formula with reduced content of improved, partially hydrolyzed protein and probiotics: infant growth and health. Monatsschrift Kinderheilkunde. 2003 Dic;151(1 Suppl):S65-S71. | CrossRef | Link |
- Weizman Z, Asli G, Alsheikh A. Effect of a probiotic infant formula on infections in child care centers: comparison of two probiotic agents. Pediatrics. 2005 Jan;115(1):5-9. | PubMed |
- Sazawal S, Hiremath G, Dhingra U, Malik P, Deb S, Black RE. Efficacy of probiotics in prevention of acute diarrhoea: a meta-analysis of masked, randomised, placebo-controlled trials. Lancet Infect Dis. 2006 Jun;6(6):374-82. | CrossRef | PubMed |
- Szajewska H, Mrukowicz JZ. Probiotics in the treatment and prevention of acute infectious diarrhea in infants and children: a systematic review of published randomized, double-blind, placebo-controlled trials. J Pediatr Gastroenterol Nutr. 2001 Oct;33 Suppl 2:S17-25. | CrossRef | PubMed |
- Chouraqui JP, Van Egroo LD, Fichot MC. Acidified milk formula supplemented with bifidobacterium lactis: impact on infant diarrhea in residential care settings. J Pediatr Gastroenterol Nutr. 2004 Mar;38(3):288-92. | CrossRef | PubMed |
- Saran S, Gopalan S, Krishna TP. Use of fermented foods to combat stunting and failure to thrive. Nutrition. 2002 May;18(5):393-6. | CrossRef | PubMed |
- Rosenfeldt V, Michaelsen KF, Jakobsen M, Larsen CN, Møller PL, Pedersen P, et al. Effect of probiotic Lactobacillus strains in young children hospitalized with acute diarrhea. Pediatr Infect Dis J. 2002 May;21(5):411-6. | CrossRef | PubMed |
- Kurugöl Z, Koturoðlu G. Effects of Saccharomyces boulardii in children with acute diarrhoea. Acta Paediatr. 2005 Jan;94(1):44-7. | CrossRef | PubMed |
- Pashapour N, Iou SG. Evaluation of yogurt effect on acute diarrhea in 6-24-month-old hospitalized infants. Turk J Pediatr. 2006 Apr-Jun;48(2):115-8. | PubMed |
- Kalliomäki M, Salminen S, Poussa T, Arvilommi H, Isolauri E. Probiotics and prevention of atopic disease: 4-year follow-up of a randomised placebo-controlled trial. Lancet. 2003 May 31;361(9372):1869-71. | CrossRef | PubMed |
- Weston S, Halbert A, Richmond P, Prescott SL. Effects of probiotics on atopic dermatitis: a randomised controlled trial. Arch Dis Child. 2005 Sep;90(9):892-7. Epub 2005 Apr 29. | CrossRef | PubMed | PMC |
- Sistek D, Kelly R, Wickens K, Stanley T, Fitzharris P, Crane J. Is the effect of probiotics on atopic dermatitis confined to food sensitized children? Clin Exp Allergy. 2006 May;36(5):629-33. | CrossRef | PubMed |
- Bin-Nun A, Bromiker R, Wilschanski M, Kaplan M, Rudensky B, Caplan M, et al. Oral probiotics prevent necrotizing enterocolitis in very low birth weight neonates. J Pediatr. 2005 Aug;147(2):192-6. | CrossRef | PubMed |
- Lin HC, Su BH, Chen AC, Lin TW, Tsai CH, Yeh TF, et al. Oral probiotics reduce the incidence and severity of necrotizing enterocolitis in very low birth weight infants. Pediatrics. 2005 Jan;115(1):1-4. | PubMed |
- West CE, Gothefors L, Granström M, Käyhty H, Hammarström ML, Hernell O. Effects of feeding probiotics during weaning on infections and antibody responses to diphtheria, tetanus and Hib vaccines. Pediatr Allergy Immunol. 2008 Feb;19(1):53-60. Epub 2007 Dec 11. | CrossRef | PubMed |
- Agostoni C, Decsi T, Fewtrell M, Goulet O, Kolacek S, Koletzko B, et al. Complementary feeding: a commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2008 Jan;46(1):99-110. | CrossRef | PubMed |
 Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
Esta obra de Medwave está bajo una licencia Creative Commons Atribución-NoComercial 3.0 Unported. Esta licencia permite el uso, distribución y reproducción del artículo en cualquier medio, siempre y cuando se otorgue el crédito correspondiente al autor del artículo y al medio en que se publica, en este caso, Medwave.
ISSN 0717-6384